- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Получение SnCl4 презентация
Содержание
- 1. Получение SnCl4
- 2. Немного о SnCl4 Бесцветная маслянистая жидкость Хороший
- 3. Кратко: SnCl4 + 2Cl2 = SnCl4 2KMnO4
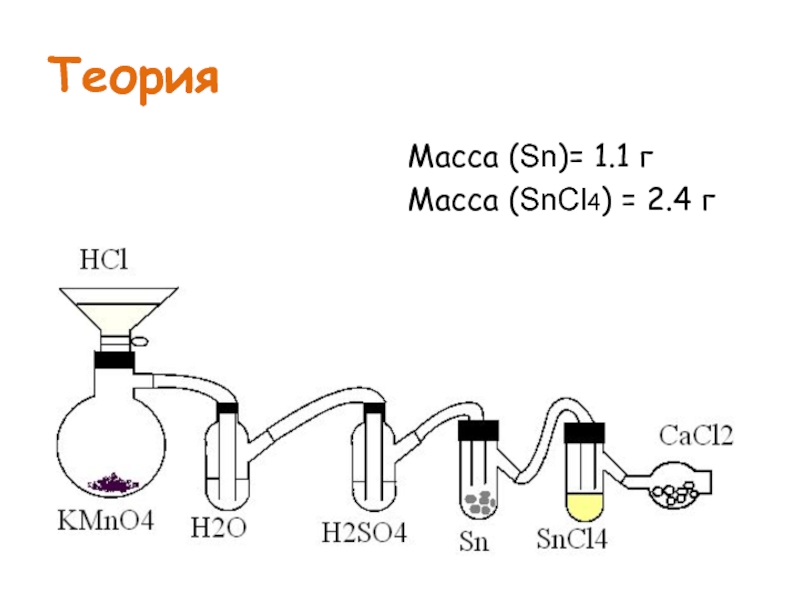
- 4. Теория Масса (Sn)= 1.1 г Масса (SnCl4) = 2.4 г
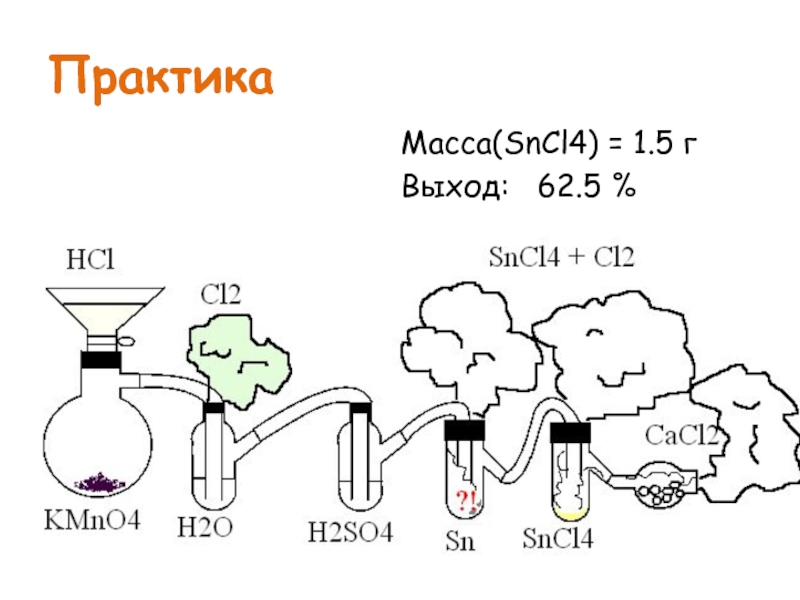
- 5. Практика Масса(SnCl4) = 1.5 г Выход: 62.5 %
- 6. Результаты Получили раствор Cl2 в SnCl4 желтоватого цвета Выход: 62.5 % Подышали хлором ☺
Слайд 2Немного о SnCl4
Бесцветная маслянистая жидкость
Хороший неполярный растворитель
Средний окислитель
Реакции:
SnCl4 +
4NaOH(p) = SnO2 + 2H2O + 4NaCl
SnCl4 + 6NaOH(к) = Na2[Sn(OH)6] + 4NaCl
SnCl4 + 4 NH3*H2O = SnO2 + 4NH4Cl + 2H2O
SnCl4 + 6NaOH(к) = Na2[Sn(OH)6] + 4NaCl
SnCl4 + 4 NH3*H2O = SnO2 + 4NH4Cl + 2H2O