- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Получение и химические свойства кислорода презентация
Содержание
- 1. Получение и химические свойства кислорода
- 2. Цели и задачи урока: Выяснить источник кислорода
- 3. * Способы получения кислорода
- 4. 3) В лаборатории кислород получают
- 5. Разложение перекиси водорода в присутствии оксида марганца (IV)
- 6. ! Катализатор – вещество, которое изменяет
- 7. * в) перманганата калия при нагревании:
- 8. Как проверить, собрался ли кислород в сосуде? Подумайте …
- 9. * Проверка собравшегося кислорода
- 10. * Химические свойства кислорода Допишите уравнения реакций:
- 11. Химические свойства кислорода
- 12. Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород
- 13. Названия оксидов Слово «оксид» + название
- 14. Реакции с участием кислорода Реакции взаимодействия веществ
- 15. Домашнее задание §§ 33,34 (конспект) №№ 2, 5 стр. 111 (после § 34)
Слайд 2Цели и задачи урока:
Выяснить источник кислорода в природе; познакомиться с лабораторными
и промышленными способами получения кислорода
Познакомиться с понятием о катализаторе
Познакомиться с важнейшими химическими свойствами кислорода
Научиться давать названия оксидам
Познакомиться с понятием о катализаторе
Познакомиться с важнейшими химическими свойствами кислорода
Научиться давать названия оксидам
Слайд 3*
Способы получения кислорода
1) В природе кислород образуется
в процессе фотосинтеза
2) В промышленности его получают перегонкой сжиженного воздуха при t = - 1830 С
2) В промышленности его получают перегонкой сжиженного воздуха при t = - 1830 С
Слайд 4
3) В лаборатории кислород получают реакциями разложения:
а) воды под действием
электрического тока (электролиз):
2H2O → 2H2 + O2
б) пероксида водорода под действием MnO2:
MnO2
2Н2О2 → 2Н2О + О2
2H2O → 2H2 + O2
б) пероксида водорода под действием MnO2:
MnO2
2Н2О2 → 2Н2О + О2
Слайд 7*
в) перманганата калия при нагревании:
2KMnO4 →
K2MnO4 + MnO2 + O2
Разложение этой соли идёт при нагревании её
выше 2000 С
Слайд 10*
Химические свойства кислорода
Допишите уравнения реакций:
Ca + O2 →
Na + O2
→
Al + O2 →
S + O2 →
H2S + O2 →
CH4 + O2→
Al + O2 →
S + O2 →
H2S + O2 →
CH4 + O2→
Слайд 12Оксиды – это сложные вещества, состоящие из двух элементов, одним из
которых является кислород
Слайд 13Названия оксидов
Слово «оксид»
+ название элемента в родительном падеже
+ валентность
элемента в данном оксиде (если она переменная)
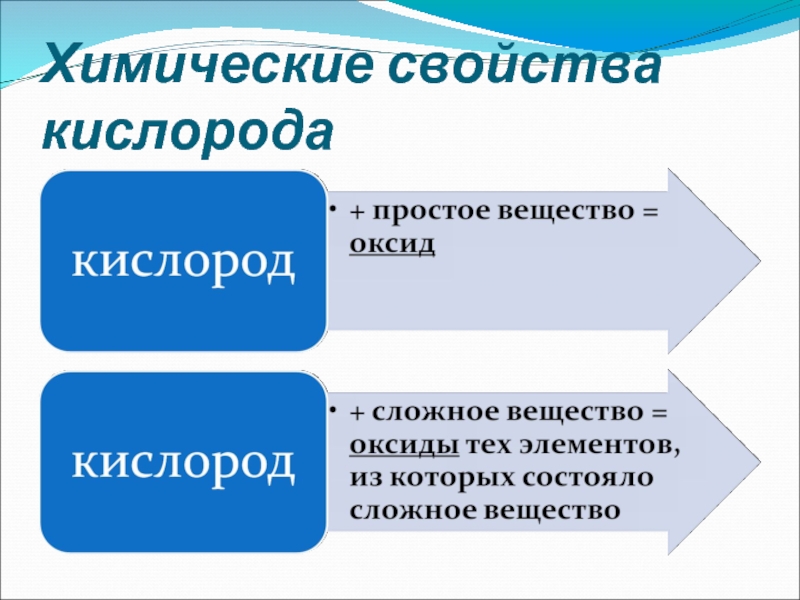
Слайд 14Реакции с участием кислорода
Реакции взаимодействия веществ с кислородом относятся к реакциям
окисления
Реакции взаимодействия веществ с кислородом, протекающие с выделением большого количества тепла и света, называются реакциями горения