- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКАНОВ презентация
Содержание
- 1. ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКАНОВ
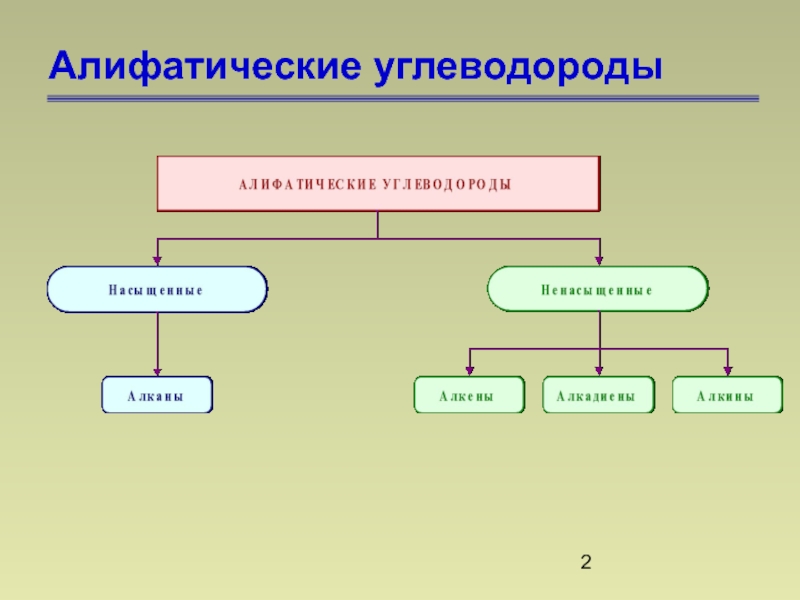
- 2. Алифатические углеводороды
- 3. Алканы Алканами называются насыщенные углеводороды, молекулы
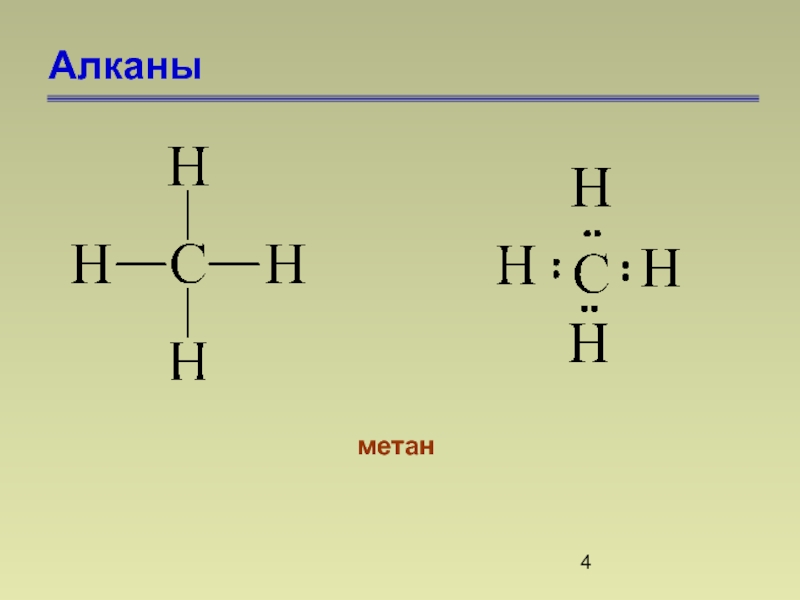
- 4. Алканы метан
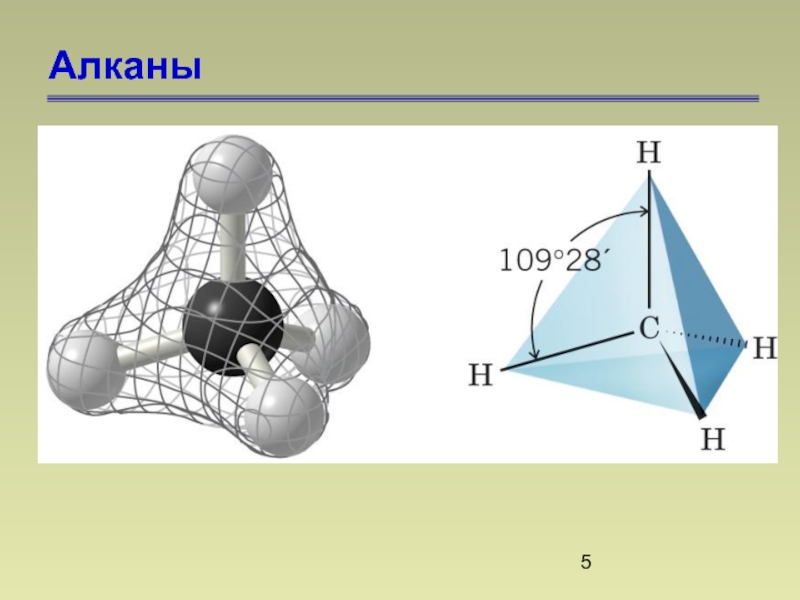
- 5. Алканы
- 6. Алканы СnН2n+2
- 7. Алканы. Номенклатура. Названия нормальных алканов по заместительной номенклатуре
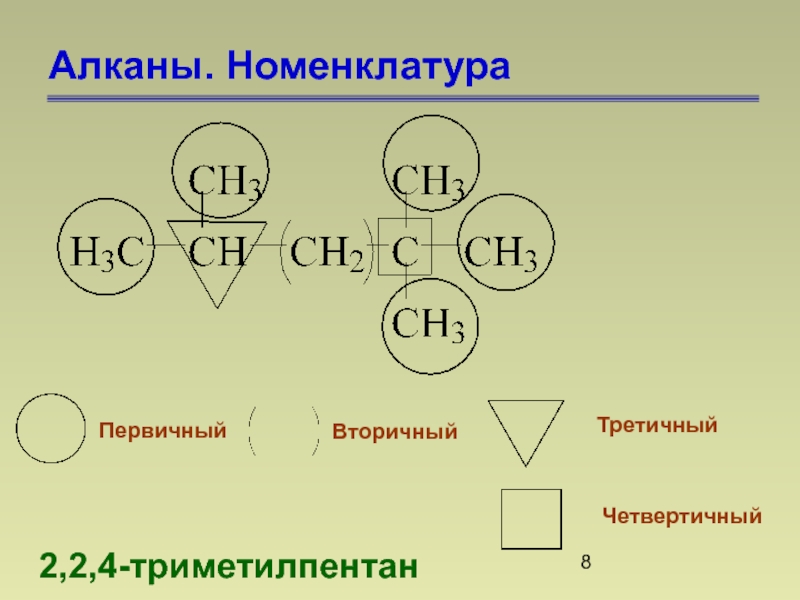
- 8. Алканы. Номенклатура 2,2,4-триметилпентан Первичный Вторичный Третичный Четвертичный
- 9. Алканы. Номенклатура
- 10. Алканы. Номенклатура 1) определяют самую длинную
- 11. Алканы. Номенклатура 4) при наличии двух
- 12. Алканы. Номенклатура 3,5-диметил-3-этилоктан
- 13. Алканы. Номенклатура 2,3,4-триметилпентан
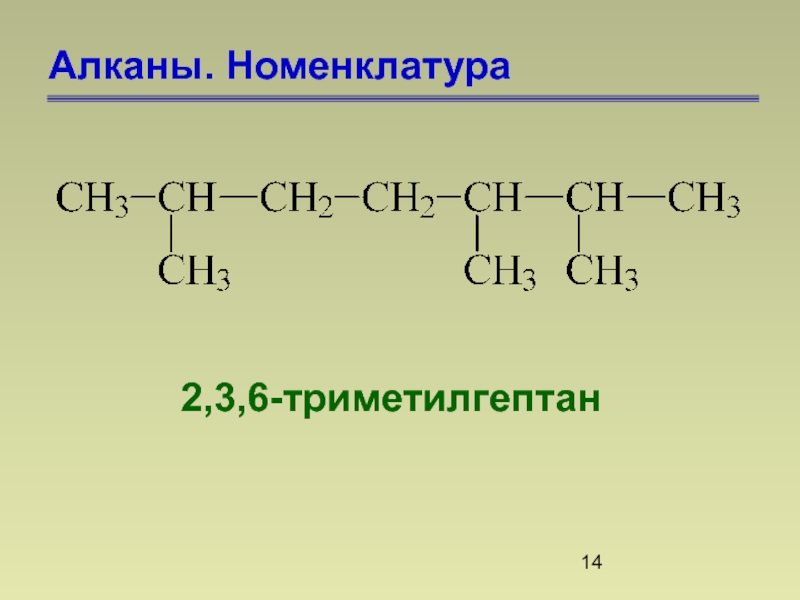
- 14. Алканы. Номенклатура 2,3,6-триметилгептан
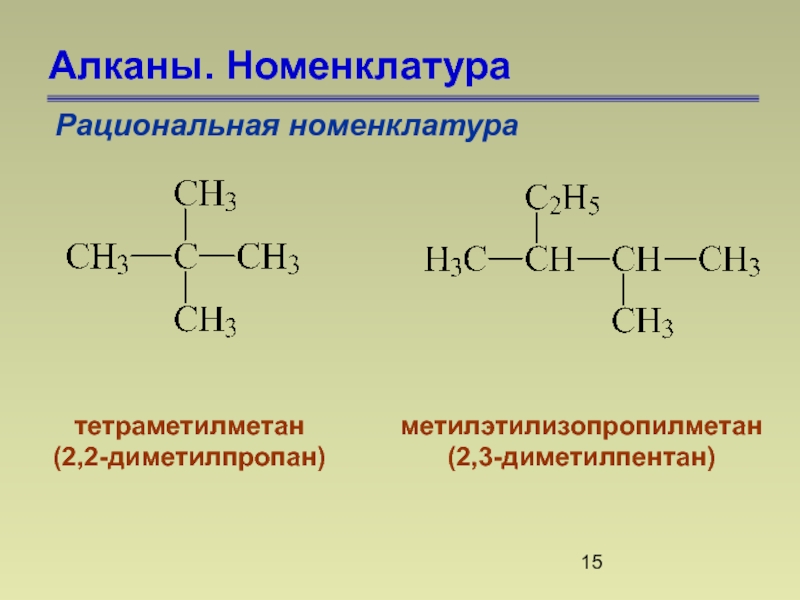
- 15. Алканы. Номенклатура Рациональная номенклатура тетраметилметан (2,2-диметилпропан) метилэтилизопропилметан (2,3-диметилпентан)
- 16. Алканы. Номенклатура Структурная изомерия
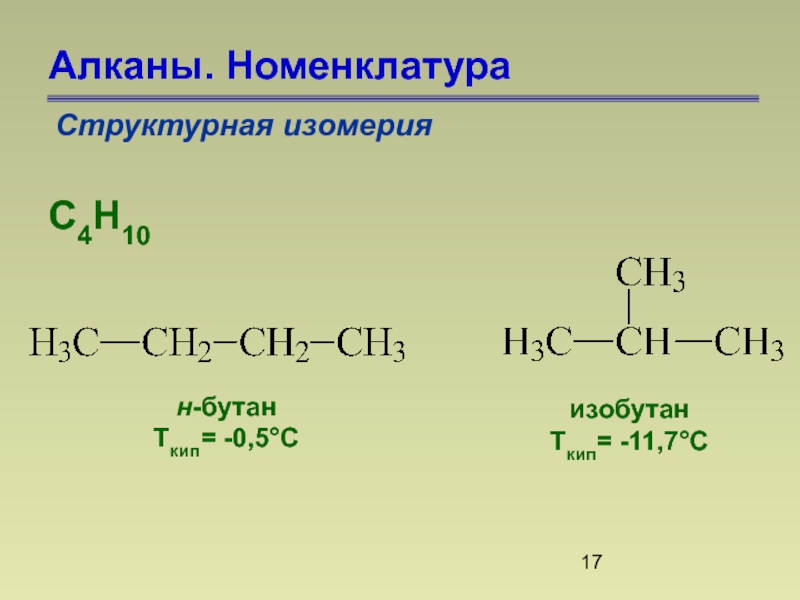
- 17. Алканы. Номенклатура Структурная изомерия С4Н10 н-бутан Ткип= -0,5°С изобутан Ткип= -11,7°С
- 18. Алканы. Номенклатура Структурная изомерия С5Н12 пентан
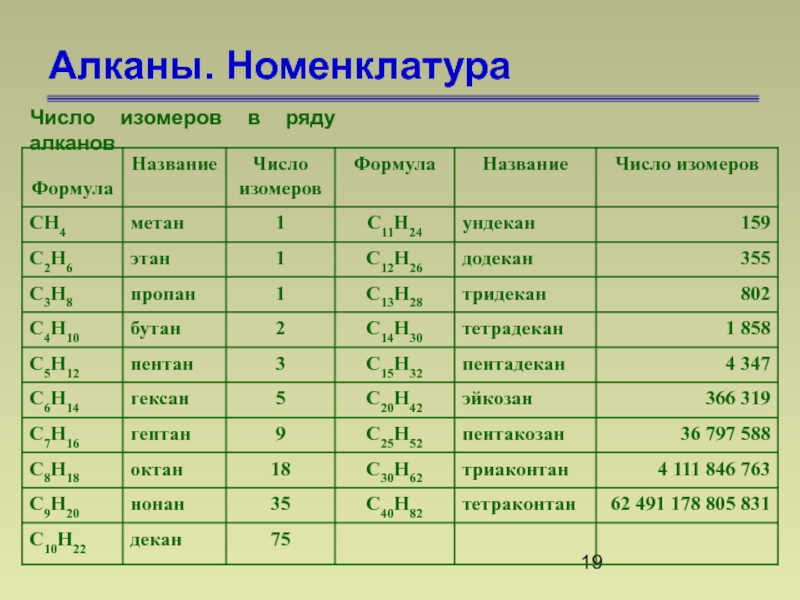
- 19. Алканы. Номенклатура Число изомеров в ряду алканов
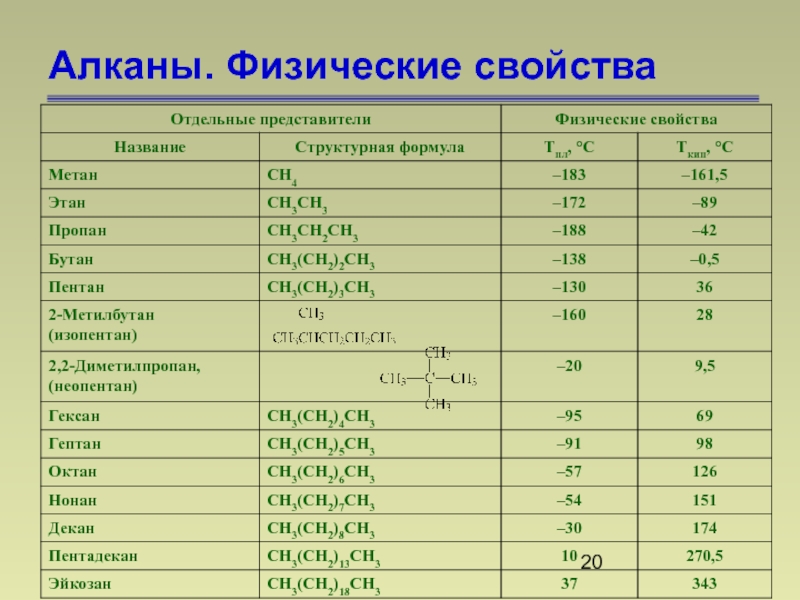
- 20. Алканы. Физические свойства
- 21. Алканы. Физические свойства Зависимость температуры
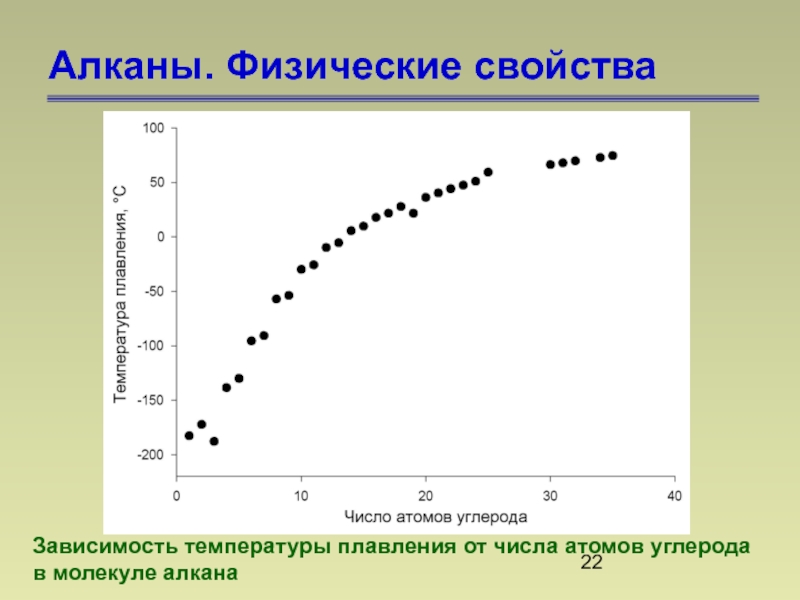
- 22. Алканы. Физические свойства Зависимость температуры
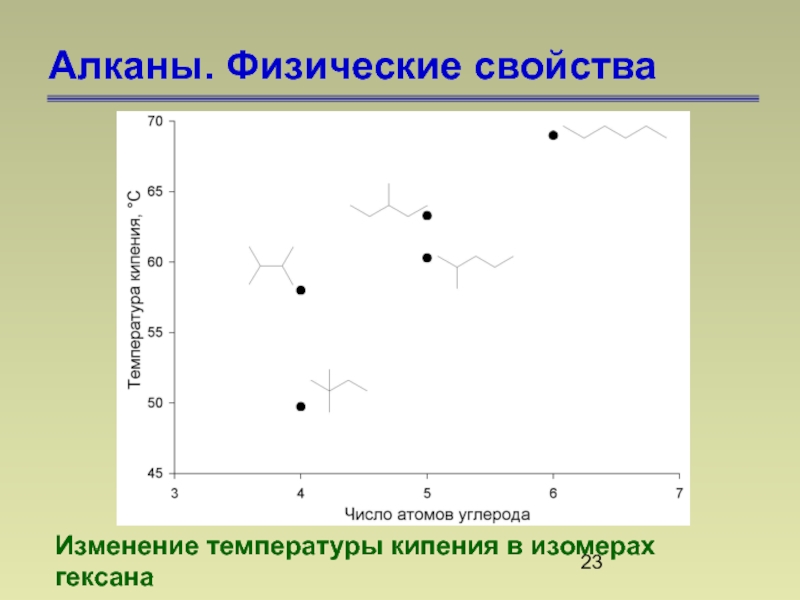
- 23. Алканы. Физические свойства Изменение температуры кипения в изомерах гексана
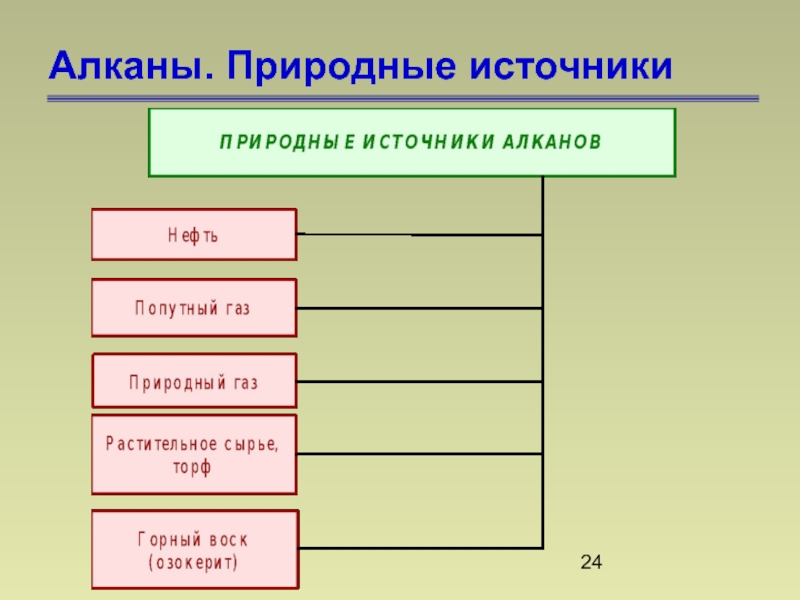
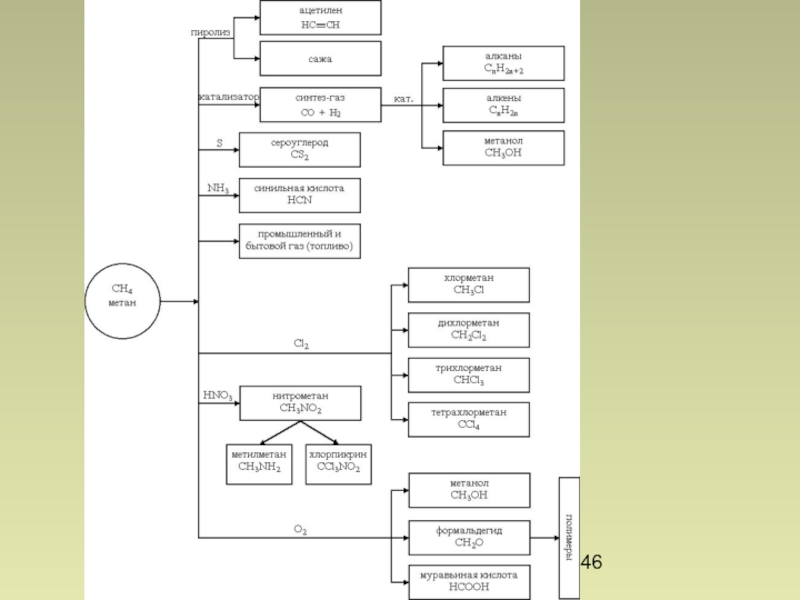
- 24. Алканы. Природные источники
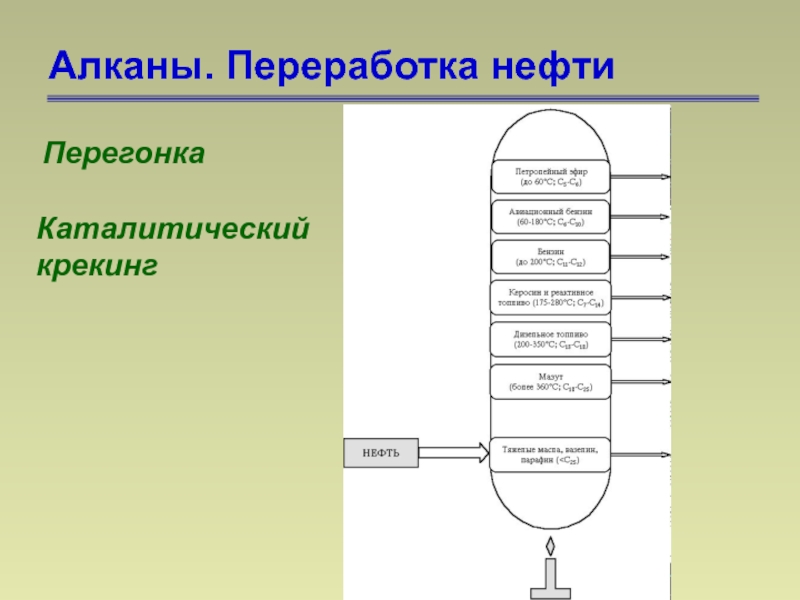
- 25. Алканы. Переработка нефти Перегонка Каталитический крекинг
- 26. Алканы. Способы получения Газофикация угля (Бертло, 1869) Сжижение угля
- 27. Алканы. Способы получения Получение из ненасыщенных углеводородов Получение из галогенопроизводных
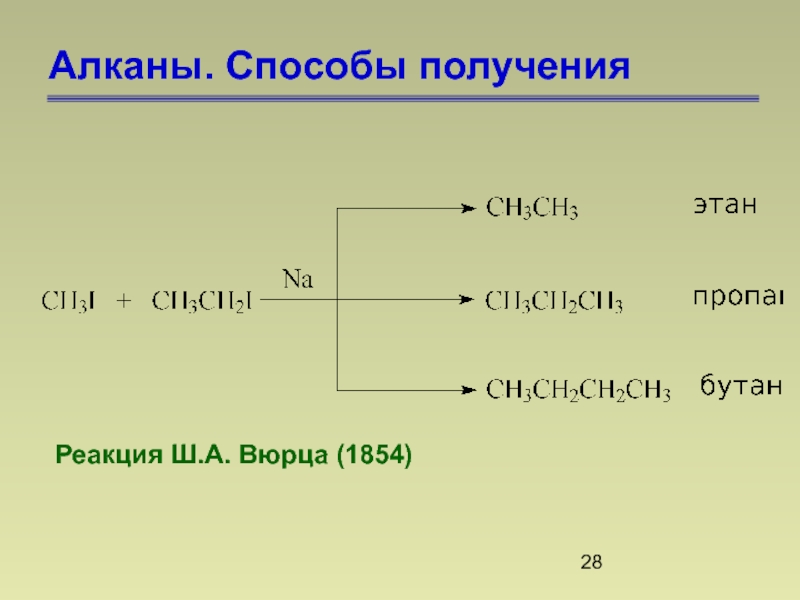
- 28. Алканы. Способы получения Реакция Ш.А. Вюрца (1854)
- 29. Алканы. Способы получения Восстановление галогеналканов
- 30. Алканы. Способы получения Получение из солей
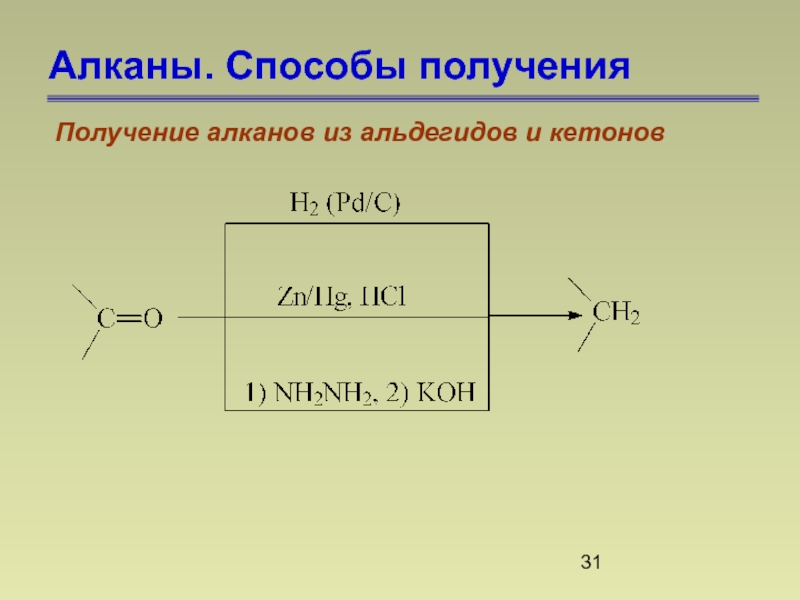
- 31. Алканы. Способы получения Получение алканов из альдегидов и кетонов
- 32. Алканы. Способы получения Гидролиз карбидов металлов
- 33. Алканы. Химические свойства Галогенирование
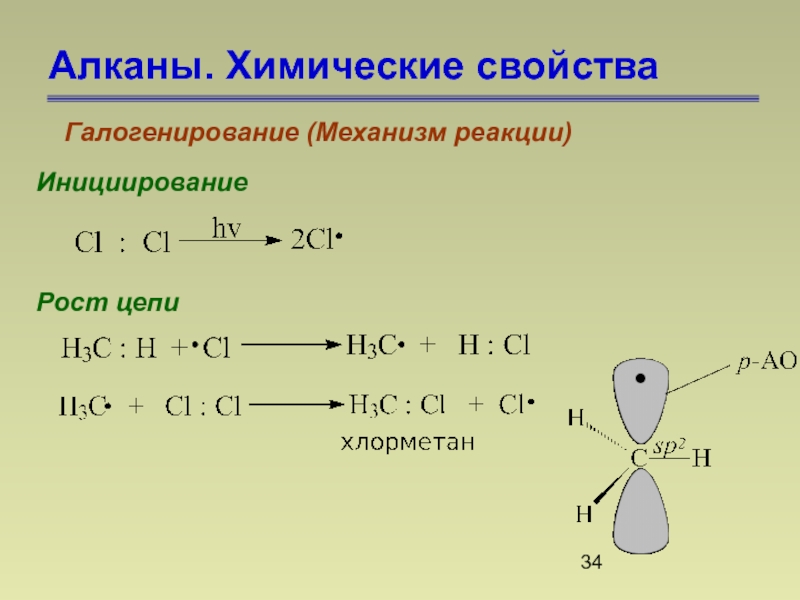
- 34. Алканы. Химические свойства Галогенирование (Механизм реакции) Инициирование Рост цепи
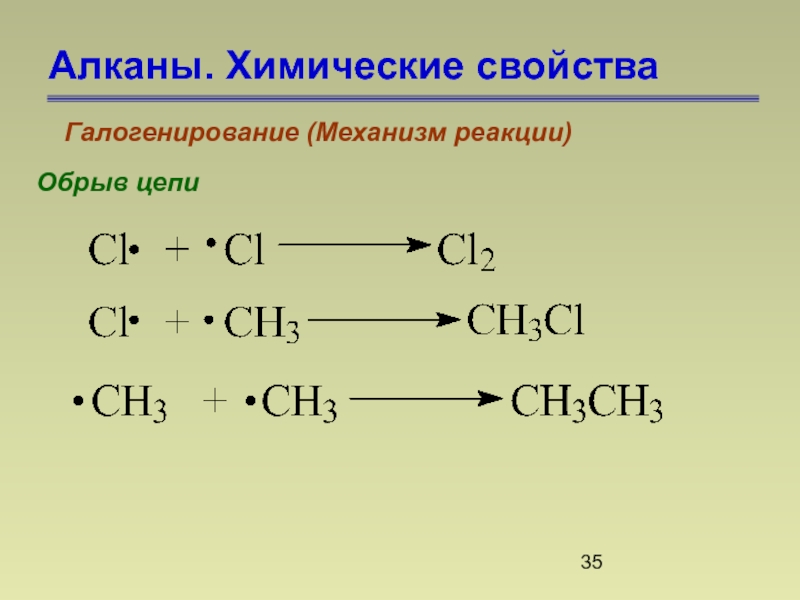
- 35. Алканы. Химические свойства Галогенирование (Механизм реакции) Обрыв цепи
- 36. Алканы. Химические свойства Галогенирование (Механизм реакции)
- 37. Алканы. Химические свойства Галогенирование (Механизм реакции)
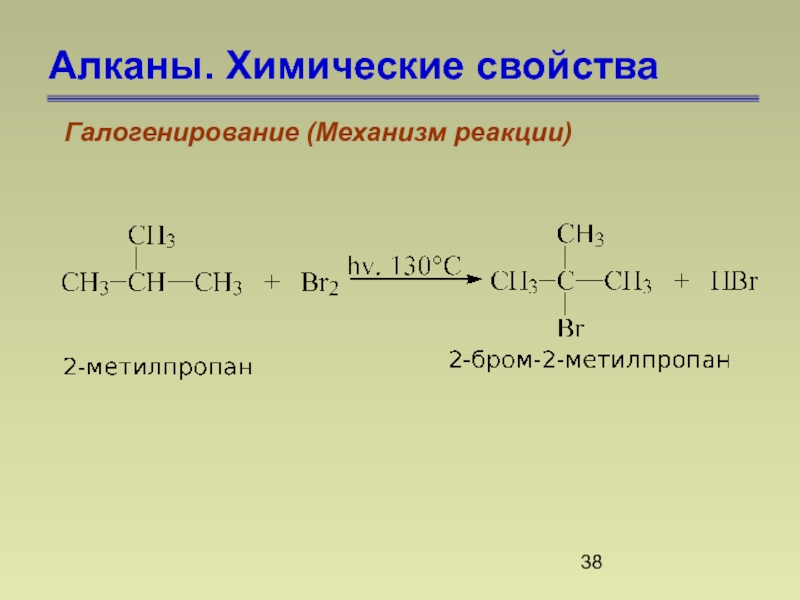
- 38. Алканы. Химические свойства Галогенирование (Механизм реакции)
- 39. Алканы. Химические свойства Сульфохлорирование
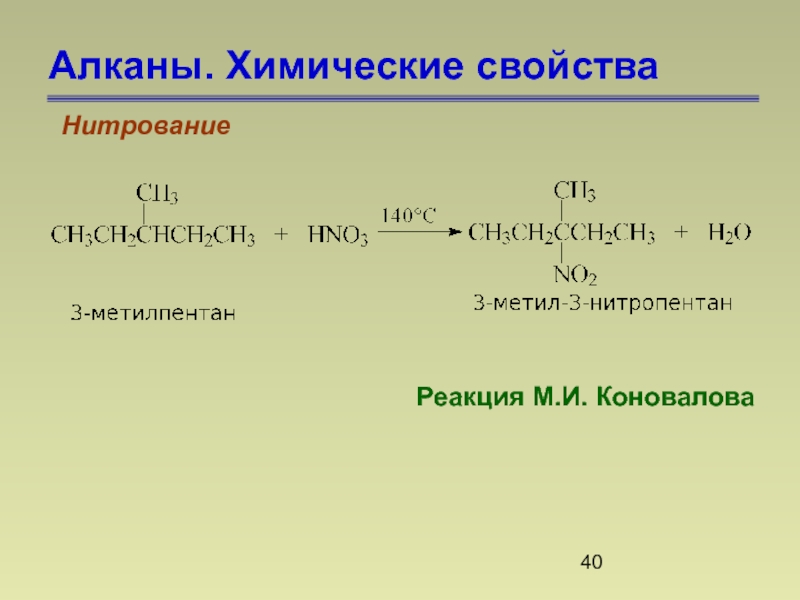
- 40. Алканы. Химические свойства Нитрование Реакция М.И. Коновалова
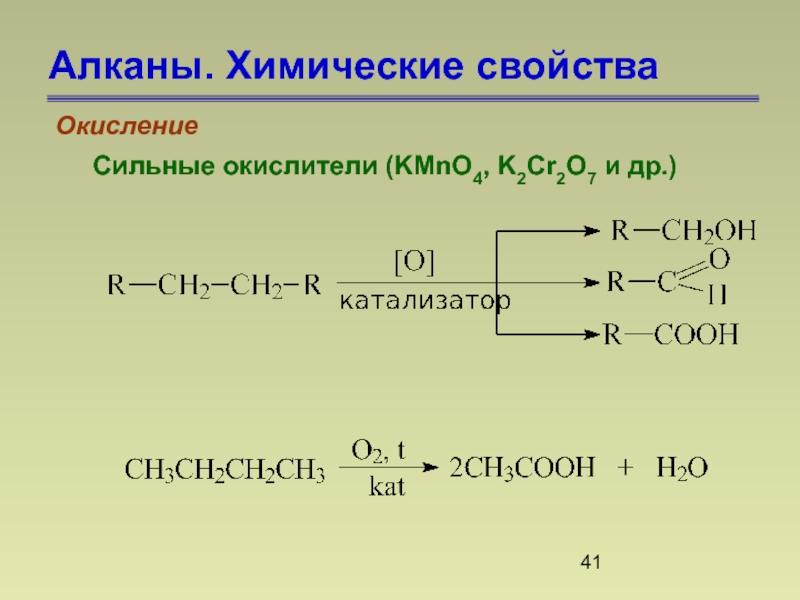
- 41. Алканы. Химические свойства Окисление Сильные окислители (KMnO4, K2Cr2O7 и др.)
- 42. Алканы. Химические свойства Окисление
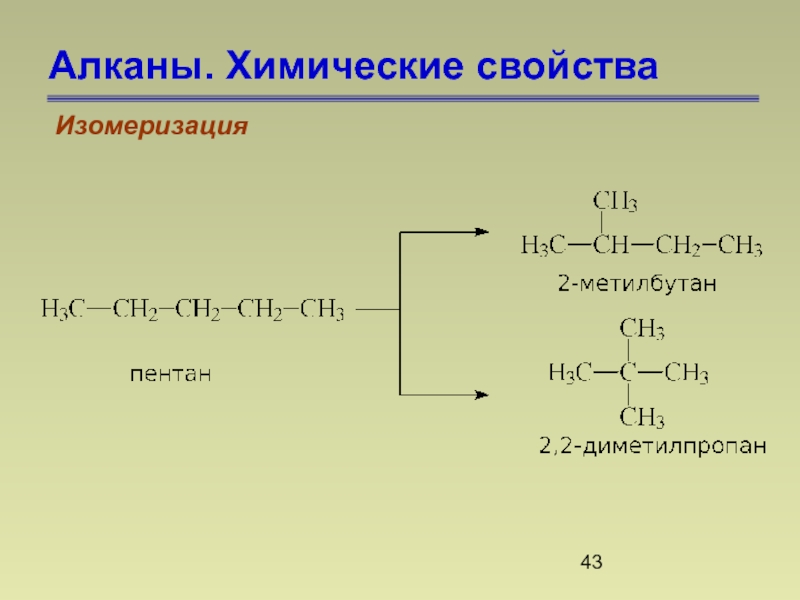
- 43. Алканы. Химические свойства Изомеризация
- 44. Алканы. Химические свойства Термическое разложение
- 45. Алканы. Химические свойства Каталитический крекинг
Слайд 3Алканы
Алканами называются насыщенные углеводороды, молекулы которых состоят из атомов углерода и
Слайд 10Алканы. Номенклатура
1) определяют самую длинную цепь атомов углерода. Число атомов углерода
2) нумеруют главную цепь с того конца, ближе к которому находится заместитель (углеводородный радикал);
3) перед основой названия указывают цифровой номер того атома углерода в главной цепи, у которого находится заместитель, а затем в виде префикса называют этот заместитель;
Систематическая номенклатура ИЮПАК
Слайд 11Алканы. Номенклатура
4) при наличии двух и более заместителей нумерацию цепи производят
5) если в главной цепи на равном расстоянии от концов стоят одинаковые радикалы, то нумерацию производят таким образом, чтобы радикалы получили наименьшие номера.
Слайд 15Алканы. Номенклатура
Рациональная номенклатура
тетраметилметан
(2,2-диметилпропан)
метилэтилизопропилметан
(2,3-диметилпентан)
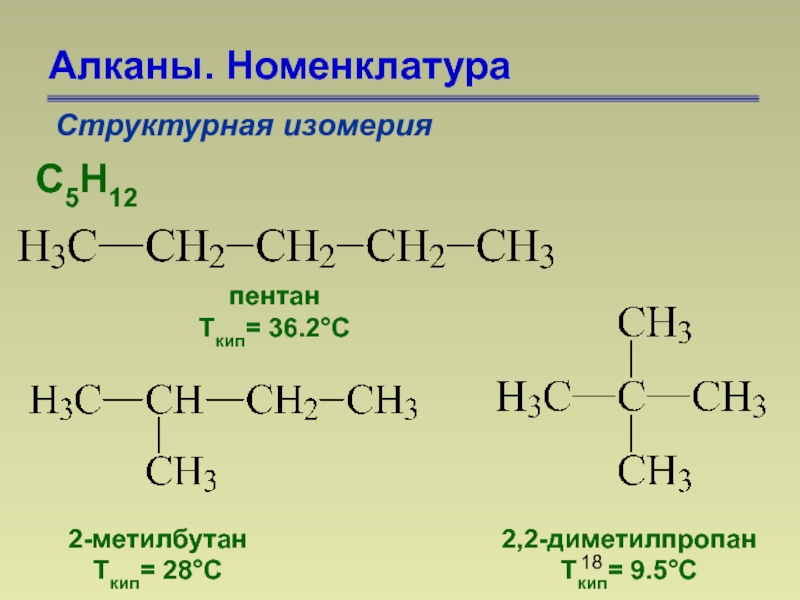
Слайд 18Алканы. Номенклатура
Структурная изомерия
С5Н12
пентан
Ткип= 36.2°С
2-метилбутан
Ткип= 28°С
2,2-диметилпропан
Ткип= 9.5°С
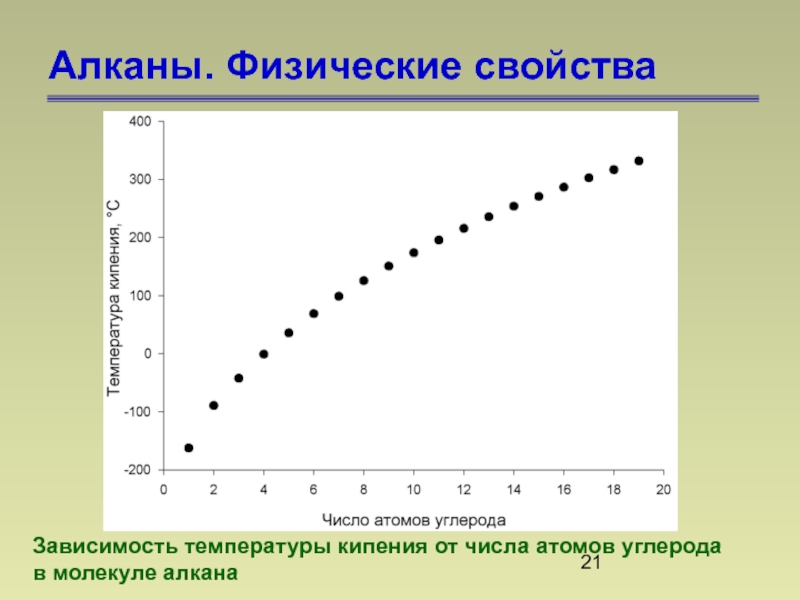
Слайд 21Алканы. Физические свойства
Зависимость температуры кипения от числа атомов углерода
в молекуле
Слайд 22Алканы. Физические свойства
Зависимость температуры плавления от числа атомов углерода
в молекуле
Слайд 27Алканы. Способы получения
Получение из ненасыщенных углеводородов
Получение из галогенопроизводных
Слайд 30Алканы. Способы получения
Получение из солей карбоновых кислот
Электролиз солей щелочных металлов и
кислот (реакция Кольбе)
Слайд 32Алканы. Способы получения
Гидролиз карбидов металлов
1) Карбиды, при гидролизе, которых образуется
Al4C3 + 12H2O = 3CH4 + 4Al(OH)3
2) Карбиды при гидролизе, которых образуется ацетилен. (Na2C2, K2C2, CaC2, BaC2, Cu2C2, Ag2C2)
3) Карбиды при гидролизе, которых образуется смесь углеводородов (карбиды переходных металлов)
Переработка отходов биологического
происхождения
Слайд 36Алканы. Химические свойства
Галогенирование (Механизм реакции)
1.Галогенирование начинается только под действием инициатора радикальных
2. Реакционная способность в ряду галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
3. Галогенирование под действием фтора и хлора может выйти из под контроля и приобрести взрывной характер.
Слайд 37Алканы. Химические свойства
Галогенирование (Механизм реакции)
4. Реакционная способность водорода у третичного атома
376 кДж/моль
390 кДж/моль
415 кДж/моль
Слайд 39Алканы. Химические свойства
Сульфохлорирование
С10H22 + SO2 + Cl2 → C10H21SO2Cl +
декан сульфохлорид
декана
C10H21SO2Cl + 2NaOH → C10H21SO3Na + NaCl + H2O
алкилсульфонат
Слайд 42Алканы. Химические свойства
Окисление
CH4 + H2O → CO + 3H2
CH4 +
CH4 + CO2 → 2CO + 2H2
CH4 + 2O2 → CO2 + H2O + 890 кДж/моль
Слайд 44Алканы. Химические свойства
Термическое разложение (Крекинг)
В.Г. Шухов (1891)
Температура – 470—650°С;
Давление – 7 МПа
Слайд 45Алканы. Химические свойства
Каталитический крекинг
Катализаторы – АlСl3, Сr2О3, алюмосиликаты; Температура –
Давление 0,01—0,1 МПа
Пиролиз и риформинг