- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основные сведения о строении атомов презентация
Содержание
- 1. Основные сведения о строении атомов
- 3. Понятие атом возникло ещё в античном мире для обозначения частиц вещества.
- 4. Ученые древности о строении вещества Древнегреческий ученый
- 6. История открытия строения атома. Уильям Крукс В 1879 году открыл катодные лучи.
- 7. Джозеф Томсон и Жан Перрен доказали, что
- 8. История открытия строения атома. Дж. Томсон.
- 10. Открытие радиоактивности Анри Беккерель
- 11. Эрнест Резерфорд В 1910 г. Эрнест Резерфорд
- 12. Доказал, что атом имеет плотное ядро. Предложил планетарную теорию строения атома. Э. Резерфорд
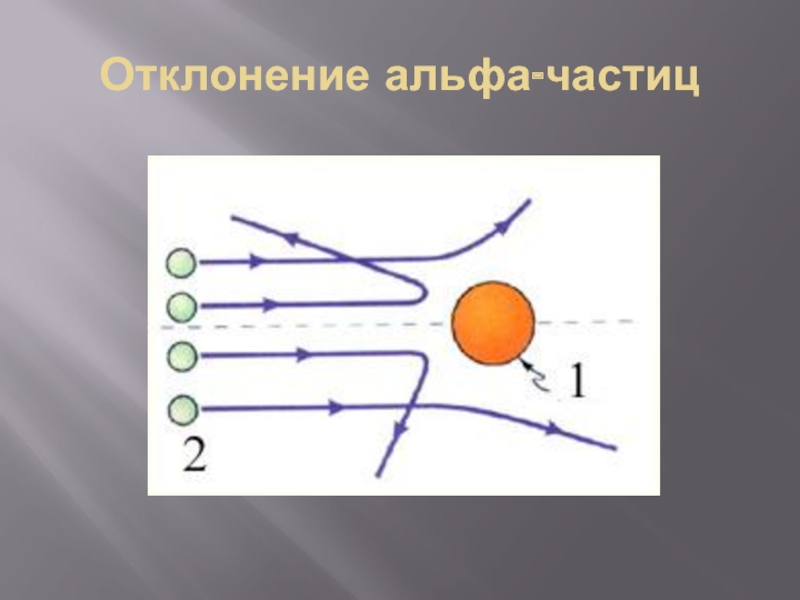
- 15. Отклонение альфа-частиц
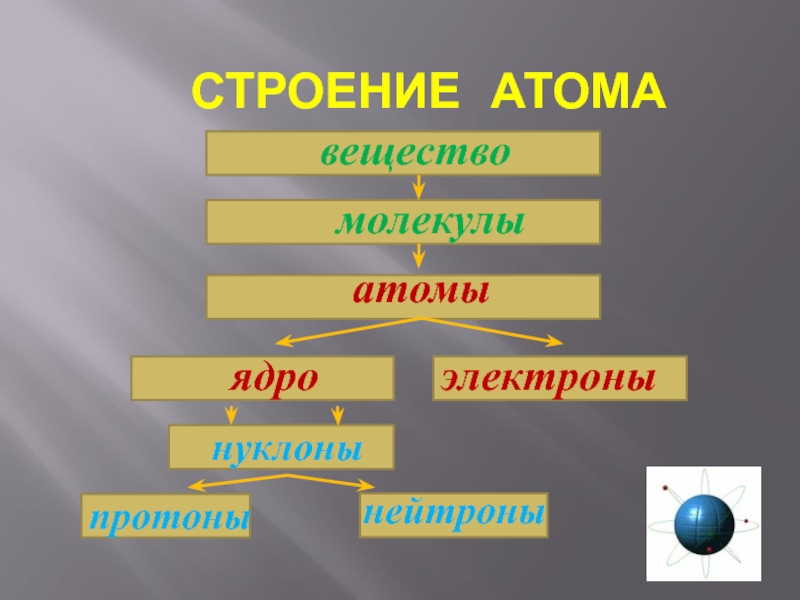
- 16. СТРУКТУРА АТОМА
- 17. В 1911 г. английский ученый Э.
- 18. Планетарная модель строения атома РЕЗЕРФОРД
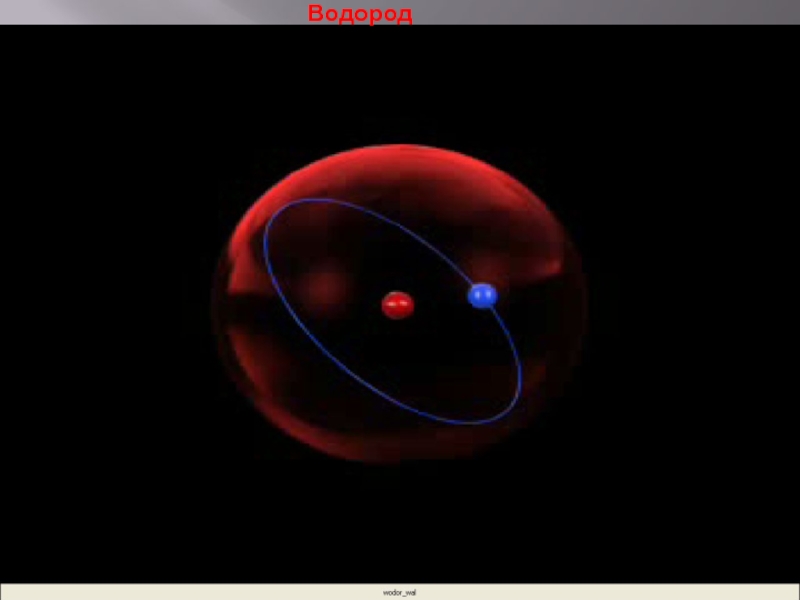
- 19. Водород
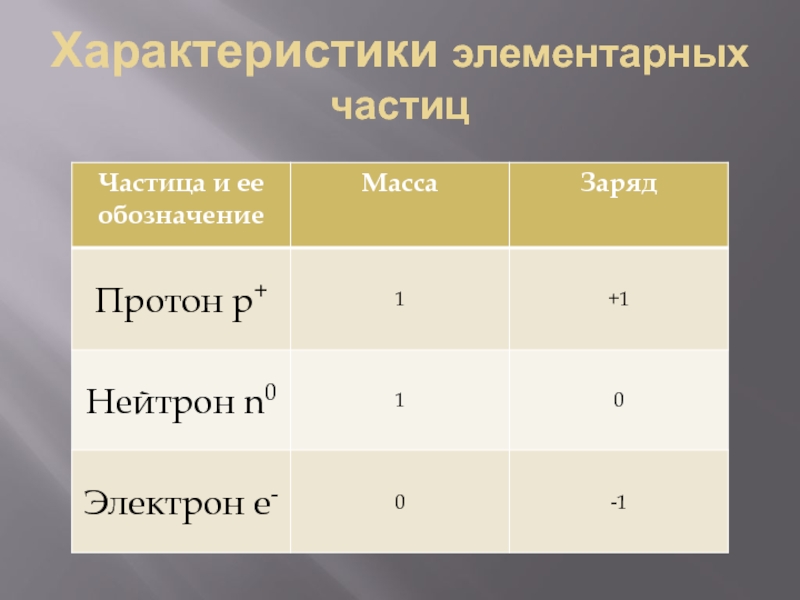
- 21. Характеристики элементарных частиц
- 22. СТРОЕНИЕ АТОМА
- 23. Число протонов
- 24. Изменение в составе ядер атомов химических элементов. Ядерные реакции. Изотопы
- 25. I. Ядерные реакции – это
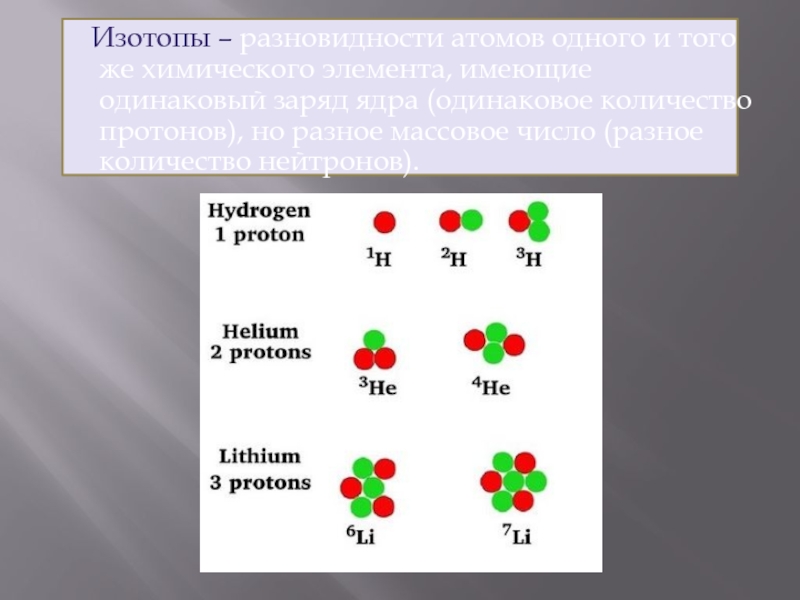
- 28. Изотопы – разновидности атомов одного и
Слайд 4Ученые древности о строении вещества
Древнегреческий ученый Демокрит 2500 лет назад считал,
Долгое время считалось, что атом является неделимой частицей.
Слайд 5
СТОНЕИ (Стони) Джордж Джонстон (Stoney George Johnstone) (15.II.1826 – 5.VII.1911) —
Ирландский физик СТОНИ на основании опытов пришёл к выводу, что электричество переносится мельчайшими частицами, существующими в атомах всех химических элементов В 1891 предложил название «электрон», что по-гречески означает «янтарь» для элементарного
Слайд 7Джозеф Томсон и Жан Перрен доказали, что электроны несут на себе
Джозеф Томсон
Жан Перрен
Слайд 8
История открытия строения атома.
Дж. Томсон.
Доказал, что электроны несут на себе отрицательный
е
- электрон
Слайд 11Эрнест Резерфорд
В 1910 г. Эрнест Резерфорд со своими учениками и коллегами
Слайд 12
Доказал, что атом имеет плотное ядро. Предложил планетарную теорию строения атома.
Э.
Слайд 17В 1911 г. английский ученый
Э. Резерфорд
доказал ,что в центре
имеется положительно
заряженное ядро.
Слайд 18Планетарная модель строения атома
РЕЗЕРФОРД ПРЕДПОЛОЖИЛ, ЧТО АТОМ УСТРОЕН ПОДОБНО
СУТЬ МОДЕЛИ СТРОЕНИЯ АТОМА ПО РЕЗЕРФОРДУ ЗАКЛЮЧАЕТСЯ В СЛЕДУЮЩЕМ: В ЦЕНТРЕ АТОМА НАХОДИТСЯ ПОЛОЖИТЕЛЬНО ЗАРЯЖЕННОЕ ЯДРО, В КОТОРОМ СОСРЕДОТОЧЕНА ВСЯ МАССА, ВОКРУГ ЯДРА ПО КРУГОВЫМ ОРБИТАМ НА БОЛЬШИХ РАССТОЯНИЯХ ВРАЩАЮТСЯ ЭЛЕКТРОНЫ (КАК ПЛАНЕТЫ ВОКРУГ СОЛНЦА).
ЗАРЯД ЯДРА СОВПАДАЕТ С НОМЕРОМ ХИМИЧЕСКОГО ЭЛЕМЕНТА В ТАБЛИЦЕ МЕНДЕЛЕЕВА.
Слайд 23 Число протонов в атоме равно порядковому номеру. Число электронов в атоме равно
Слайд 25
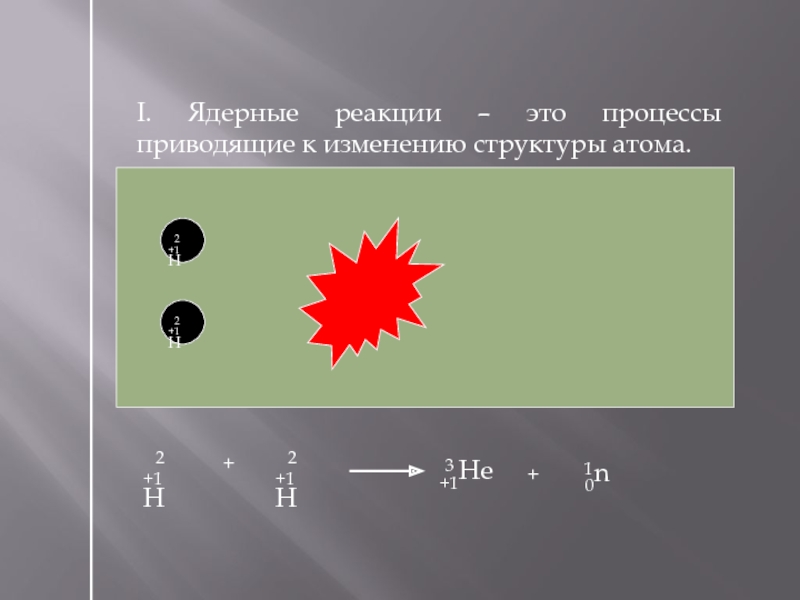
I. Ядерные реакции – это процессы приводящие к изменению структуры атома.
+1Н
2
+1Н
2
+1Не
3
0n
1
+1Н
2
+1Н
2
+
+1Не
3
0n
1
+
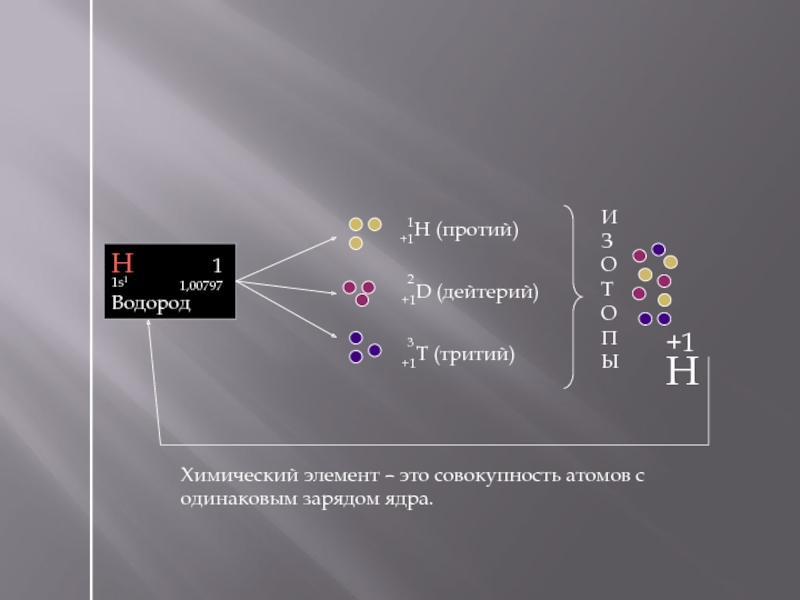
Слайд 27
+1H (протий)
+1D (дейтерий)
+1T (тритий)
Химический элемент – это совокупность атомов с
Н
1
1,00797
1s1
Водород
3
1
2
И
З
О
Т
О
П
Ы
+1H