http://www.chem.asu.ru/org/ochem_bio/index.html
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Органическая химия презентация
Содержание
- 1. Органическая химия
- 2. Преподаватели КАТРАКОВ Игорь Борисович, доцент, канд.
- 3. Модульно-рейтинговая технология обучения Модули –
- 4. Модульно-рейтинговая технология обучения Модульная программа (модуль)
- 5. Структура рейтинга по курсу органической химии
- 6. Нормировка рейтинга к стандартной оценке
- 7. Сайт курса «Органическая химия» http://www.chem.asu.ru/org/ochem_bio/index.html
- 8. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
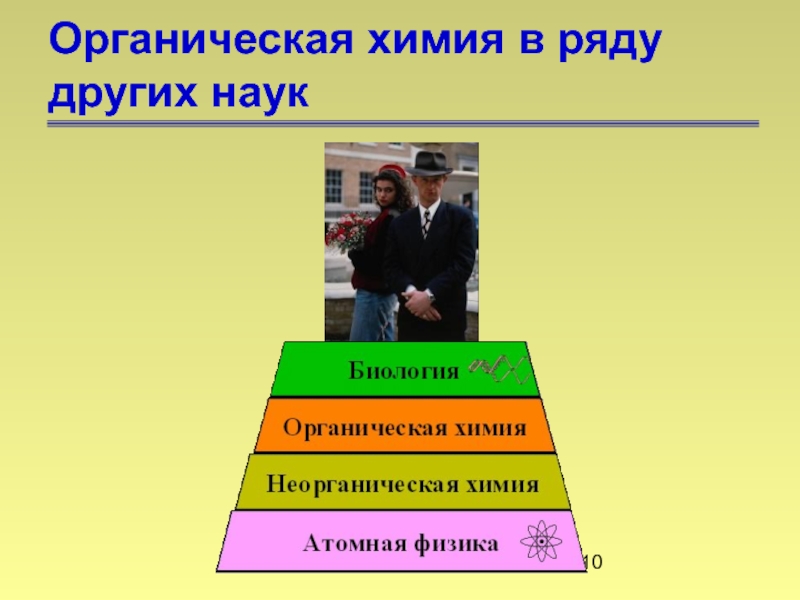
- 9. Органическая химия в ряду других наук
- 10. Органическая химия в ряду других наук
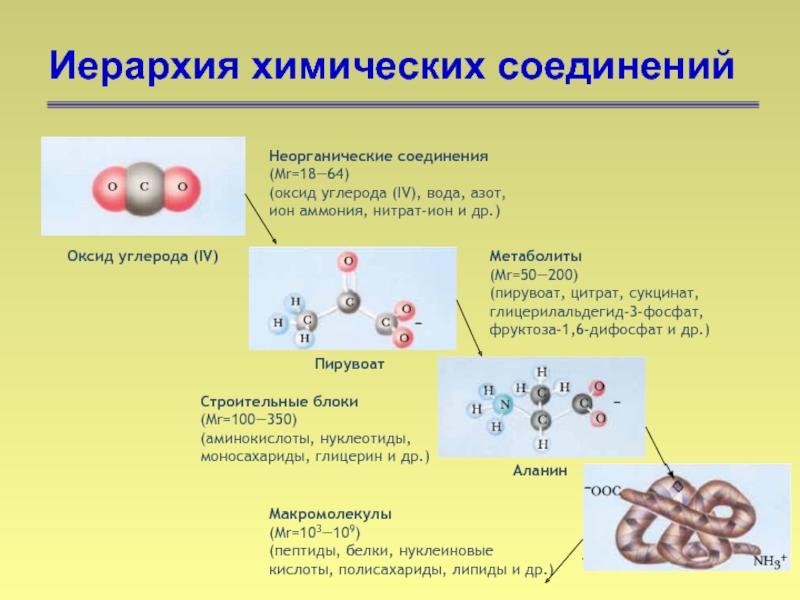
- 11. Иерархия химических соединений Неорганические соединения (Mr=18―64) (оксид
- 12. Предмет органической химии Органическая химия —
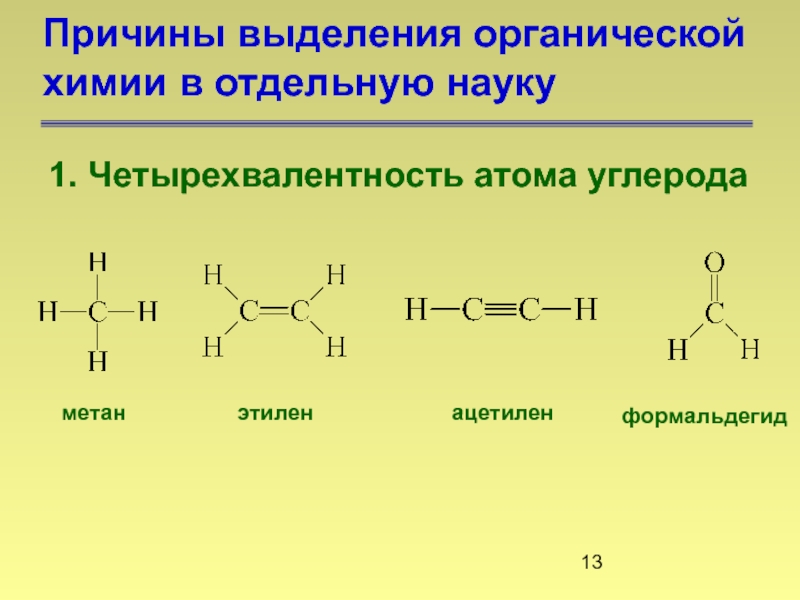
- 13. Причины выделения органической химии в отдельную науку
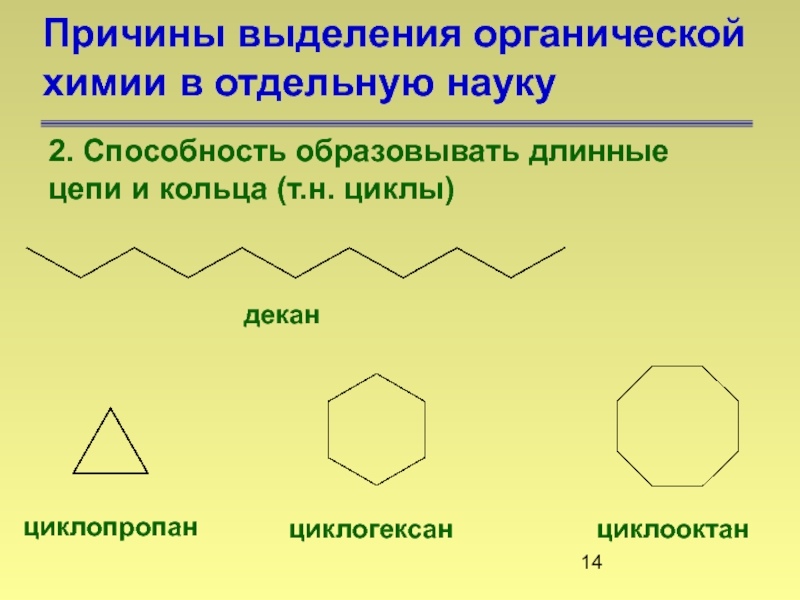
- 14. Причины выделения органической химии в отдельную науку
- 15. Причины выделения органической химии в отдельную науку
- 16. Причины выделения органической химии в отдельную науку
- 17. Причины выделения органической химии в отдельную науку
- 18. Причины выделения органической химии в отдельную науку
- 19. Причины выделения органической химии в отдельную науку
- 20. Многочисленность органических соединений Chemical Abstract Service (CAS) http://www.cas.org
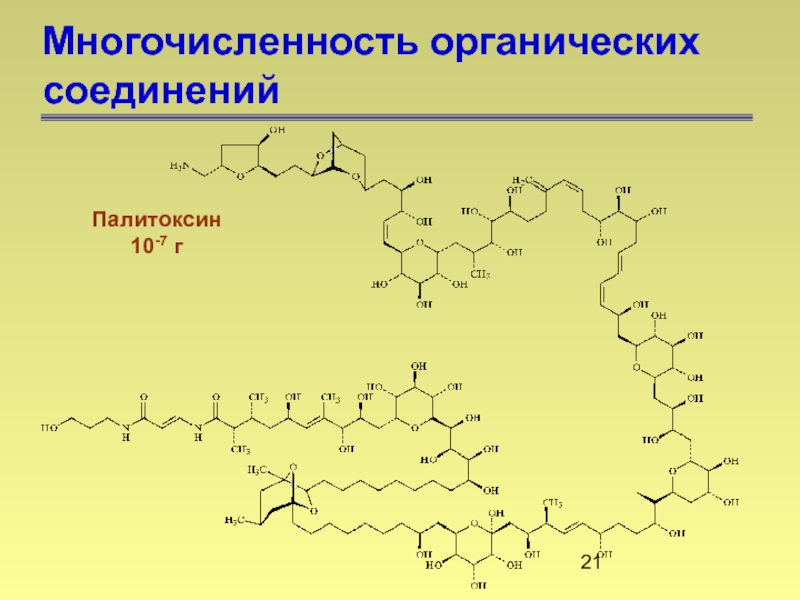
- 21. Многочисленность органических соединений Палитоксин 10-7 г
- 22. Многочисленность органических соединений Палитоксин 10-7 г
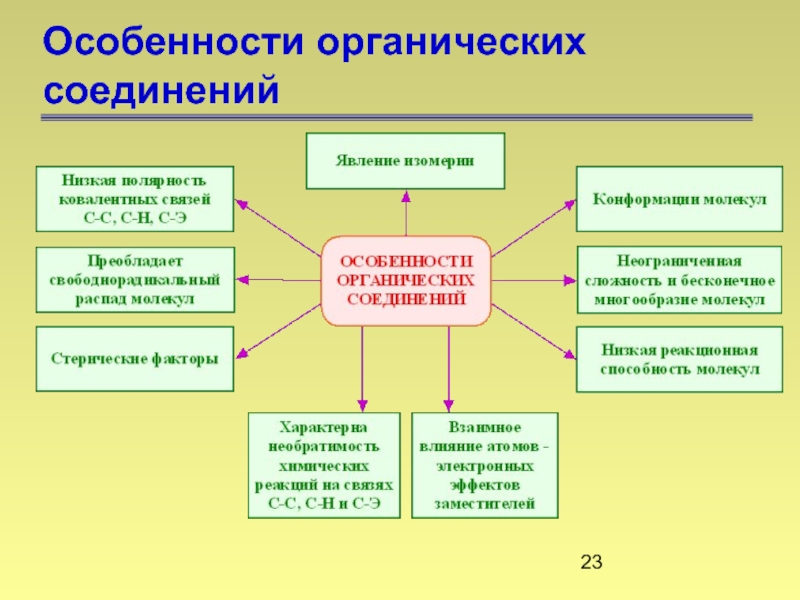
- 23. Особенности органических соединений
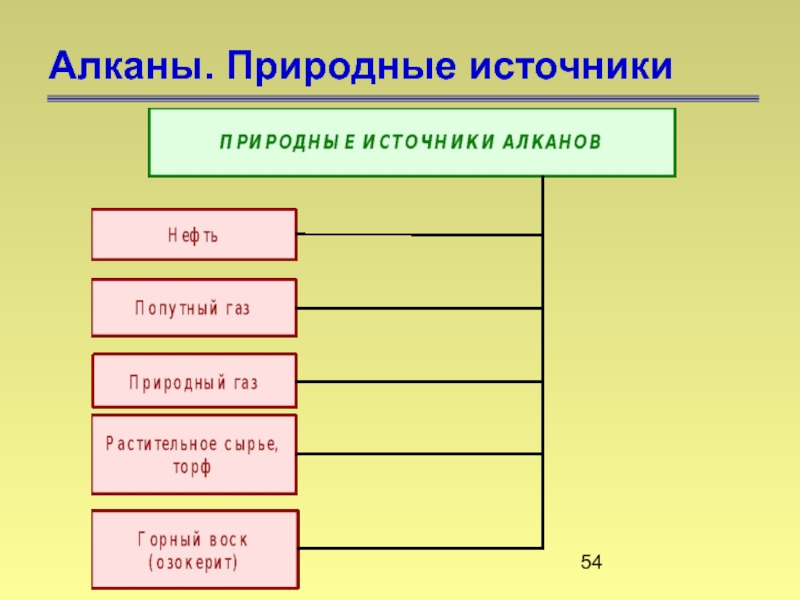
- 24. Источники органических соединений
- 25. Предельные углеводороды. Алканы
- 26. Алифатические углеводороды
- 27. Алканы Алканами называются насыщенные углеводороды, молекулы
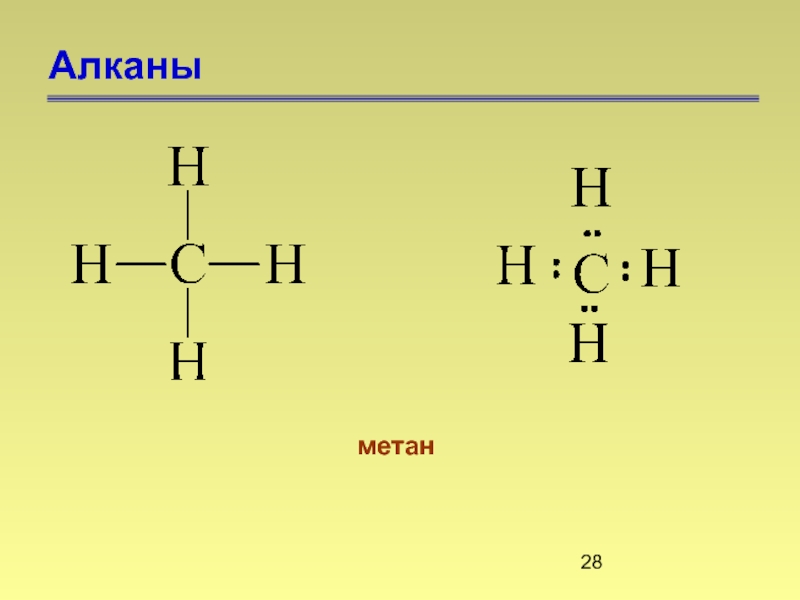
- 28. Алканы метан
- 29. Алканы
- 30. Электронная структура атома углерода в органических соединениях
- 31. Электронная структура атома углерода в органических соединениях основное состояние возбужденное состояние
- 32. Электронная структура атома углерода в органических соединениях
- 33. Гибридизация Атомная орбиталь — это
- 34. Гибридизация
- 35. Алканы Группы органических соединений однотипной структуры
- 36. Алканы СnН2n+2
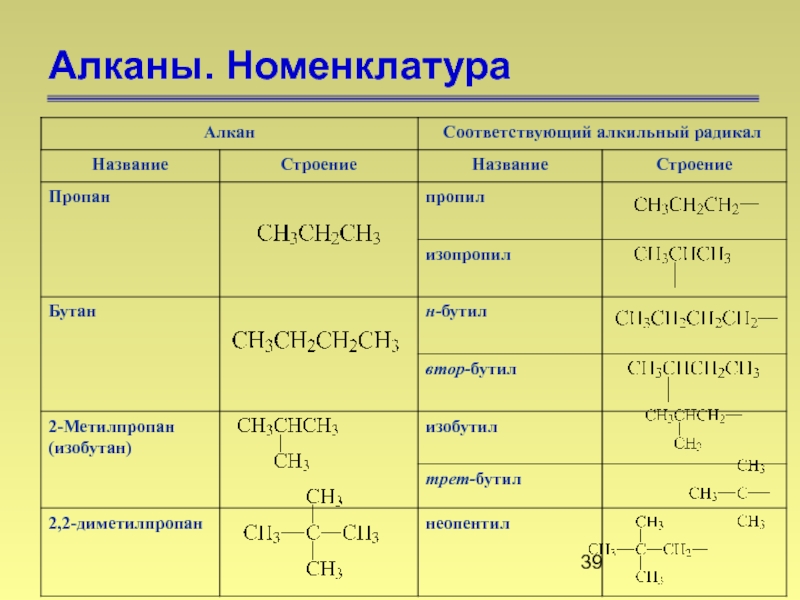
- 37. Алканы. Номенклатура. Названия нормальных алканов по заместительной номенклатуре
- 38. Алканы. Номенклатура 2,2,4-триметилпентан Первичный Вторичный Третичный Четвертичный
- 39. Алканы. Номенклатура
- 40. Алканы. Номенклатура 1) определяют самую длинную
- 41. Алканы. Номенклатура 4) при наличии двух
- 42. Алканы. Номенклатура 3,5-диметил-3-этилоктан
- 43. Алканы. Номенклатура 2,3,4-триметилпентан
- 44. Алканы. Номенклатура 2,3,6-триметилгептан
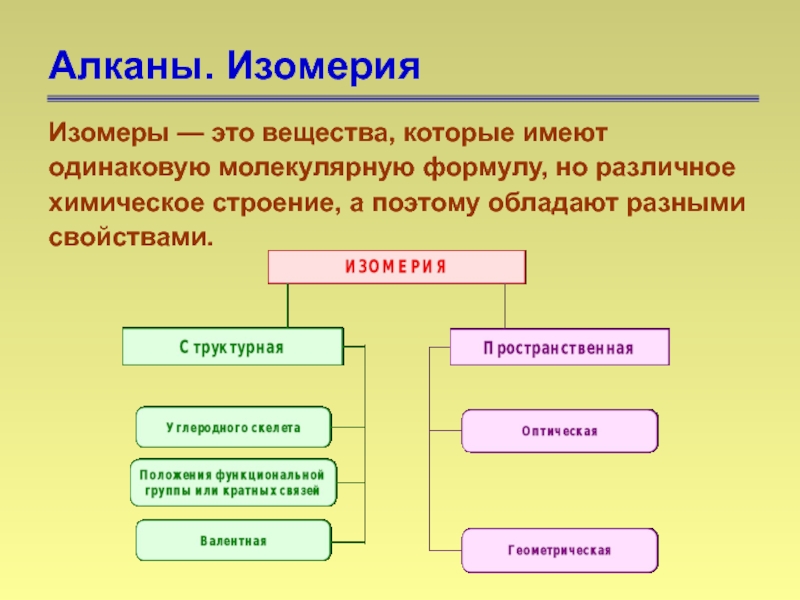
- 45. Алканы. Изомерия Изомеры — это вещества,
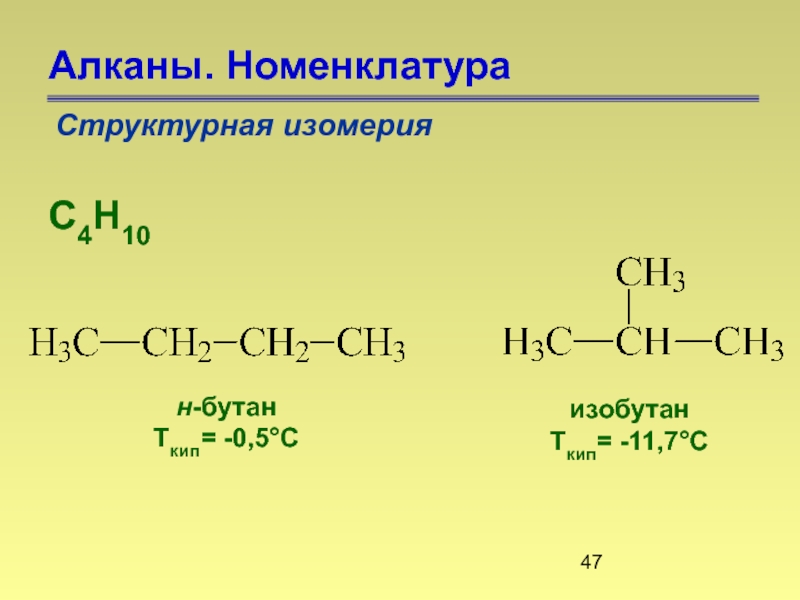
- 46. Алканы. Номенклатура Структурная изомерия
- 47. Алканы. Номенклатура Структурная изомерия С4Н10 н-бутан Ткип= -0,5°С изобутан Ткип= -11,7°С
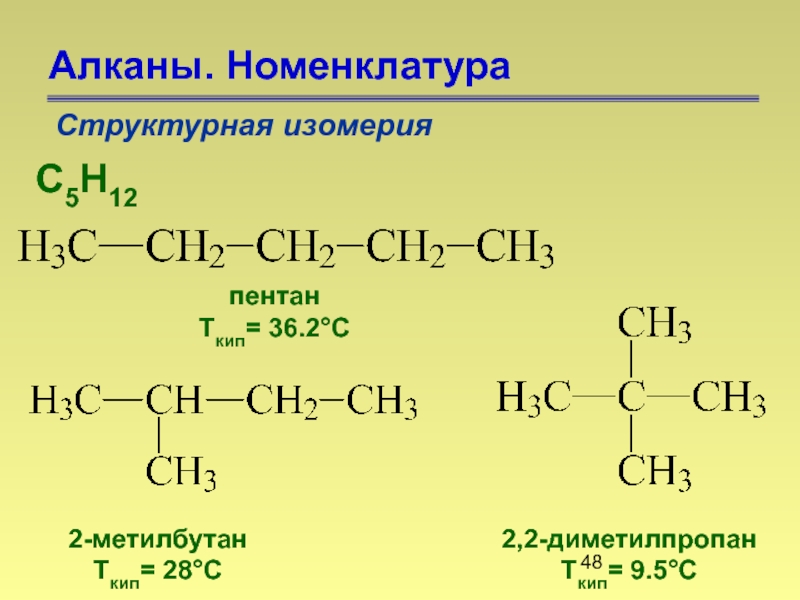
- 48. Алканы. Номенклатура Структурная изомерия С5Н12 пентан
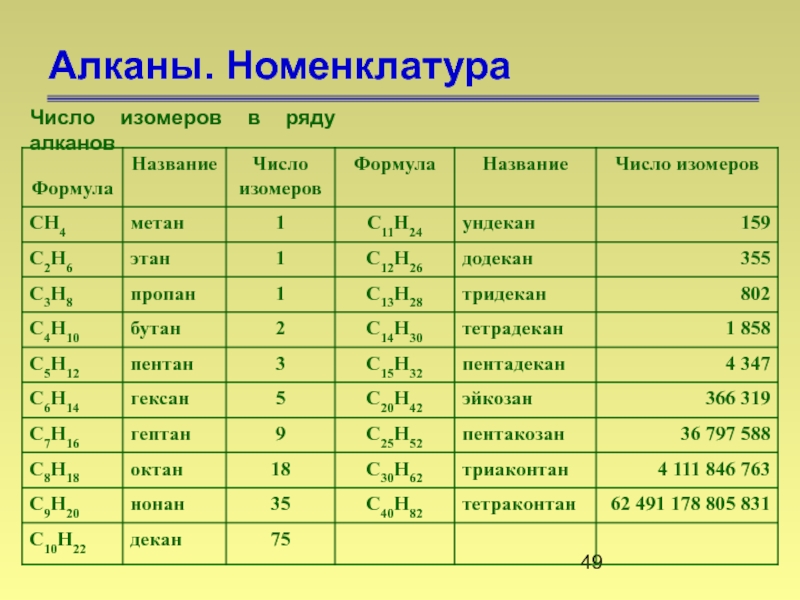
- 49. Алканы. Номенклатура Число изомеров в ряду алканов
- 50. Алканы. Физические свойства
- 51. Алканы. Физические свойства Зависимость температуры
- 52. Алканы. Физические свойства Зависимость температуры
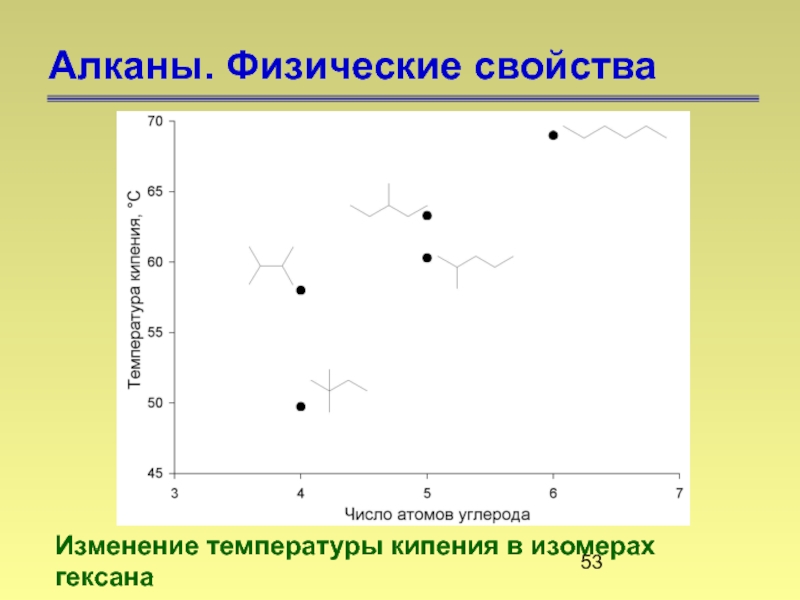
- 53. Алканы. Физические свойства Изменение температуры кипения в изомерах гексана
- 54. Алканы. Природные источники
- 55. Алканы. Способы получения Газофикация угля (Бертло, 1869) Сжижение угля
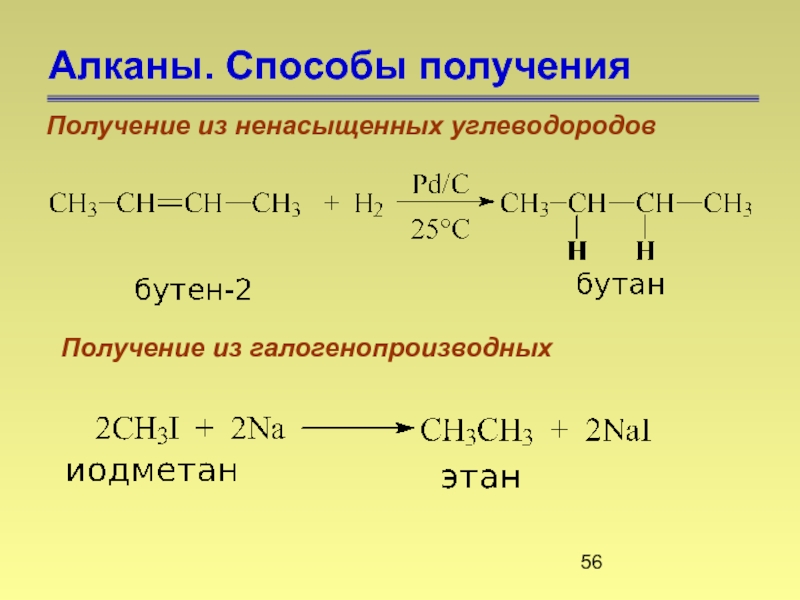
- 56. Алканы. Способы получения Получение из ненасыщенных углеводородов Получение из галогенопроизводных
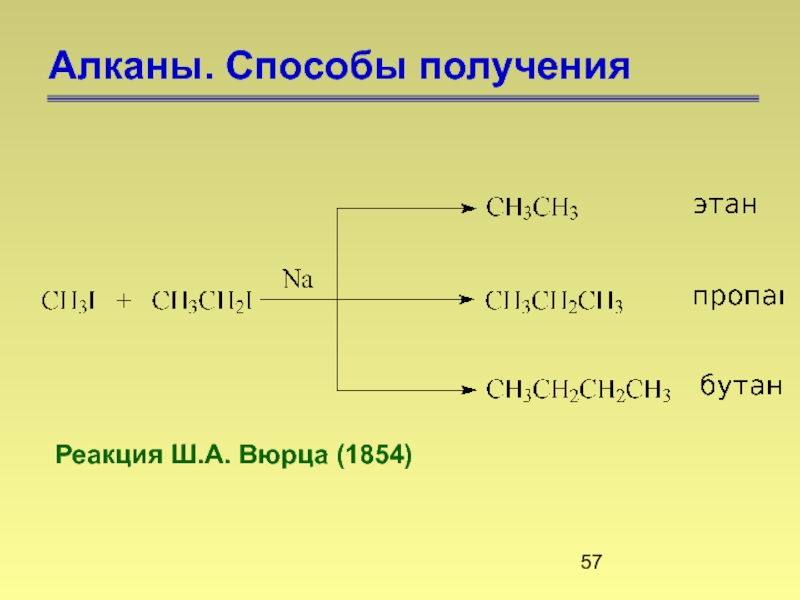
- 57. Алканы. Способы получения Реакция Ш.А. Вюрца (1854)
- 58. Алканы. Способы получения Восстановление галогеналканов
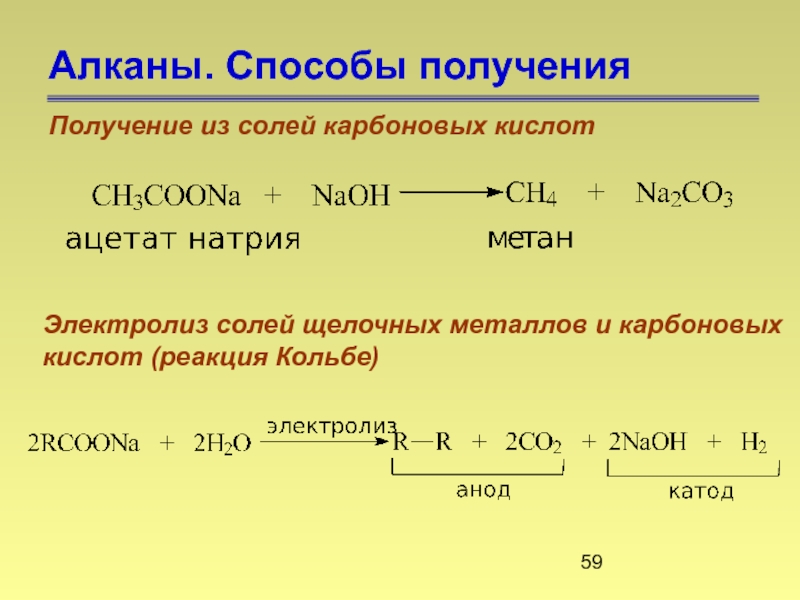
- 59. Алканы. Способы получения Получение из солей
- 60. Алканы. Способы получения Гидролиз карбидов металлов
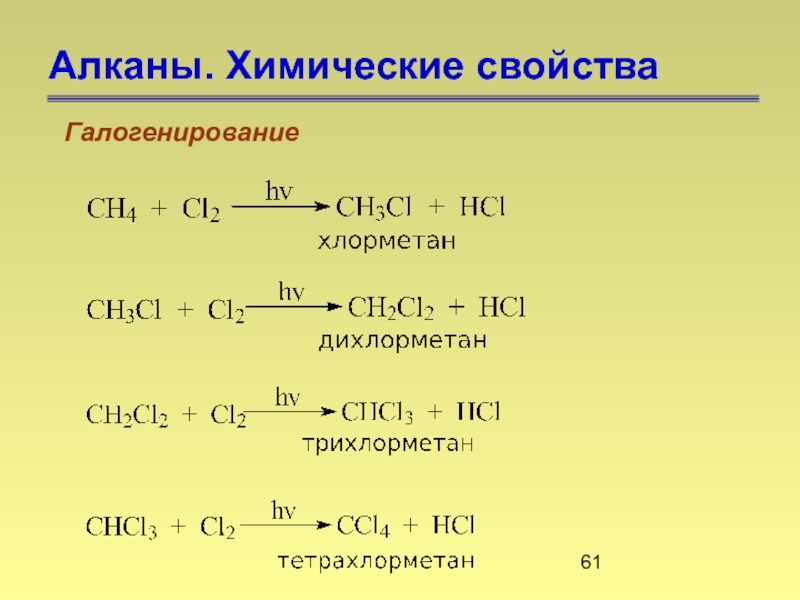
- 61. Алканы. Химические свойства Галогенирование
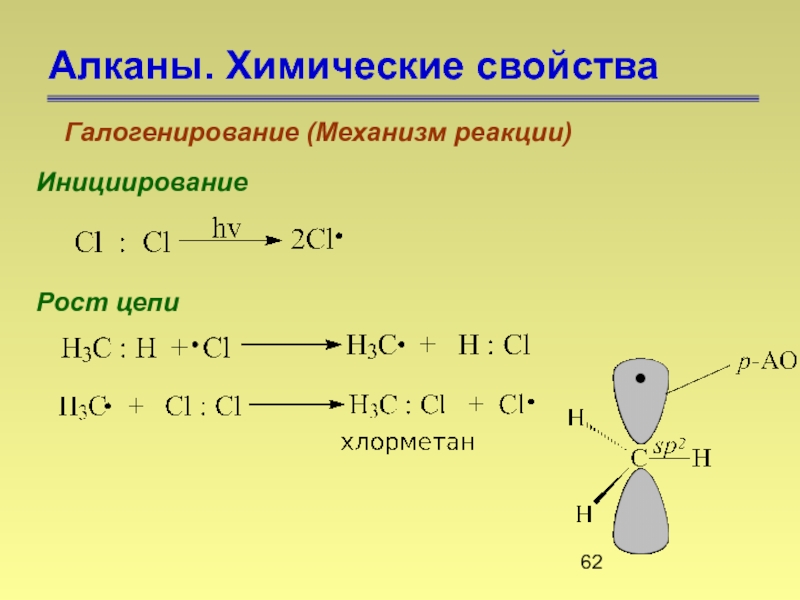
- 62. Алканы. Химические свойства Галогенирование (Механизм реакции) Инициирование Рост цепи
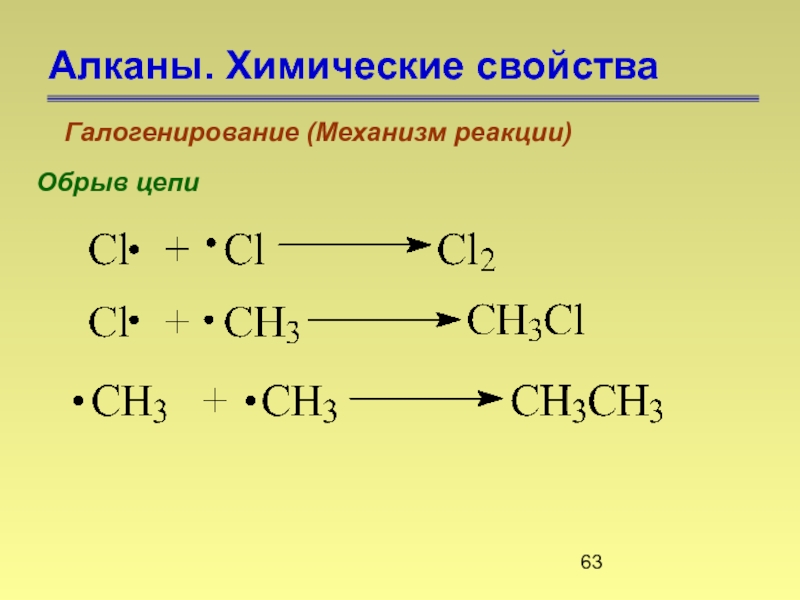
- 63. Алканы. Химические свойства Галогенирование (Механизм реакции) Обрыв цепи
- 64. Алканы. Химические свойства Галогенирование (Механизм реакции)
- 65. Алканы. Химические свойства Галогенирование (Механизм реакции)
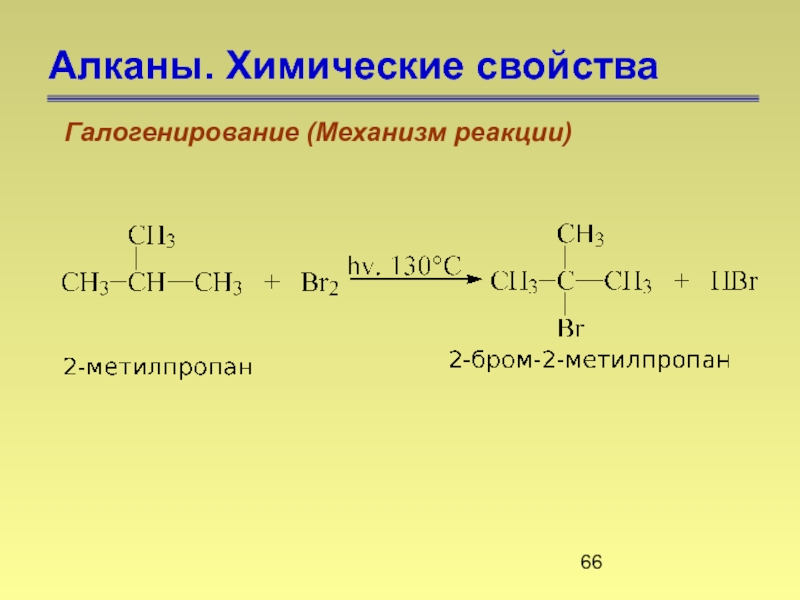
- 66. Алканы. Химические свойства Галогенирование (Механизм реакции)
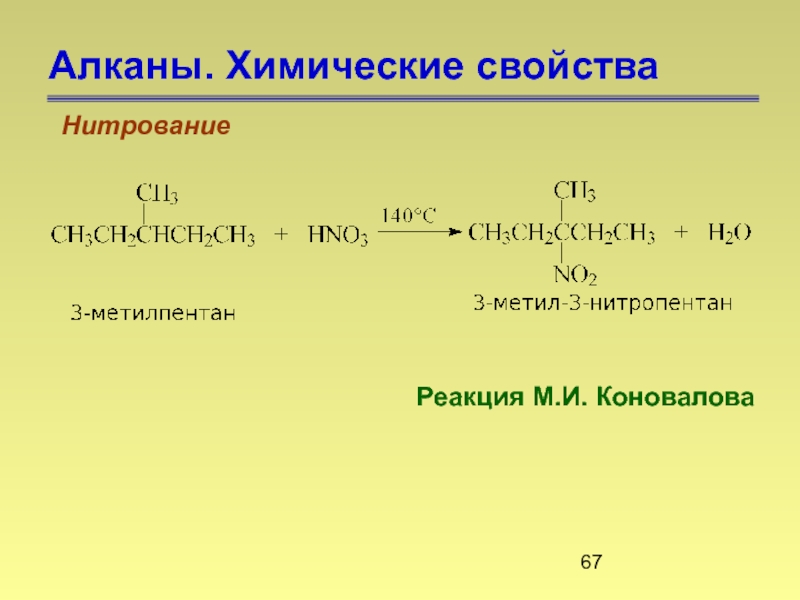
- 67. Алканы. Химические свойства Нитрование Реакция М.И. Коновалова
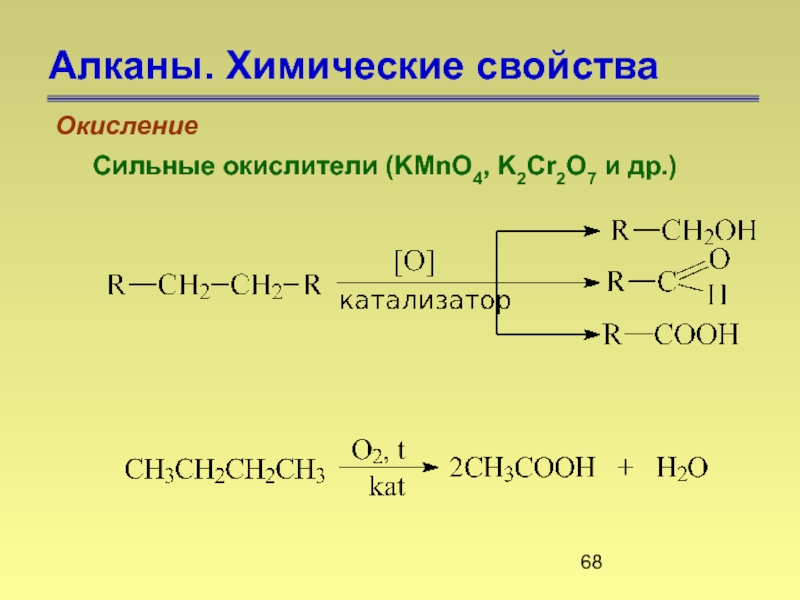
- 68. Алканы. Химические свойства Окисление Сильные окислители (KMnO4, K2Cr2O7 и др.)
- 69. Алканы. Химические свойства Окисление
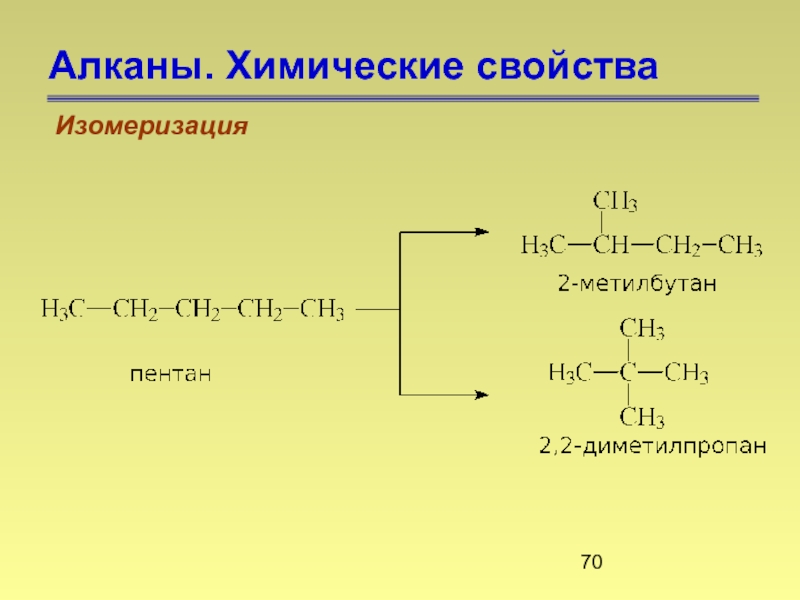
- 70. Алканы. Химические свойства Изомеризация
- 71. Алканы. Химические свойства Термическое разложение
- 72. Алканы. Химические свойства Каталитический крекинг
- 73. Алканы. Переработка нефти Перегонка Каталитический крекинг
Слайд 1Органическая химия
Лектор: Маркин Вадим Иванович
доцент кафедры органической химии, канд. хим. наук
E-mail:
Слайд 2Преподаватели
КАТРАКОВ
Игорь Борисович,
доцент, канд. хим. наук
ЧЕПРАСОВА
Марина Юрьевна,
ассистент
СИЯНКО
Петр Иванович,
доцент, канд. хим. наук
Слайд 3Модульно-рейтинговая технология обучения
Модули – 4
Лекции – 20 ч
Лабораторные работы –
Семинары – 14 ч
Контрольные работы – 2
ЭКЗАМЕН
Слайд 4Модульно-рейтинговая технология обучения
Модульная программа (модуль)
самостоятельная работа
(выполнение индивидуального задания);
посещение лекций;
индивидуальная консультация
семинарское занятие;
лабораторный практикум.
Слайд 9Органическая химия в ряду других наук
Органическая химия вполне может свести
Фридрих Велер (1835)
Фридрих Велер
(1800-1882)
Слайд 11Иерархия химических соединений
Неорганические соединения
(Mr=18―64)
(оксид углерода (IV), вода, азот, ион аммония, нитрат-ион
Оксид углерода (IV)
Метаболиты
(Mr=50―200)
(пирувоат, цитрат, сукцинат, глицерилальдегид-3-фосфат, фруктоза-1,6-дифосфат и др.)
Пирувоат
Макромолекулы
(Mr=103―109)
(пептиды, белки, нуклеиновые кислоты, полисахариды, липиды и др.)
Строительные блоки
(Mr=100―350)
(аминокислоты, нуклеотиды, моносахариды, глицерин и др.)
Аланин
Слайд 12Предмет органической химии
Органическая химия — химия соединений углерода.
Элементы С, Н,
Органическая химия — химия углеводородов и их производных.
Слайд 13Причины выделения органической химии в отдельную науку
1. Четырехвалентность атома углерода
метан
этилен
ацетилен
формальдегид
Слайд 14Причины выделения органической химии в отдельную науку
2. Способность образовывать длинные
декан
циклопропан
циклогексан
циклооктан
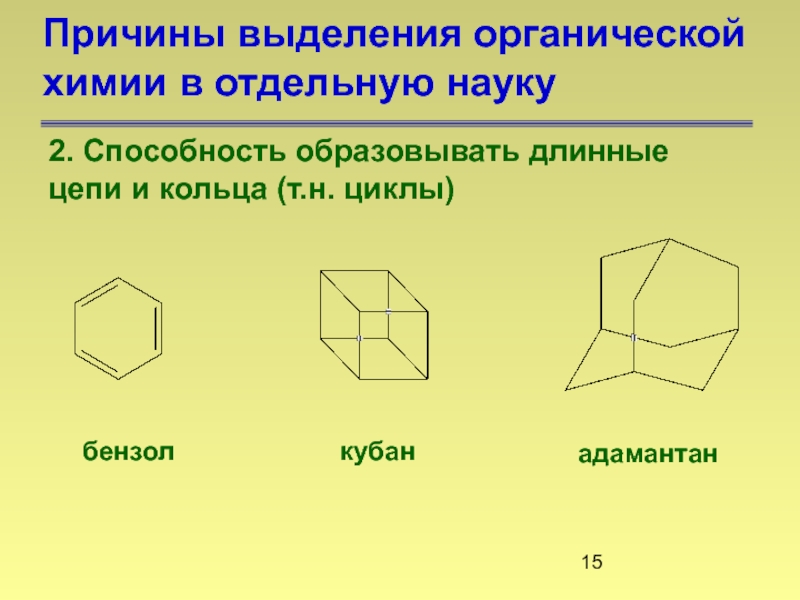
Слайд 15Причины выделения органической химии в отдельную науку
2. Способность образовывать длинные
бензол
кубан
адамантан
Слайд 16Причины выделения органической химии в отдельную науку
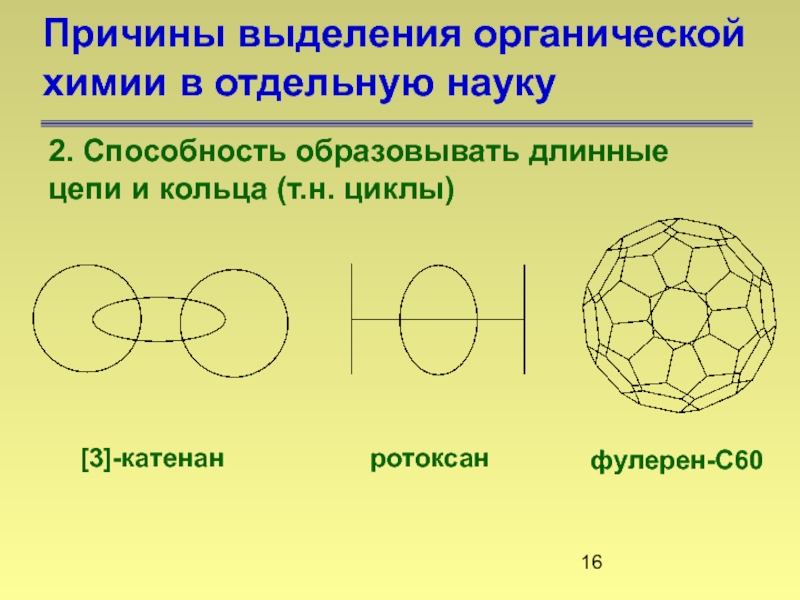
2. Способность образовывать длинные
[3]-катенан
ротоксан
фулерен-С60
Слайд 17Причины выделения органической химии в отдельную науку
3. Способность образовывать устойчивые
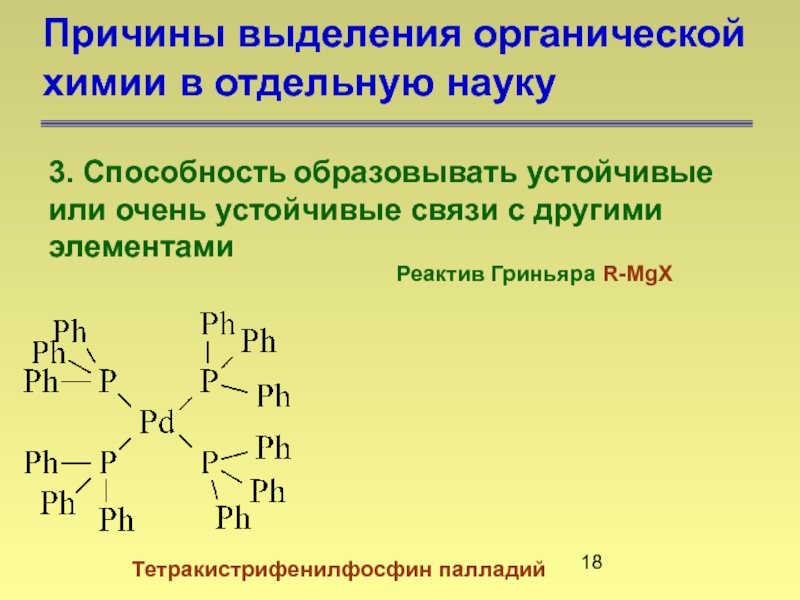
Слайд 18Причины выделения органической химии в отдельную науку
3. Способность образовывать устойчивые
Реактив Гриньяра R-MgX
Тетракистрифенилфосфин палладий
Слайд 19Причины выделения органической химии в отдельную науку
4. Из всех элементов
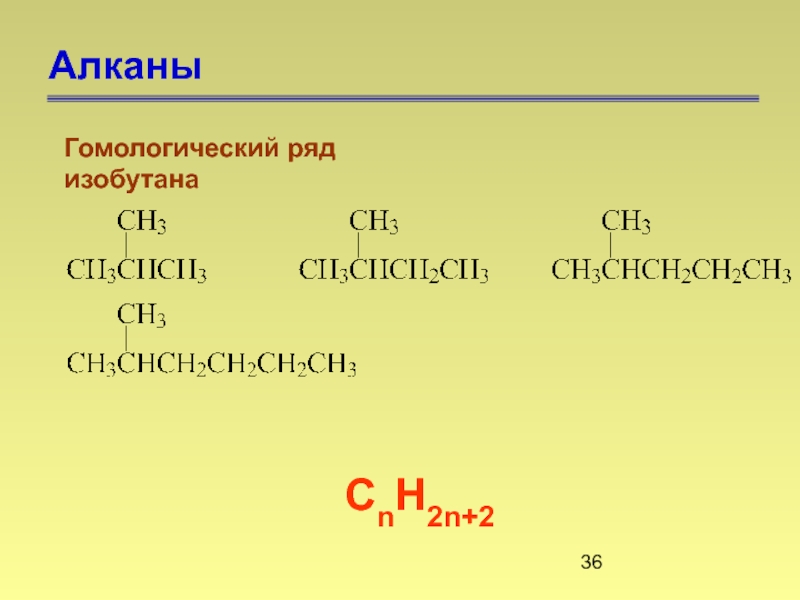
Слайд 27Алканы
Алканами называются насыщенные углеводороды, молекулы которых состоят из атомов углерода и
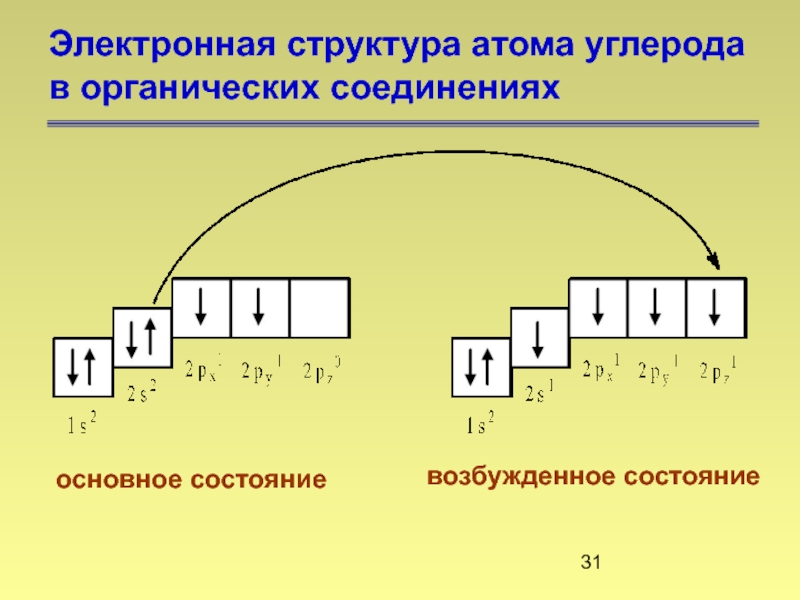
Слайд 31Электронная структура атома углерода
в органических соединениях
основное состояние
возбужденное состояние
Слайд 33Гибридизация
Атомная орбиталь — это часть пространства, в которой вероятность нахождения
Слайд 35Алканы
Группы органических соединений однотипной структуры с одинаковой функциональными группами, отличающиеся друг
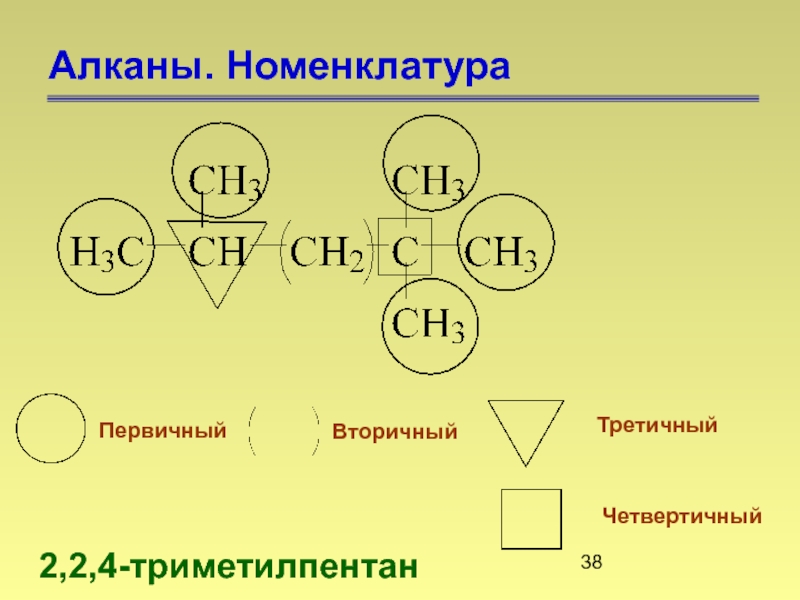
Слайд 40Алканы. Номенклатура
1) определяют самую длинную цепь атомов углерода. Число атомов углерода
2) нумеруют главную цепь с того конца, ближе к которому находится заместитель (углеводородный радикал);
3) перед основой названия указывают цифровой номер того атома углерода в главной цепи, у которого находится заместитель, а затем в виде префикса называют этот заместитель;
Систематическая номенклатура ИЮПАК
Слайд 41Алканы. Номенклатура
4) при наличии двух и более заместителей нумерацию цепи производят
5) если в главной цепи на равном расстоянии от концов стоят одинаковые радикалы, то нумерацию производят таким образом, чтобы радикалы получили наименьшие номера.
Слайд 45Алканы. Изомерия
Изомеры — это вещества, которые имеют одинаковую молекулярную формулу, но
Слайд 48Алканы. Номенклатура
Структурная изомерия
С5Н12
пентан
Ткип= 36.2°С
2-метилбутан
Ткип= 28°С
2,2-диметилпропан
Ткип= 9.5°С
Слайд 51Алканы. Физические свойства
Зависимость температуры кипения от числа атомов углерода
в молекуле
Слайд 52Алканы. Физические свойства
Зависимость температуры плавления от числа атомов углерода
в молекуле
Слайд 56Алканы. Способы получения
Получение из ненасыщенных углеводородов
Получение из галогенопроизводных
Слайд 59Алканы. Способы получения
Получение из солей карбоновых кислот
Электролиз солей щелочных металлов и
кислот (реакция Кольбе)
Слайд 60Алканы. Способы получения
Гидролиз карбидов металлов
1) Карбиды, при гидролизе, которых образуется
Al4C3 + 12H2O = 3CH4 + 4Al(OH)3
2) Карбиды при гидролизе, которых образуется ацетилен. (Na2C2, K2C2, CaC2, BaC2, Cu2C2, Ag2C2)
3) Карбиды при гидролизе, которых образуется смесь углеводородов (карбиды переходных металлов)
Переработка отходов биологического
происхождения
Слайд 64Алканы. Химические свойства
Галогенирование (Механизм реакции)
1.Галогенирование начинается только под действием инициатора радикальных
2. Реакционная способность в ряду галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
3. Галогенирование под действием фтора и хлора может выйти из под контроля и приобрести взрывной характер.
Слайд 65Алканы. Химические свойства
Галогенирование (Механизм реакции)
4. Реакционная способность водорода у третичного атома
376 кДж/моль
390 кДж/моль
415 кДж/моль
Слайд 69Алканы. Химические свойства
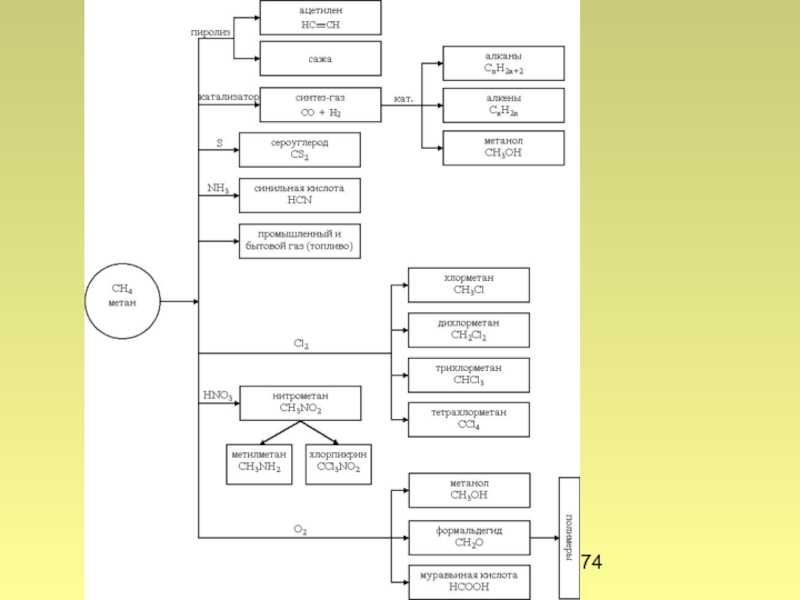
Окисление
CH4 + H2O → CO + 3H2
CH4 +
CH4 + CO2 → 2CO + 2H2
CH4 + 2O2 → CO2 + H2O + 890 кДж/моль
Слайд 71Алканы. Химические свойства
Термическое разложение (Крекинг)
В.Г. Шухов (1891)
Температура – 470—650°С;
Давление – 7 МПа
Слайд 72Алканы. Химические свойства
Каталитический крекинг
Катализаторы – АlСl3, Сr2О3, алюмосиликаты; Температура –
Давление 0,01—0,1 МПа
Пиролиз и риформинг