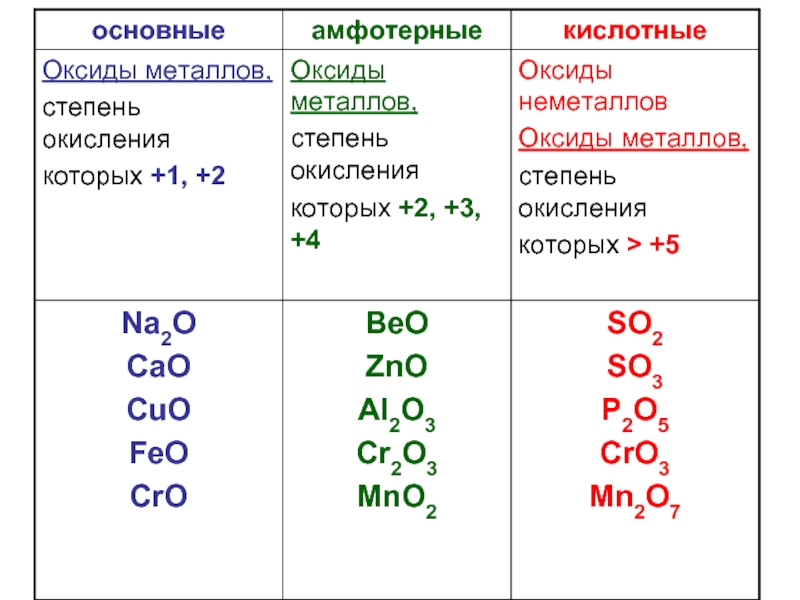
со степенью окисления -2
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ОКСИДЫ презентация
Содержание
- 1. ОКСИДЫ
- 2. ОКСИДЫ вокруг нас Углекислый газ
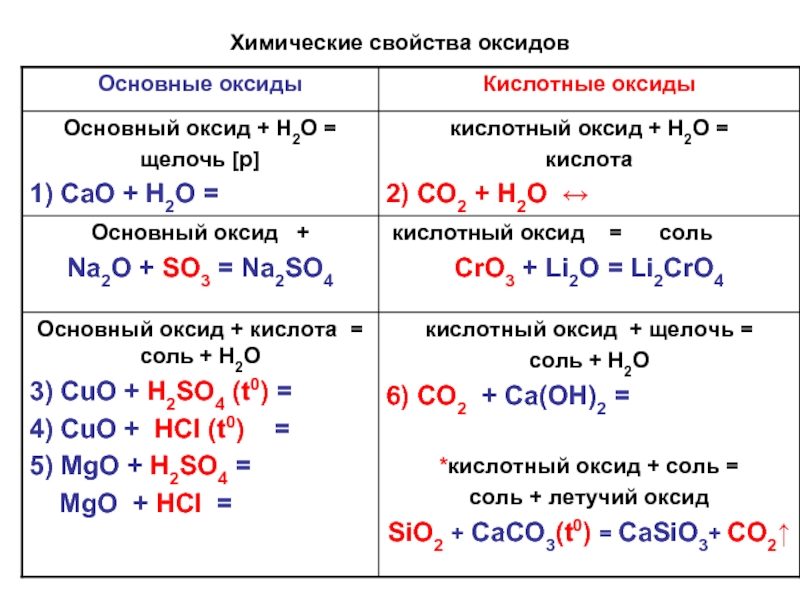
- 4. Химические свойства оксидов
- 5. Основный оксид + H2O = щелочь [p]
- 6. Кислотный оксид + вода = кислота
- 7. Основный оксид + кислота = соль +
- 8. Кислотный оксид + щелочь = соль +
- 9. Основный оксид + кислотный оксид = соль
- 10. Допишите уравнения реакций СаО + СО2 →
- 11. Осуществите превращения Литий → оксид лития → гидроксид лития → нитрат лития
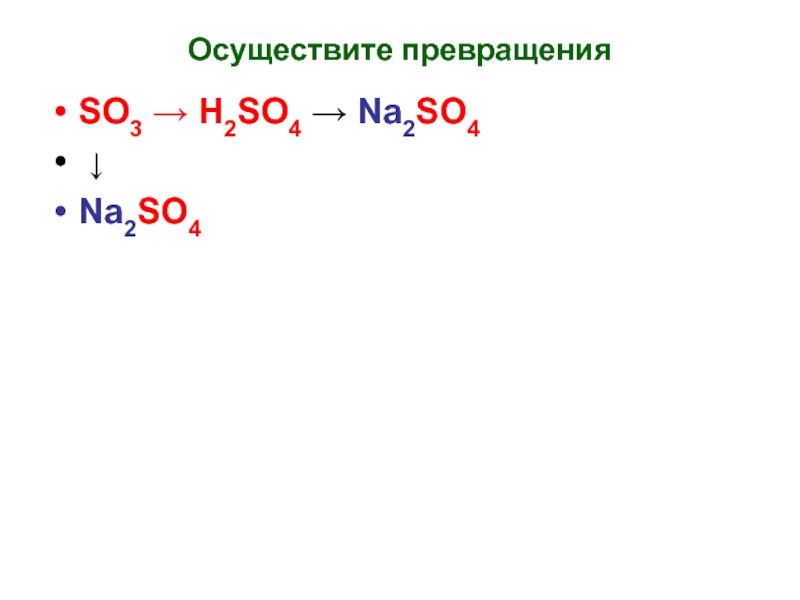
- 12. Осуществите превращения SO3 → H2SO4 → Na2SO4 ↓ Na2SO4
- 13. Ва → ВаО → Ва(ОН)2 → Ва3(РО4)2
- 14. Генетическая связь неорганических веществ Металл → основный
- 15. Генетическая связь неорганических веществ Неметалл → кислотный
- 16. По названию напишите формулу оксида нужным цветом:
- 17. Напишите формулы щелочей и кислот, соответствующих данным
Слайд 2ОКСИДЫ вокруг нас
Углекислый газ
Угарный газ
«Веселящий газ»
Негашеная известь
Кварц, кремнезем, песок
Корунд, наждак
Слайд 5Основный оксид + H2O = щелочь [p]
Запомни!
Li2O + H2O = 2LiOH
Na2O
+ H2O = 2NaOH едкий натр, каустик
K2O + H2O = 2KOH едкое кали
СаО + Н2О = Са(ОН)2 гашеная известь
негашеная известь известковая вода
ВаО + Н2О = Ва(ОН)2 баритовая вода
K2O + H2O = 2KOH едкое кали
СаО + Н2О = Са(ОН)2 гашеная известь
негашеная известь известковая вода
ВаО + Н2О = Ва(ОН)2 баритовая вода
Слайд 6Кислотный оксид + вода = кислота
Запомни!
СО2 + Н2О ↔ Н2СО3
(Н2О + СО2↑)
SО2 + Н2О ↔ Н2SО3 (Н2О + SО2↑)
SО3 + Н2О → Н2SО4
N2O5 + Н2О → 2HNO3
P2O5 + 3Н2О → 2H3PO4
Эти оксиды реагируют с водой и образуют кислоты!
-------------------------------------------------------------------------
SiО2 (песок, кварц, кремнезем ← Н2SiО3↓
не взаимодействует с водой)
SО2 + Н2О ↔ Н2SО3 (Н2О + SО2↑)
SО3 + Н2О → Н2SО4
N2O5 + Н2О → 2HNO3
P2O5 + 3Н2О → 2H3PO4
Эти оксиды реагируют с водой и образуют кислоты!
-------------------------------------------------------------------------
SiО2 (песок, кварц, кремнезем ← Н2SiО3↓
не взаимодействует с водой)
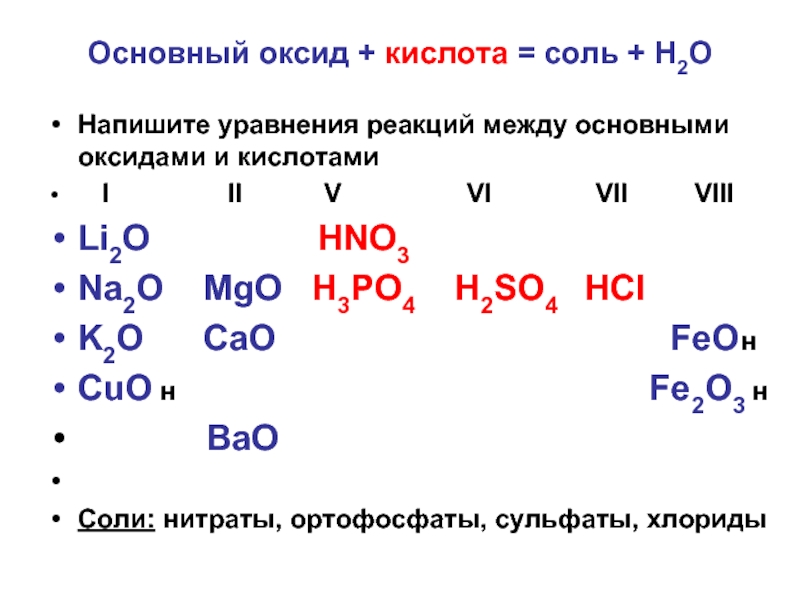
Слайд 7Основный оксид + кислота = соль + Н2О
Напишите уравнения реакций между
основными оксидами и кислотами
I II V VI VII VIII
Li2O HNO3
Na2O MgO H3PO4 H2SO4 HCl
K2O CaO FeOн
CuO н Fe2O3 н
BaO
Соли: нитраты, ортофосфаты, сульфаты, хлориды
I II V VI VII VIII
Li2O HNO3
Na2O MgO H3PO4 H2SO4 HCl
K2O CaO FeOн
CuO н Fe2O3 н
BaO
Соли: нитраты, ортофосфаты, сульфаты, хлориды
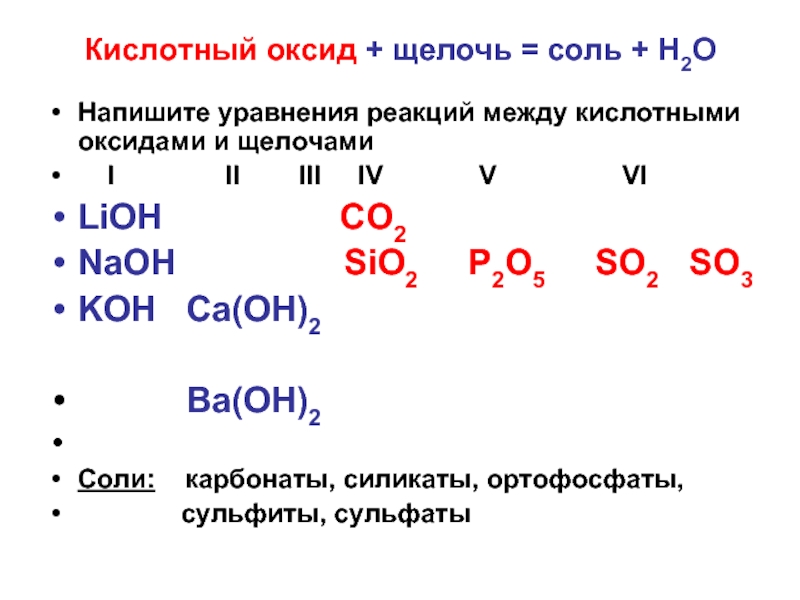
Слайд 8Кислотный оксид + щелочь = соль + Н2О
Напишите уравнения реакций между
кислотными оксидами и щелочами
I II III IV V VI
LiOН СО2
NaOН SiO2 P2O5 SO2 SO3
KOН Ca(OН)2
Ba(OН)2
Соли: карбонаты, силикаты, ортофосфаты,
сульфиты, сульфаты
I II III IV V VI
LiOН СО2
NaOН SiO2 P2O5 SO2 SO3
KOН Ca(OН)2
Ba(OН)2
Соли: карбонаты, силикаты, ортофосфаты,
сульфиты, сульфаты
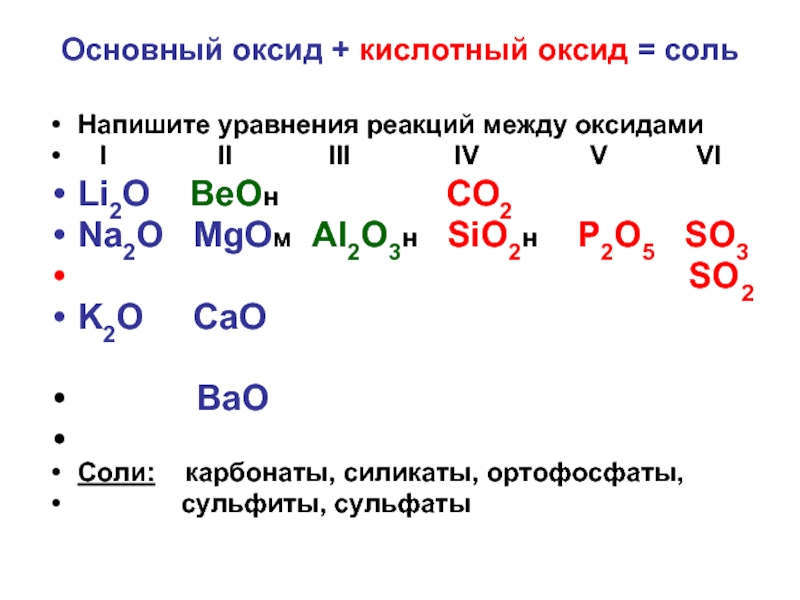
Слайд 9Основный оксид + кислотный оксид = соль
Напишите уравнения реакций между оксидами
I II III IV V VI
Li2O ВеОн CO2
Na2O MgOм Al2O3н SiO2н P2O5 SO3
SO2
K2O CaO
BaO
Соли: карбонаты, силикаты, ортофосфаты,
сульфиты, сульфаты
Li2O ВеОн CO2
Na2O MgOм Al2O3н SiO2н P2O5 SO3
SO2
K2O CaO
BaO
Соли: карбонаты, силикаты, ортофосфаты,
сульфиты, сульфаты
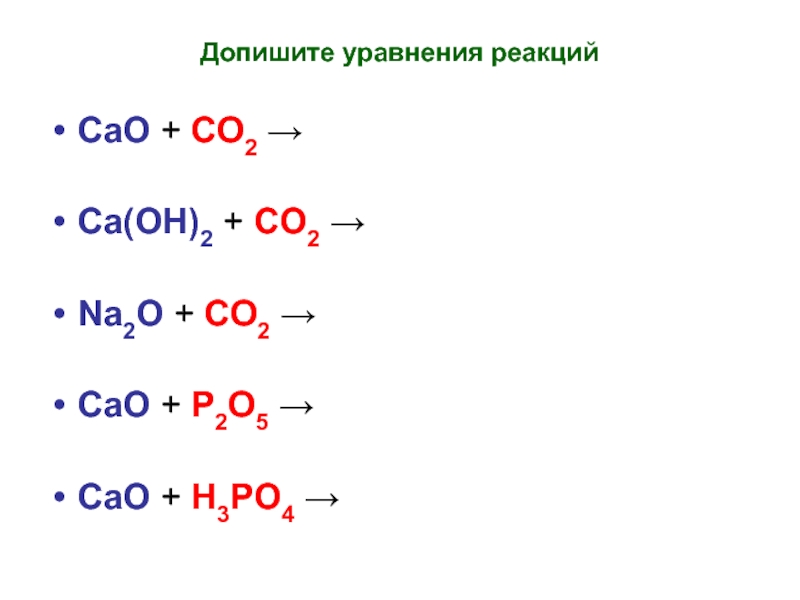
Слайд 10Допишите уравнения реакций
СаО + СО2 →
Са(ОН)2 + СО2 →
Nа2О
+ СО2 →
СаО + P2О5 →
CaO + H3PO4 →
СаО + P2О5 →
CaO + H3PO4 →
Слайд 13Ва → ВаО → Ва(ОН)2 → Ва3(РО4)2
↓
Ва3(РО4)2
S → SO2 → SO3 → H2SO4
↓ два способа
K2SO4
Fe(OH)3 → Fe2O3 → Fe2(SO4)3
РН3 → Р2О5 → Н3РО4
↓ два способа
Na3PO4
CaSiO3 → CaO → Ca(OH)2 → CaCO3
↓
CaCO3
Ва3(РО4)2
S → SO2 → SO3 → H2SO4
↓ два способа
K2SO4
Fe(OH)3 → Fe2O3 → Fe2(SO4)3
РН3 → Р2О5 → Н3РО4
↓ два способа
Na3PO4
CaSiO3 → CaO → Ca(OH)2 → CaCO3
↓
CaCO3
Слайд 14Генетическая связь неорганических веществ
Металл → основный оксид → щелочь → соль
Li
→ Li2O → LiOH → LiNO3
↓ → Li2CO3
Li3PO4 → Li3PO4
Ca → CaO → Ca(OH)2 → Ca(NO3)2
↓ → CaCO3
Ca3(PO4)2 → Ca3(PO4)2
↓ → Li2CO3
Li3PO4 → Li3PO4
Ca → CaO → Ca(OH)2 → Ca(NO3)2
↓ → CaCO3
Ca3(PO4)2 → Ca3(PO4)2
Слайд 15Генетическая связь неорганических веществ
Неметалл → кислотный оксид → кислота → соль
С
→ СО2 ↔ Н2СО3
↓ два способа
СаСО3
Р → Р2О5 → Н3РО4
↓ два способа
Са3(РО4)2
↓ два способа
СаСО3
Р → Р2О5 → Н3РО4
↓ два способа
Са3(РО4)2
Слайд 16По названию напишите формулу оксида нужным цветом: основный, кислотный, амфотерный
Оксид натрия
Оксид
серы (IV)
Оксид алюминия
Оксид хрома (VI)
Оксид бария
Оксид азота (I)
Оксид алюминия
Оксид хрома (VI)
Оксид бария
Оксид азота (I)
Слайд 17Напишите формулы щелочей и кислот, соответствующих данным оксидам
СаО
СО2
К2О SO3
N2O5 BaO
SO2 P2O5
SiO2 СаО
К2О SO3
N2O5 BaO
SO2 P2O5
SiO2 СаО


![Основный оксид + H2O = щелочь [p] Запомни! Li2O + H2O = 2LiOHNa2O + H2O](/img/tmb/1/34202/4436b6086efa0ef41cf6d752306c1552-800x.jpg)