- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Окислительно – восстановительные реакции Опорные понятия теории ОВР. Опорные понятия теории ОВР. Частицы, отдающие электроны – восстановители. Частицы, презентация
Содержание
- 2. Окислительно – восстановительные реакции
- 4. Опорные понятия теории ОВР. Частицы, отдающие
- 5. Задание №1. Какие из
- 6. Степень окисления.
- 7. Степень окисления -
- 8. Степень окисления изолированных атомов равна 0 Степень
- 9. Степень окисления фтора в соединениях равна -1
- 10. Степень окисления щелочноземельных Ме и Mg в
- 11. Как определить степень окисления?
- 15. Задание №1 Определите степени окисления элементов
- 16. Задание №1 Определите степени окисления элементов
- 18. Задание №2. Определите степени окисления элементов в
- 19. Задание №2. Определите степени окисления элементов в
- 20. Определение степени окисления углерода в
- 21. Классификация окислительно-восстановительных реакций
- 22. ОВР Межмолекулярные А0+В0 → А+ В- Контрпропорцио-
- 23. Задание К какому типу ОВР относятся реакции,
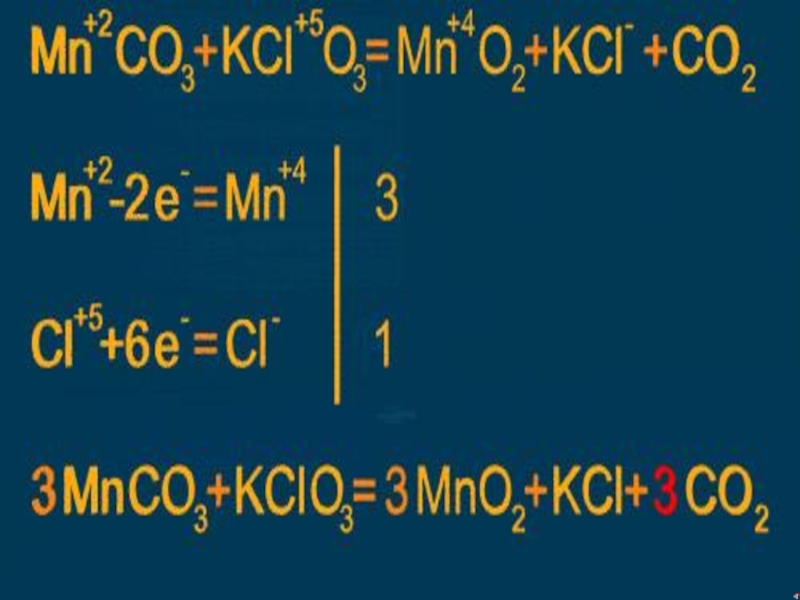
- 24. Расстановка коэффициентов в ОВР методом электронного баланса.
- 28. А что в ЕГЭ? Используя
- 29. Презентация подготовлена учащимися 11 «Б» класса МОУ «Средняя общеобразовательная школа №17» г.Калуги Ноябрь 2007 г.
Слайд 4 Опорные понятия теории ОВР.
Частицы, отдающие электроны – восстановители.
Частицы, принимающие электроны
Процесс отдачи электронов частицей – процесс окисления.
Процесс присоединения электронов – процесс восстановления.
Слайд 5 Задание №1.
Какие из перечисленных ниже процессов представляют собой:
Cl2 + 2ẽ → 2Cl - Fe+3 + ẽ → Fe+2
Ni0 - 2ẽ → Ni+2 S-2 - 2ẽ → S0
Слайд 7
Степень окисления -
условный заряд,
числу смещённых электронов от атома одного
элемента к атому другого элемента в соедине-
нии(условно считаем, что соединение состоит
только из ионов).
Слайд 8Степень окисления изолированных атомов равна 0
Степень окисления простых веществ равна 0
Степень
ЗАПОМНИ:
Слайд 9Степень окисления фтора в соединениях равна -1
Степень окисления щелочных Ме в
Степень окисления кислорода в соединениях равна -2, кроме: O+2F2 , Н2О2-1,
Ме2+1О2-1, Ме+1О2-1/2
ЗАПОМНИ:
Слайд 10Степень окисления щелочноземельных Ме и Mg в соединениях равна +2
Высшая положительная
Низшая отрицательная степень окисления равна числу ē, недостающих до завершения внешнего энергетического уровня
ЗАПОМНИ:
Слайд 15Задание №1
Определите степени окисления элементов в соединениях, формулы которых:
KMnO4; HClO3;
Na2CrO4
Слайд 16Задание №1
Определите степени окисления элементов в соединениях, формулы которых:
K+1Mn+7O4-2; H+1Cl+3O3-2;
Na2+1Cr+6O4-2
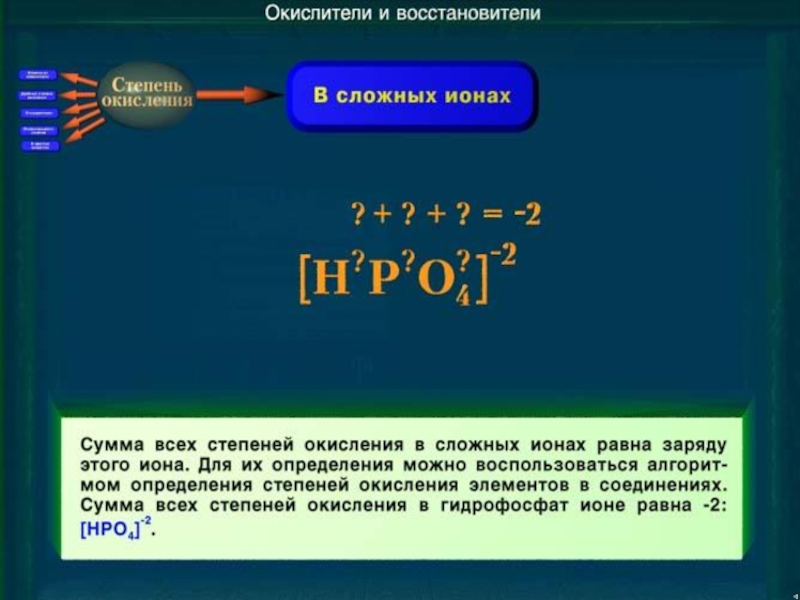
Слайд 18Задание №2.
Определите степени окисления элементов в ионах:
(Cr2O7)2-; (SO3)2-;
(AsO4)3-; (P2O7)4-
Слайд 19Задание №2.
Определите степени окисления элементов в ионах:
(Cr2+6O7-2)2-; (S+4O3-2)2-;
(As+5O4-2)3-; (P2+5O7-2)4-
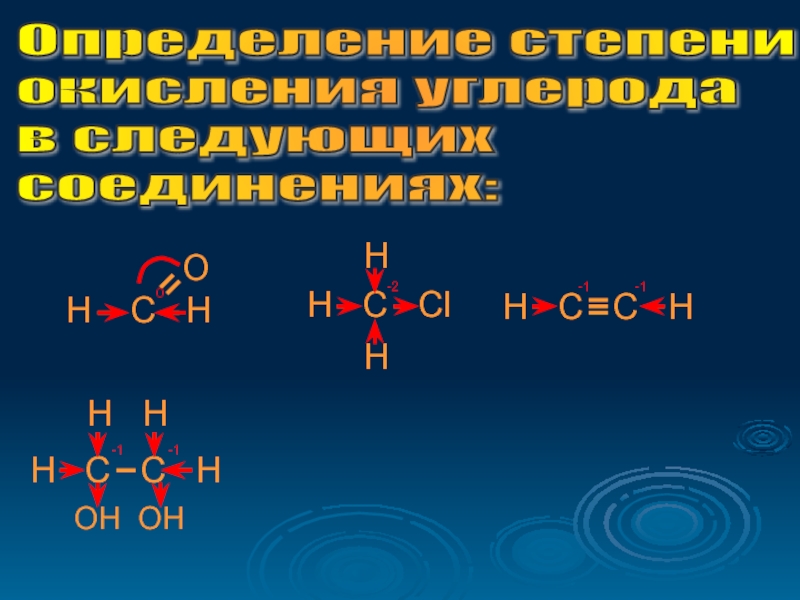
Слайд 20Определение степени
окисления углерода
в следующих
соединениях:
H C H
0
H C Cl
H
H
-2
H C C H
-1
-1
H C C H
H H
OH OH
-1
-1
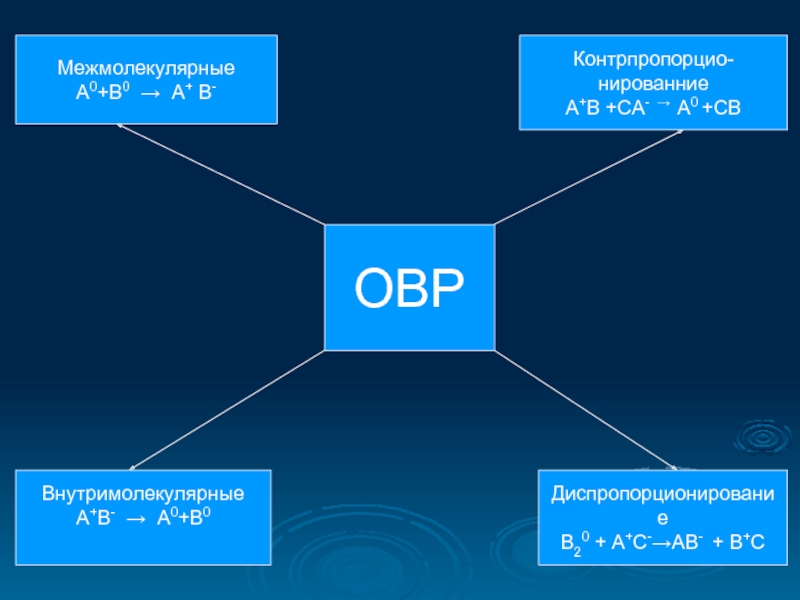
Слайд 22ОВР
Межмолекулярные
А0+В0 → А+ В-
Контрпропорцио-
нированние
A+B +CA- → A0 +CB
Внутримолекулярные
А+В- → А0+В0
Диспропорционирование
B20 +
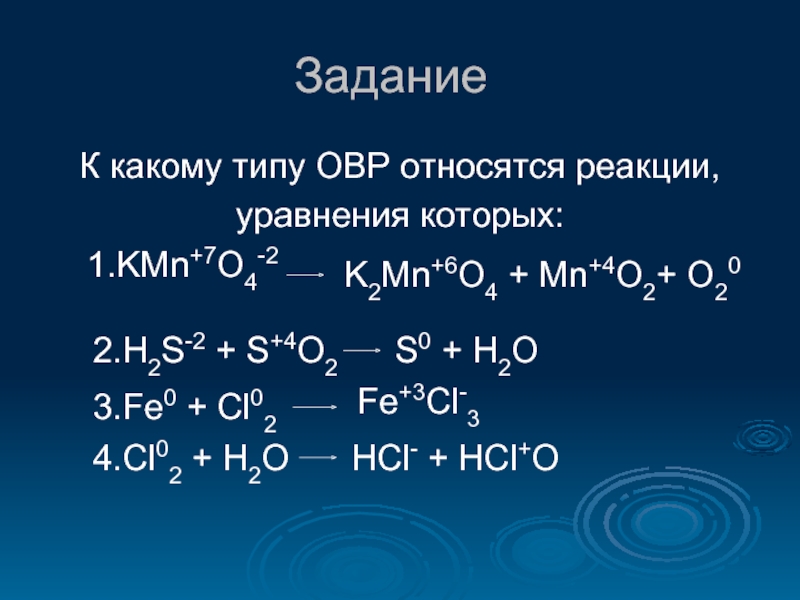
Слайд 23Задание
К какому типу ОВР относятся реакции,
уравнения которых:
1.KMn+7O4-2
K2Mn+6O4 + Mn+4O2+
2.H2S-2 + S+4O2
S0 + H2O
3.Fe0 + Cl02
Fe+3Cl-3
4.Cl02 + H2O
HCl- + HCl+O
Слайд 28
А что в ЕГЭ?
Используя метод электронного баланса, составьте уравнение реакции:
SO2
Слайд 29Презентация подготовлена учащимися 11 «Б» класса МОУ «Средняя общеобразовательная школа №17»
Ноябрь 2007 г.