- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Охарактеризовать строение и состав атома, а также составить схему распределения электронов по энергетическим уровням в атоме алюминия и хлора. презентация
Содержание
- 2. Охарактеризовать строение и состав атома, а
- 3. Расположите химические элементы в порядке увеличения
- 4. Cоставьте формулы высшего оксида и летучего водородного соединения для:
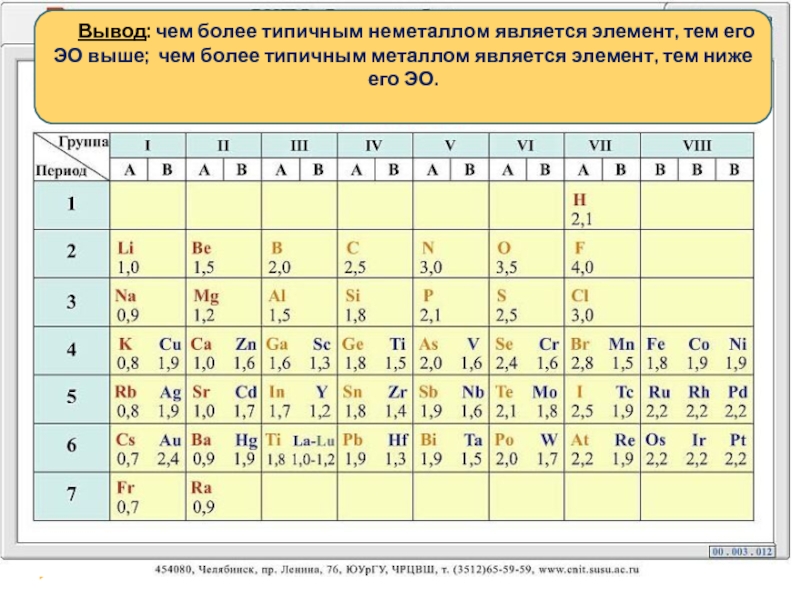
- 5. Электроотрицательность химических элементов
- 6. Электроотрицательность - это свойство атомов
- 7. Л. Полинг
- 8. Вывод: чем
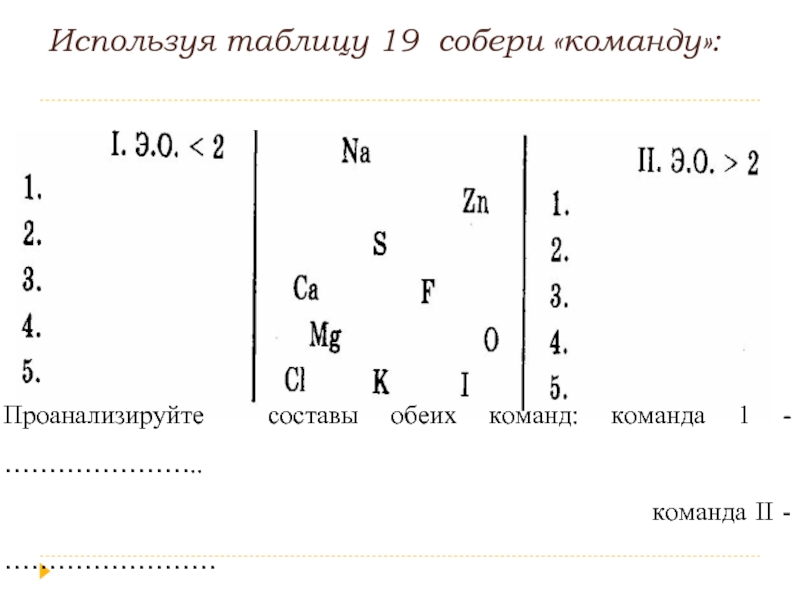
- 9. Используя таблицу 19 собери «команду»: Проанализируйте
- 10. В приведенных ниже формулах подчеркните атомы наиболее
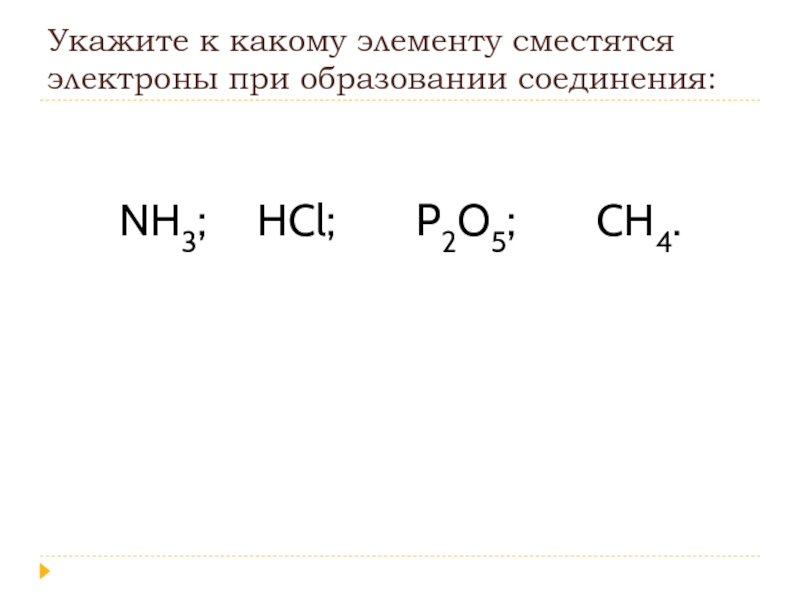
- 11. Укажите к какому элементу сместятся электроны при
- 12. С помощью знаков >или < покажите, у
- 13. Не пользуясь таблицей электроотрицательнос-тей, а только руководствуясь
- 14. Объясните причину большей ЭО одного из химических
- 15. Домашнее задание Изучить § 40 1. Сравните
Слайд 2
Охарактеризовать строение и состав атома, а также составить схему распределения электронов
Слайд 3
Расположите химические элементы в порядке увеличения атомного радиуса.
1) О,
1) C, 2) Bе, 3) B, 4)Li ______________________________________________
1) Al, 2) Cl, 3) P, 4) S ______________________________________________
1) N, 2) Sb, 3) P, 4)As ______________________________________________
Слайд 6
Электроотрицательность - это свойство атомов элемента оттягивать на себя электроны от
Слайд 8
Вывод: чем более типичным неметаллом является элемент, тем
Слайд 9Используя таблицу 19 собери «команду»:
Проанализируйте составы обеих команд: команда 1 -
команда II - ……………………
Слайд 10В приведенных ниже формулах подчеркните атомы наиболее ЭО химического элемента:
Слайд 11Укажите к какому элементу сместятся электроны при образовании соединения:
NH3;
Слайд 12С помощью знаков >или < покажите, у какого элемента электроотрицательность имеет
а) H Cl
б) S O
в) Na Cl
г) Cu O
д) O F
е) Mg Al
Слайд 13Не пользуясь таблицей электроотрицательнос-тей, а только руководствуясь положением химических элементов в
а) O, P, S …………………………...
б)Mg, Si, Al …………………………..
Слайд 14Объясните причину большей ЭО одного из химических элементов в паре, если
+14 и +17
+7 и +15
Слайд 15Домашнее задание
Изучить § 40
1. Сравните значения ЭО элементов в парах:
кислород и углерод,
натрий и магний,
магний и литий.
2. Не пользуясь таблицей электроотрицательностей, а только руководствуясь положением химических элементов в периодической таблице, расположите перечисленные элементы в порядке возрастания электроотрицательности их атомов:
а) S, Cl, Br ………………………
б) C, Si, N ……………………………
3. Объясните причину большей электроотрицательности одного из химических элементов в паре, если известны заряды их атомных ядер:
а) +6 и +8…………….
б) +12 и +20…………