- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Наследственные эндокринопатии презентация
Содержание
- 1. Наследственные эндокринопатии
- 2. Наследственные болезни эндокринной системы обусловлены мутациями в
- 3. Так, различные синдромы гиперальдостеронизма и гипоальдостеронизма связаны с избыточной продукцией или дефицитом альдостерона
- 4. Наследственная недостаточность гормона роста ассоциирована с различными
- 5. Аутоиммунное поражение островкового аппарата поджелудочной железы,
- 6. В этиологии большинства случаев сахарного диабета
- 7. Наследственный альдостеронизм
- 8. Нарушения водно-солевого обмена являются ведущими клиническими проявлениями
- 9. Этот ген кодирует полипептид 2 субсемейства 11b
- 11. Как многие другие адреналовые цитохромы P-450, альдостеронсинтетаза
- 12. Мутации, затрагивающие разные активности фермента, приводят к
- 13. При биохимическом исследовании выявляются гипонатриемия, гиперкалиемия и
- 14. Недостаточность КМОI и КМОII ведет
- 15. При первом варианте с недостаточностью КМОI
- 16. При втором варианте заболевания адреналовые кризы с
- 17. Наследственный гиперальдостеронизм является гетерогенной группой заболеваний.
- 18. Чаще этот тип гиперальдостеронизма рассматривается к одна из моногенных формам артериальной гипертензии - дексаметазон-чувствительная гипертония
- 19. Аутосомно-доминантный тип III заболевания обусловлен мутациями в
- 20. Нарушения в работе других ионных каналов также
- 21. Сопутствующими проявлениями заболевания являются артериальная гипертензия, легочная гипертензия и врожденные пороки сердца
- 22. Синдром Барттера является необычной формой вторичного
- 23. Болезнь развивается вследствие нарушения реабсорбции хлорида натрия
- 24. Ведущими клиническими проявлениями заболевания являются задержка роста,
- 25. Наследственные формы синдрома Барттера – это гетерогенная
- 26. Антенатальный тип 2 синдрома Барттера связан с
- 27. Причиной развития младенческого дигенного типа 4B
- 28. Псевдогипоальдостеронизм I типа обусловлен снижением чувствительности канальцевого
- 29. Типичными для этой патологии являются инфекционные поражения
- 30. Наследственные формы заболевания генетически гетерогенны. Аутосомно-доминантная
- 31. Причиной развития аутосомно-рецессивного псевдогипоальдостеронизма типа IВ
- 32. Псевдогипоальдостеронизм II типа, известный как синдром Гордона,
- 33. Наследственные формы заболевания также генетически гетерогенны.
- 34. Другим регулятором этого котранспортера является транскрипционный фактор
- 35. Еще один аутосомно-доминантный тип заболевания обусловлен
- 36. Таким образом, все генетические формы псевдогипоальдостеронизма
- 37. Гипофизарный нанизм
- 38. Рост скелета и мягких тканей организма индуцируется
- 39. После высвобождения из гипотоламуса биологически активный гормон
- 40. Соматомедины являются членами инсулинового семейства полипептидных факторов
- 41. Существует два гена гормона роста: нормальный —
- 42. В настоящее время в этом кластере генов
- 43. Тип заболевания IA является наиболее тяжелой
- 44. В большинстве случаев задержка роста диагностируется уже
- 45. Экзогенный гормон роста при данном типе
- 46. При варианте недостаточности IВ содержание гормона роста
- 47. При некоторых формах карликовости, сходных по своим
- 48. Тип II семейной изолированной недостаточности гормона роста
- 49. При аутосомно-доминантном синдроме Коварского уровень иммунореактивных форм
- 50. При этом больные хорошо отвечают на терапию
- 51. Мутации в гене рецептора гормона роста
- 52. При синдроме Ларона наблюдается выраженная задержка роста,
- 53. Болезнь наследуется по аутосомно-рецессивному типу и чаще
- 54. Инактивирующие мутации в генах инсулиноподобного фактора роста
- 55. У таких больных наблюдается нормальный уровень гормона
- 56. Пангипопитуитарная карликовость, или низкий рост в
- 57. Наряду с этим, описаны моногенные формы пангипопитуитаризма,
- 58. Мутации в этих генах приводят к комбинированной
- 59. Так, полное отсутствие гормона роста и
- 60. У больных с раннего детского возраста наблюдается
- 61. Другой аутосомно-рецессивный тип пангипопитуитарной карликовости, сочетающийся с
- 62. Причем подобная гормональная недостаточность у разных больных
- 63. Однако в большинстве случаев болезнь проявляется карликовостью,
- 64. Мутации в гене LHX3 приводят к дефициту
- 65. Остальные типы пангипопитуитарной карликовости наследуются по аутосомно-доминантному
- 66. Недостаточность гормонов гипофиза в сочетании с пороками
- 67. Наследственные болезни тиреоидного обмена
- 68. Одной из причин снижения функции щитовидной железы
- 69. При этом нарушается обмен мукополисахаридов и в
- 70. Однако при раннем назначении больным гормонов щитовидной
- 71. Тяжелая форма врожденного гипотиреоза выявляется сразу после
- 72. Для больных характерны большая масса тела, увеличение
- 74. Наиболее яркая картина врожденного гипотиреоза проявляется к
- 75. В 85% случаев причиной наследственного врожденного гипотиреоза
- 76. Аутосомно-доминантные типы врожденного незобного гипотиреоза генетически гетерогенны.
- 77. Мальформации щитовидной железы характерны для типов заболевания,
- 78. Продуктом гена CSX является кардиоспецифический транскрипционный фактор
- 79. Другие наследственные болезни тиреоидного обмена могут быть
- 80. Наследственные формы ожирения
- 81. При ожирении наблюдается патологическое увеличение массы тела
- 82. Важная роль в поддержании энергетического равновесия принадлежит
- 83. Поэтому ожирение может быть результатом как наследственных
- 84. Предполагается, что изменчивость массы жира у человека
- 85. Гены-кандидаты, ассоциированные с ожирением, во многих случаях
- 86. Действие лептина противоположно действию «гормона голода» -
- 87. При этом активизируется метаболическая цепь, которая заканчивается
- 88. Мутации в гене лептина (LEP) и его
- 89. Этот прогормон является предшественником, по крайней мере,
- 90. У больных, наряду с ожирением, которое наблюдается
- 91. К сходной форме ожирения приводят рецессивные мутации
- 92. В этом случае у больных развивается гиперпроинсулинемия,
- 93. Однако наиболее частым является аутосомно-доминантный тип ожирения,
- 94. Избыточная масса тела является одним из ведущих
- 95. Синдром Прадера-Вилли относится к болезням геномного импринтинга
- 96. После 6-месячного возраста развивается полифагия, ожирение.
- 98. При синдроме Барде-Бидля, ожирение может сочетаться
- 99. Синдром Барде-Бидля– это гетерогенная группа аутосомно-рецессивных
- 100. Для многих генетических типов синдрома Барде-Бидля характерно
- 101. При синдроме Альстрема ожирение с гиперинсулинемией сочетается
- 102. У больных с аутосомно-рецессивным синдромом Коэна при
- 103. Отмечаются характерные лицевые особенности – антимонголоидный разрез
- 104. Сахарный диабет 1 и 2 типов
- 105. Сахарный диабет — это частое хроническое заболевание,
- 106. При ИЗСД развивается абсолютная недостаточность инсулина, а
- 107. ИЗСД отличает разнообразие этиологии и патогенеза, при
- 108. Характерными проявлениями заболевания являются жажда, полиурия, потеря
- 109. Конкордантность среди монозиготных близнецов варьирует от 30%
- 110. Значительная часть наследственной предрасположенности к ИЗСД
- 111. Наиболее значимыми предрасполагающими аллелями являются DR3, DR4
- 112. Другими значимыми генетическими факторами риска ИЗСД
- 113. Сахарный диабет 2 типа обычно развивается в
- 114. Сопутствующими этиотропными факторами ИНСД являются ожирение и
- 115. Это приводит к инсулиновой недостаточности, нарушению толерантности
- 116. В этиологии ИНСД генетические факторы могут определять
- 117. Показано, что в основе патогенеза подобных
- 118. В других семьях причиной наследуемого по материнской
- 119. MODY-диабет наследуется по аутосомно-доминантному типу.
- 120. В настоящее время идентифицировано 11 генетических типов
- 121. Этот тип заболевания часто обнаруживается у детей
- 122. Часто MODY-диабет может быть связан с нарушением
- 123. При других генетических типах заболевания мутации найдены
- 124. Мутации в гене инсулинового рецептора (INSR) приводят
- 125. У больных могут наблюдаться как нарушение толерантности
- 126. Лепречаунизм может проявляться задержкой внутриутробного развития, низким
- 127. Синдром Рабсона-Менденхолла отличается более мягким течением и
- 128. Такое разное проявление мутаций в одном и
- 129. При мягких формах инсулинорезистентности чаще всего находят
- 130. Генетические причины развития многофакторного ИНСД очень разнообразны.
- 131. Продукт этого гена участвует в формировании жировой
- 132. С повышенными частотами у больных присутствуют полиморфные
- 133. Найдена ассоциация сахарного диабета 2 типа с
- 134. Благодарю за внимание
Слайд 1Наследственные эндокринопатии
В. Н. Горбунова
Санкт-Петербургский государственный педиатрический медицинский университет
Слайд 2Наследственные болезни эндокринной системы обусловлены мутациями в генах гормонов, их рецепторов,
а также ферментов биосинтеза и метаболизма
Слайд 3Так, различные синдромы гиперальдостеронизма и гипоальдостеронизма связаны с избыточной продукцией или
дефицитом альдостерона
Слайд 4Наследственная недостаточность гормона роста ассоциирована с различными вариантами карликовости, или нанизма.
Нарушения тиреоидного обмена являются причиной врожденного гипотиреоза.
Генетические нарушения гормональной регуляции запаса энергии в жировой ткани ассоциированы с развитием наследственных форм ожирения
Слайд 5Аутоиммунное поражение островкового аппарата поджелудочной железы, а также инсулинорезистентность инсулинозависимых тканей
приводят к нарушениям всех видов обмена веществ, и, прежде всего, метаболизма углеводов, обуславливая развитие сахарного диабета
Слайд 6В этиологии большинства случаев сахарного диабета участвуют как средовые, так
и генетические факторы, хотя существуют и моногенные формы этого заболевания (MODY-диабет)
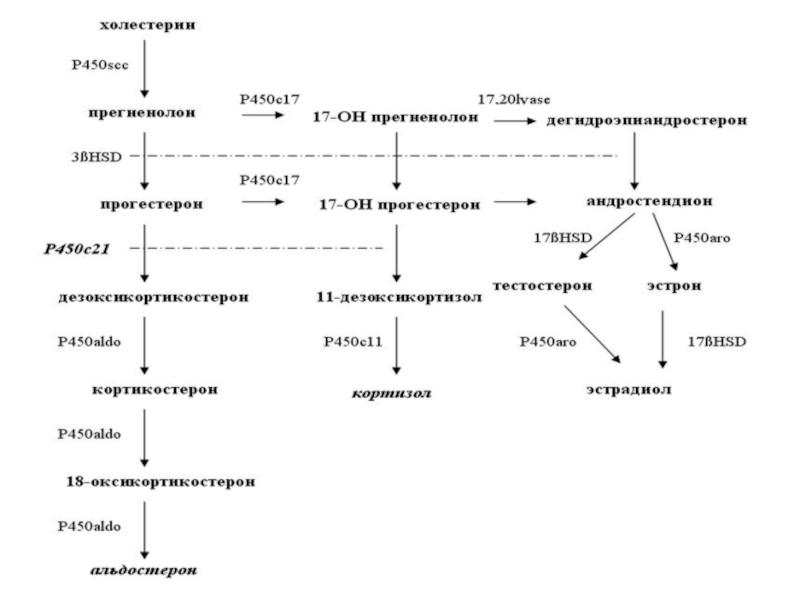
Слайд 8Нарушения водно-солевого обмена являются ведущими клиническими проявлениями различных наследственных типов альдостеронизма.
Аутосомно-рецессивный врожденный гипоальдостеронизм, обусловлен мутациями в гене CYP11B2
Слайд 9Этот ген кодирует полипептид 2 субсемейства 11b митохондриального цитохрома P-450, или
альдостеронсинтетазу — фермент, катализирующий конечный шаг превращения кортикостерона в альдостерон
Слайд 11Как многие другие адреналовые цитохромы P-450, альдостеронсинтетаза обладает множественной ферментативной
активностью.
В клубочковой зоне надпочечников фермент последовательно выполняет функции кортикостеронметилоксидазы
I типа (КМОI), а затем - II типа (КМОII),
то есть производит соответственно
11-бета-гидроксилирование и
18-гидроксилирование
Слайд 12Мутации, затрагивающие разные активности фермента, приводят к двум аллельным вариантам заболевания
с недостаточностью КМОI или КМОII соответственно. Оба варианта характеризуются выраженной потерей натрия и нарушением водно-солевого обмена
Слайд 13При биохимическом исследовании выявляются гипонатриемия, гиперкалиемия и ацидоз. При этих заболеваниях,
вызывающих изолированную недостаточность минералокортикоидов, биосинтез глюкокортикоидов не страдает
Слайд 14Недостаточность КМОI и КМОII ведет к накоплению прямых и отдаленных
субстратов блокированных реакций: дезоксикортикостерона, кортикостерона и
18-гидроксикортикостерона
(в последнем случае только при недостаточности КМОII)
Слайд 15При первом варианте с недостаточностью КМОI болезнь проявляется в неонатальном
периоде в виде частого срыгивания, рвоты, дегидратации, жажды, отказа от пищи, летаргии, судорог.
Подобные кризы в первые недели жизни могут приводить к остановке сердца и гибели больного. Характерны задержка раннего физического развития и отставание в росте. В дальнейшем водно-солевой баланс постепенно нормализуется
Слайд 16При втором варианте заболевания адреналовые кризы с выраженной потерей натрия и
воды и увеличением концентрации калия в крови проявляются уже в неонатальном периоде.
Смерть может наступить в течение первого года жизни.
У выживших детей отмечается задержка роста и ослабление тяжести кризов.
При своевременной диагностике и заместительной гормонотерапии прогноз для жизни при обоих вариантах заболевания благоприятный
Слайд 17Наследственный гиперальдостеронизм является гетерогенной группой заболеваний. Аутосомно-доминантный семейный гиперальдостеронизм I типа,
или глюкокортикоид-подавляемый гиперальдостеронизм
обусловлен микроструктурными перестройками в области локализации генов
CYP11B1 и CYP11B2
Слайд 18Чаще этот тип гиперальдостеронизма рассматривается к одна из моногенных формам артериальной
гипертензии - дексаметазон-чувствительная гипертония
Слайд 19Аутосомно-доминантный тип III заболевания обусловлен мутациями в гене KCNJ5, кодирующем субъединицу
5 G-чувствительного калиевого канала семейства J. Мутации увеличивают проводимость натрия и приводят к тяжелому альдостеронизму с массивной билатеральной гиперплазией надпочечников
Слайд 20Нарушения в работе других ионных каналов также могут приводить к различным
формам альдостеронизма. Так, первичный альдостеронизм с неврологическими аномалиями, включающими генерализованные тонико-клонические судороги, обусловлен мутациями в гене альфа1-субъединицы потенциал-зависимого кальциевого канала L-типа — CACNA1D
Слайд 21Сопутствующими проявлениями заболевания являются артериальная гипертензия, легочная гипертензия и врожденные пороки
сердца
Слайд 22Синдром Барттера является необычной формой вторичного гиперальдостеронизма, при котором гипертрофия и
гиперплазия юкстагломерулярных клеток почечных нефронов сочетается с нормальным артериальным давлением, гипокалиемическим алкалозом при отсутствии эдемы и резистентностью к сосудосуживающему действию ангиотензина II
Слайд 23Болезнь развивается вследствие нарушения реабсорбции хлорида натрия в восходящем колене петли
Генле, где в норме реабсорбируется до 30% фильтрующейся соли
Слайд 24Ведущими клиническими проявлениями заболевания являются задержка роста, гиперактивность ренин-ангиотензиновой системы, гипокалиемия,
увеличение продукции почечных простагландинов, гиперкальциурия и гипомагниемия
Слайд 25Наследственные формы синдрома Барттера – это гетерогенная группа аутосомно-рецессивных заболеваний, вызванных
нарушением работы почечных ионных каналов.
Антенатальный тип 1 заболевания обусловлен мутациями в гене буметанид-чувствительного
Na-K-2Cl котранспортера – SLC12A1
Слайд 26Антенатальный тип 2 синдрома Барттера связан с мутациями в гене АТФ-чувствительного
калиевого канала – KCNJ1.
Тип 3 синдрома Барттера вызван мутациями в гене почечного хлорного канала В – CLCNKB.
Младенческий тип 4А обусловлен мутациями в гене барттина - BSND, выполняющего роль транспортера почечных хлорных каналов А и В
Слайд 27 Причиной развития младенческого дигенного типа 4B синдрома Барттера, сочетающегося с
нейросенсорной тугоухостью, является одновременное присутствие мутаций в двух соседних генах CLCNKA и CLCNKB, продуктами которых являются почечные хлорные каналы А и В соответственно
Слайд 28Псевдогипоальдостеронизм I типа обусловлен снижением чувствительности канальцевого эпителия к альдостерону и
нарушением реабсорбции натрия, приводящим к солевому истощению вследствие полиурии и дегидратации.
В анализах крови обнаруживаются высокая концентрация альдостерона, гипонатриемия, повышенная активность ренина плазмы
Слайд 29Типичными для этой патологии являются инфекционные поражения дыхательных путей. Компенсация водно-солевого
обмена, введение натрия и контроль гиперкалиемии оказывают положительный лечебный эффект у детей более старшего возраста
Слайд 30Наследственные формы заболевания генетически гетерогенны. Аутосомно-доминантная форма псевдогипоальдостеронизма типа IА с
относительно мягким течением обусловлена мутациями в гене минералокортикоидного рецептора — MCR
Слайд 31Причиной развития аутосомно-рецессивного псевдогипоальдостеронизма типа IВ являются нарушения работы эпителиальных натриевых
каналов, обусловленные мутациями в генах
SCNN1A, SCNN1B и SCNN1G
Слайд 32Псевдогипоальдостеронизм II типа, известный как синдром Гордона, клинически характеризуется гиперкалиемией, гиперхлоремией,
метаболическим ацидозом, а также психическими расстройствами, которые могут быть компенсированы при приеме тиазидовых диуретиков.
У детей старшего возраста, подростков и взрослых больных часто выявляется артериальная гипертензия при низком уровне ренина плазмы
Слайд 33Наследственные формы заболевания также генетически гетерогенны. Два аутосомно-доминантных типа заболевания обусловлены
мутациями в генах WNK4 и WNK1, продуктами которых являются две гомологичные серинтреонинкиназы, участвующие в регуляции тиазид-чувствительного Na-Cl—котранспортера
Слайд 34Другим регулятором этого котранспортера является транскрипционный фактор kelch3, кодируемый геном KLHL3.
Мутации в этом гене найдены у больных с аутосомно-рецессивным типом псевдогипоальдостеронизма IID
Слайд 35Еще один аутосомно-доминантный тип заболевания обусловлен мутациями в гене куллина
3 – CUL3.
Куллины участвуют в контроле митотического деления и способны образовывать комплексы с продуктами
KLHL-генов
Слайд 36Таким образом, все генетические формы псевдогипоальдостеронизма II типа связаны с нарушением
работы
тиазид-чувствительного
Na-Cl—котранспортера
Слайд 38Рост скелета и мягких тканей организма индуцируется гормоном роста (соматотропином), который
синтезируется соматотропными клетками передней доли гипофиза.
Центральную роль в секреции гормона роста играет
рилизинг-гормон,
который действует путем связывания со специфическим рецептором
Слайд 39После высвобождения из гипотоламуса биологически активный гормон роста связывается со своим
трансмембранным рецептором, который димеризуется и активирует сигнальную цепь, ведущую к синтезу и секреции инсулиноподобного фактора роста 1, или соматомедина
Слайд 40Соматомедины являются членами инсулинового семейства полипептидных факторов роста и выполняют роль
аутокринных регуляторов клеточной пролиферации.
Комплекс соматомедина с рецептором активирует в клетках-мишенях пути сигнальной трансдукции, необходимые для формирования митогенных и анаболических ответов, ведущих к росту
Слайд 41Существует два гена гормона роста: нормальный — GH1, или GHN, и
вариантный — GH2, или GHV,
а также 3 гена
плацентарного лактогена (CSH).
Все они образуют единый кластер из 5 соседних генов, расположенных в области 17q22-q24 —
(5'-GH1-CSHL1-CSH1-GH2-CSH2-3')
Слайд 42В настоящее время в этом кластере генов мутации, ассоциированные с наследственными
заболеваниями, найдены только в гене
гормона роста — GH1.
Они идентифицированы у больных с четырьмя аллельными вариантами карликовости: семейной изолированной недостаточности гормона роста
IA, IB и II типов, а также
синдромом Коварского
Слайд 43Тип заболевания IA является наиболее тяжелой аутосомно-рецессивной формой карликовости, при
которой гормон роста полностью отсутствует.
Причиной развития этого варианта заболевания являются
нонсенс-мутации или делеции со сдвигом рамки считывания
Слайд 44В большинстве случаев задержка роста диагностируется уже в первом полугодии жизни.
Часто у больных детей развивается ожирение, характерен высокий голос. Дети выглядят моложе своих сверстников. Наблюдается отставание костного возраста.
У взрослых больных при осмотре выявляются элементы преждевременного старения в виде тонкой морщинистой кожи
Слайд 45Экзогенный гормон роста при данном типе заболевания неэффективен. Более того,
у больных в ответ на введение гормона роста вырабатываются антитела, что свидетельствует об его отсутствии в эмбриональном периоде
Слайд 46При варианте недостаточности IВ содержание гормона роста в крови снижено, но
все же определяется. Карликовость менее выражена. Такие больные хорошо отвечают на терапию экзогенным гормоном роста.
Чаще всего у больных обнаруживаются сплайсинговые мутации в гене GH1
Слайд 47При некоторых формах карликовости, сходных по своим клиническим проявлениям с вариантом
IВ, у больных найдены мутации в гене рецептора специфического рилизинг-гормона — GHRHR
Слайд 48Тип II семейной изолированной недостаточности гормона роста наследуется по доминантному типу
и протекает также как тип IВ. Причиной развития этой формы заболевания являются сплайсинговые или миссенс-мутации в гене GH1
Слайд 49При аутосомно-доминантном синдроме Коварского уровень иммунореактивных форм гормона роста сохраняется в
пределах нормы или даже выше, однако его биологическая активность резко снижена, и одновременно наблюдаются аномально низкие уровни соматомедина.
Причиной развития синдрома Коварского являются специфические миссенс-мутации в гене GH1
Слайд 50При этом больные хорошо отвечают на терапию препаратами соматотропного гормона. Оказалось,
что мутантный гормон роста, хотя и способен связываться с рецептором, но это не приводит к его димеризации, а значит и к активации синтеза соматомедина
Слайд 51Мутации в гене рецептора гормона роста – GHR – также приводят
к карликовости, известной как синдром Ларона, или нечувствительность рецептора гормона роста.
При этом содержание соматотропина и его активность сохраняются в пределах нормы, но снижено содержание соматомедина
Слайд 52При синдроме Ларона наблюдается выраженная задержка роста, которая может быть очевидна
уже при рождении.
Кроме того, к проявлениям заболевания относятся ожирение, голубые склеры, лицевой дизморфизм, задержка прорезывания зубов, позднее закрытие родничка, высокий голос, а также гипокалиемия
Слайд 53Болезнь наследуется по аутосомно-рецессивному типу и чаще всего обусловлена мутациями с
преждевременной терминацией трансляции.
Среди них нонсенс-мутация R43X является мажорной
Слайд 54Инактивирующие мутации в генах инсулиноподобного фактора роста 1 (IGF1) и его
рецептора (IGF1R) приводят к двум тяжелым формам аутосомно-рецессивной карликовости, которая в первом случае сочетается с тугоухостью и умственной отсталостью.
Некоторые мутации в гене IGF1R могут оказывать ингибирующее действие на рост даже в гетерозиготном состоянии
Слайд 55У таких больных наблюдается нормальный уровень гормона роста и его рецептора
в сочетании с высоким уровнем соматомедина и снижением количества или чувствительности рецептора соматомедина
Слайд 56Пангипопитуитарная карликовость, или низкий рост в сочетании с дефицитом гормона роста,
гонадотропинов, адренокортикотропного и тиреотропного гормонов,
встречается довольно часто и в большинстве случаев объясняется не наследственными причинами, например, краниофарингеомой
Слайд 57Наряду с этим, описаны моногенные формы пангипопитуитаризма, обусловленные, в частности, нарушением
регуляции синтеза и секреции гормонов роста.
В дифференцировке соматотропных клеток участвуют гены транскрипционных факторов POU1F1, PROP1, LHX3,
LHX4, HESX1, OTX2 и др.
Слайд 58Мутации в этих генах приводят к комбинированной недостаточности гипофизарных гормонов (КНГГ),
при которой у больных наблюдается снижение продукции гормона роста и одного или нескольких других гормонов гипофиза
Слайд 59Так, полное отсутствие гормона роста и пролактина в сочетании с частичной
недостаточностью тиреотропного гормона
может быть обусловлено присутствием инактивирующих мутаций в гене POU1F1
Слайд 60У больных с раннего детского возраста наблюдается грубая задержка роста, у
некоторых развивается тяжелая умственная отсталость.
При магнитно-резонансной томографии может быть обнаружена гипоплазия гипофиза.
В лечении больных используется комбинированная терапия препаратами соматотропного гормона и L-тирозином
Слайд 61Другой аутосомно-рецессивный тип пангипопитуитарной карликовости, сочетающийся с гипогонадизмом, является результатом мутаций
в гене PROP1.
У таких больных, наряду с отсутствием гормона роста, наблюдается недостаточность гонадотропинов, тиреотропного и адренокортикотропного гормонов
Слайд 62Причем подобная гормональная недостаточность у разных больных может появляться в разном
возрасте При тяжелой гипоплазии гипофиза и атрофии надпочечников больные погибают в периоде новорожденности.
У некоторых больных могут развиваться гипогликемические судороги, которые в неонатальном периоде также нередко приводят к летальному исходу
Слайд 63Однако в большинстве случаев болезнь проявляется карликовостью, сходной с синдромом Ларона,
в сочетании с выраженной задержкой репродуктивного развития.
При этом комплексная гормональная заместительная терапия дает положительные результаты
Слайд 64Мутации в гене LHX3 приводят к дефициту гормона роста и гонадотропина.
Клинически болезнь проявляется в форме гипофизарного инфантилизма, сочетающегося с ригидностью шейного отдела позвоночника и варьирующей по степени тяжести нейросенсорной тугоухостью
Слайд 65Остальные типы пангипопитуитарной карликовости наследуются по аутосомно-доминантному типу. Мутации в гене
LHX4 приводят к недостаточности соматотропина в сочетании со снижением продукции тиреоид-стимулирующего и адренокортикотропного гормонов. При этом у больных, наряду с задержкой роста, выявляются пороки развития гипофиза и мозжечка, малые размеры турецкого седла
Слайд 66Недостаточность гормонов гипофиза в сочетании с пороками развития ЦНС характерна для
одного из наиболее распространенных типов пангипопитуитарной карликовости, обусловленной мутациями в гене HESX1. При аутосомно-доминантном типе заболевания, обусловленном мутациями в гене OTX2, гипофизарная дисфункция может сочетаться с микроофтальмией или дистрофией сетчатки
Слайд 68Одной из причин снижения функции щитовидной железы является врожденный гипотиреоз. Болезнь
может развиваться еще во внутриутробном периоде из-за недостаточности тиреотропных гормонов и, прежде всего, вследствие дефицита циркулирующего тироксина
Слайд 69При этом нарушается обмен мукополисахаридов и в тканях накапливается большое количество
креатинина и муцинозного вещества, приводящих к слизистому отеку – микседеме.
Следствием этих процессов является отставание нервно-психического и физического развития ребенка
Слайд 70Однако при раннем назначении больным гормонов щитовидной железы, в частности L-тироксина,
можно предотвратить развитие инвалидизирующей симптоматики и значительно улучшить состояние больного.
Это обусловливает необходимость ранней диагностики заболевания путем биохимического неонатального скрининга
Слайд 71Тяжелая форма врожденного гипотиреоза выявляется сразу после рождения ребенка из-за присутствия
микседемы в сочетании с брадикардией, пупочной грыжей, повышенной сухостью и ломкостью волос, вялостью и сонливостью
Слайд 72Для больных характерны большая масса тела, увеличение языка, сухость, шелушение и
бледность кожных покровов, холодных на ощупь. Голос низкий, «каркающий». При отсутствии лечения отставание психического и физического развития неуклонно прогрессируют, в последующем формируется олигофрения
Слайд 74Наиболее яркая картина врожденного гипотиреоза проявляется к 4-6 месяцам жизни, особенно
при естественном вскармливании.
Дети начинают резко отставать в росте, весе, психическом развитии, вяло реагируют на различные раздражители, перестают узнавать родителей
Слайд 75В 85% случаев причиной наследственного врожденного гипотиреоза является агенезия, гипоплазия или
чаще эктопическая локализация щитовидной железы.
В последнем случае тиреоидная ткань может располагаться в основании языка.
В некоторых случаях болезнь протекает бессимптомно — так называемый компенсированный гипотиреоз
Слайд 76Аутосомно-доминантные типы врожденного незобного гипотиреоза генетически гетерогенны. Высокий уровень тиреотропного гормона
и снижение содержания тиреоидных гормонов наблюдается у больных с мутациями в генах рецепторов тиреотропного гормона –TSHR и THRA, а также бета-субъединицы тиреоид-стимулирующего гормона – TSHB
Слайд 77Мальформации щитовидной железы характерны для типов заболевания, обусловленных мутациями в генах
транскрипционных факторов –
PAX8 и CSX.
Pax8, участвует в дифференцировке тироксин-продуцирующих фолликулярных клеток щитовидной железы
Слайд 78Продуктом гена CSX является кардиоспецифический транскрипционный фактор NKX2-5. Наследственные нарушения в
его работе чаще всего обнаруживаются у больных с врожденными пороками сердца.
Однако некоторые специфические мутации в гене CSX приводят к дисгенезии щитовидной железы, что и объясняет патогенез данного типа врожденного гипотиреоза
Слайд 79Другие наследственные болезни тиреоидного обмена могут быть обусловлены нарушением органификации, транспорта
или рециркуляции йода, а также генерализованной тканевой резистентностью к тиреоидным гормонам или нарушением их внутриклеточного транспорта и метаболизма
Слайд 81При ожирении наблюдается патологическое увеличение массы тела за счет жировой ткани.
Этому способствует положительный энергетический баланс в сочетании с избытком поступающих углеводов, которые накапливаются в организме в виде триглицеридов
в жировой ткани
Слайд 82Важная роль в поддержании энергетического равновесия принадлежит гормонам. Ожирение может развиваться
при уменьшении затрат энергии, повышении эффективности усвоения питательных веществ, недостаточной возможности мобилизовать недостающую энергию из жировых энергетических депо.
В контроле каждого из этих уровней участвуют как генетические, так и средовые факторы
Слайд 83Поэтому ожирение может быть результатом как наследственных нарушений энергетического метаболизма, так
и неправильного образа жизни, касающегося, в первую очередь, характера питания
Слайд 84Предполагается, что изменчивость массы жира у человека на 30-50% обусловлена генетическими
факторами.
В большинстве случаев у больных наблюдается повышенная наследственная предрасположенность к развитию ожирения, которая формируется за счет присутствия функциональных полиморфных аллелей во многих генах
Слайд 85Гены-кандидаты, ассоциированные с ожирением, во многих случаях участвуют в контроле сигнального
пути, ответственного за регуляцию количества энергии, запасаемой в виде жира в организме.
Начинается этот путь с гормона лептина, вырабатываемого адипоцитами
Слайд 86Действие лептина противоположно действию «гормона голода» - грелина. Количество лептина пропорционально
объему жировой ткани.
Из жировой ткани лептин попадает в кровь и достигает специфических рецепторов в гипотоламусе
Слайд 87При этом активизируется метаболическая цепь, которая заканчивается выработкой меланокортина, снижающего потребление
человеком пищи. Генетические нарушения любого из участников этой цепи ведут к развитию синдрома ожирения
Слайд 88Мутации в гене лептина (LEP) и его рецептора (LEPR) приводят к
редким аутосомно-рецессивным формам ожирения.
Примерно у 1% больных с наследственными формами ожирения обнаруживается специфическая мутация Arg236Gly
в гене проопиомеланокортина (POMC3)
Слайд 89Этот прогормон является предшественником, по крайней мере, шести гормонов, включая АКТГ,
липотропин, мелано-стимулирующие гормоны (альфа- и бета-меланотропин, а также меланокортин), эндорфин
Слайд 90У больных, наряду с ожирением, которое наблюдается уже в течение первых
месяцев жизни, как правило, выявляется недостаточность АКТГ в сочетании с рыжим цветом волос
Слайд 91К сходной форме ожирения приводят рецессивные мутации в гене прогормоновой конвертазы
1, участвующей в процессинге АКТГ и меланокортина (PCSK1)
Слайд 92В этом случае у больных развивается гиперпроинсулинемия, так как эта конвертаза
участвует в биогенезе инсулина, переводя проинсулин в активный инсулин в клетках поджелудочной железы. Сопутствующими проявлениями аутосомно-рецессивных форм ожирения могут быть гипогонадотропный гипогонадизм, гипоадренализм и низкий рост
Слайд 93Однако наиболее частым является аутосомно-доминантный тип ожирения, обусловленный мутациями в гене
рецептора 4 меланокортина – MC4R .
Он составляет около 6% всех случаев наследственного ожирения.
В многочисленных исследованиях подтверждена ассоциация
индекса массы тела с генетическими маркерами, сцепленными с геном MC4R
Слайд 94Избыточная масса тела является одним из ведущих клинических проявлений многих наследственных
синдромов – Прадера-Вилли, Альстрема, Барде-Бидля и Лоренса-Муна, Коэна и др.
Слайд 95Синдром Прадера-Вилли относится к болезням геномного импринтинга – у больных инактивированы
локализованные в области 15q11-13 гены отцовского происхождения.
При рождении дети малоподвижны, имеют выраженную мышечную гипотонию, у них снижены сухожильные рефлексы, а также сосательный и глотательный, что затрудняет кормление
Слайд 96После 6-месячного возраста развивается полифагия, ожирение. В пубертатном периоде отмечается проявление
гипогонадотропного гипогонадизма, снижение когнитивных функций и мягкая олигофрения различной степени выраженности.
Больные доброжелательны и безинициативны
Слайд 98При синдроме Барде-Бидля, ожирение может сочетаться с деградацией сетчатки глаз, поликистозом
почек, гипогонадизмом, полидактилией и задержкой умственного развития.
У больных наблюдается склонность к развитию диабета, фиброза печени, атаксии, расстройства речи, асимметрии висцеральных органов, патологии зубов, аносмии, потери слуха
Слайд 99Синдром Барде-Бидля– это гетерогенная группа аутосомно-рецессивных заболеваний. В настоящее время описаны
19 генетических типов этого синдрома, и все они относятся к цилиопатиям.
В большинстве случаев у больных дефектными являются структурные белки комплекса, необходимого для осуществления цилиогенеза (BBS-белки)
Слайд 100Для многих генетических типов синдрома Барде-Бидля характерно «трехаллельное наследование» – присутствие
гомозиготной или компаунд-гетерозиготной мутации в одном из 6 ассоциированных с заболеванием BBS-локусов, в сочетании с гетерозиготной мутацией в любом другом из этих локусов
Слайд 101При синдроме Альстрема ожирение с гиперинсулинемией сочетается с пигментной дегенерацией сетчатки,
прогрессирующей нейросенсорной тугоухостью, дилатационной кардиомиопатией, сахарным диабетом и нефропатией. Причиной этого аутосомно-рецессивного заболевания являются мутации в гене ALMS1, продукт которого также участвует в цилиогенезе
Слайд 102У больных с аутосомно-рецессивным синдромом Коэна при рождении наблюдается низкая масса
тела, мышечная гипотония.
В дальнейшем развивается умеренное ожирение в сочетании с задержкой психомоторного развития, эпилепсией, атаксией и множественными проявлениями скелетной дисплазии
Слайд 103Отмечаются характерные лицевые особенности – антимонголоидный разрез глаз, высокая спинка носа,
постоянно открытый рот косоглазие. Болезнь обусловлена мутациями в гене VPS13B, продукт которого участвует в везикулоопосредуемом внутриклеточном транспорте белков
Слайд 105Сахарный диабет — это частое хроническое заболевание, которым страдает до 12%
населения в странах Европы,
Северной Америки и Африки.
Согласно существующей классификации различают: сахарный диабет 1 типа, или инсулинзависимый (ИЗСД) и сахарный диабет 2 типа, инсулиннезависимый (ИНСД)
Слайд 106При ИЗСД развивается абсолютная недостаточность инсулина, а особенностью патогенеза ИНСД является
относительная недостаточность инсулина или инсулинорезистентность инсулинозависимых тканей.
При сахарном диабете нарушаются все виды обмена веществ, но главным проявлением болезни является гипергликемия
Слайд 107ИЗСД отличает разнообразие этиологии и патогенеза, при этом в основе развития
сахарного диабета 1 типа лежит аутоиммунное поражение бета-клеток островков Лангерганса поджелудочной железы, что приводит к дефициту синтеза проинсулина и гипергликемии
Слайд 108Характерными проявлениями заболевания являются жажда, полиурия, потеря массы тела, нарастающая общая
слабость.
Нередко ИЗСД манифестирует внезапно развитием кетоацидоза и
диабетической комы.
Типичным является наличие осложнений со стороны многих органов, прежде всего, сосудов и почек (диабетические ангиопатии, диабетическая нефропатия)
Слайд 109Конкордантность среди монозиготных близнецов варьирует от 30% до 50%. Риск развития
заболевания у брата или сестры больного составляет 6%.
Таким образом, в этиологии заболевания участвуют как средовые, так и генетические факторы
Слайд 110Значительная часть наследственной предрасположенности к ИЗСД формируется за счет присутствия
специфических полиморфных аллелей в HLA-локусе. Чувствительность к ИЗСД определяется, главным образом, комбинацией аллелей HLA-DR и HLA-DQ локусов гистосовместимости класса II
Слайд 111Наиболее значимыми предрасполагающими аллелями являются DR3, DR4 и DQ-beta .
При наличии соответствующих гаплотипов риск для сибсов пробанда возрастает до 20%. Некоторые аллели HLA-комплекса (DR2, DR5) оказывают протективный эффект в отношении развития диабета
Слайд 112 Другими значимыми генетическими факторами риска ИЗСД являются полиморфные аллели генов
PTPN2, C12ORF30, ERBB3, KIAA0350
Слайд 113Сахарный диабет 2 типа обычно развивается в возрасте 40-60 лет. Вместе
с тем, известны случаи развития ИНСД у лиц в возрасте до 35 лет с сохранной функцией поджелудочной железы, так называемый «диабет взрослого типа у молодых», или MODY-диабет
Слайд 114Сопутствующими этиотропными факторами ИНСД являются ожирение и полифагия, обуславливающими повышенную потребность
в инсулине и, как следствие, вызывающими гипертрофию островков поджелудочной железы с последующим их истощением
Слайд 115Это приводит к инсулиновой недостаточности, нарушению толерантности к глюкозе и развитию
инсулинорезистентности тканей. Часто нарушение толерантности к глюкозе или ИНСД, наряду с ожирением, АГ, дислипопротеинемией и ИБС, являются компонентами метаболического синдрома
Слайд 116В этиологии ИНСД генетические факторы могут определять секреторную недостаточность бета-клеток или
резистентность рецепторов инсулина. Это гетерогенная патология, в которую, наряду с многофакторными, входят и моногенные формы.
В 2-3% случаев диабет наследуется по материнскому типу, причем иногда он сопровождается серьезными нарушениями слуха
Слайд 117 Показано, что в основе патогенеза подобных состояний лежат мутации в
мтДНК.
В некоторых семьях с материнским наследованием ИНСД и тугоухости, развивающейся в третьей или четвертой декаде жизни, идентифицирована протяженная делеция размером в 10,4 кб, затрагивающая более 60% всего митохондриального генома
Слайд 118В других семьях причиной наследуемого по материнской линии синдромального ИНСД являются
точковые мутации
в мтДНК.
Во всех этих случаях диабет связан с дефектами митохондриального окислительного фосфорилирования
Слайд 119MODY-диабет наследуется по аутосомно-доминантному типу. Он составляет 2-5% всех случаев ИНСД.
Эта генетически гетерогенная патология связана с наследственными дефектами секреции инсулина
Слайд 120В настоящее время идентифицировано 11 генетических типов MODY-диабета. Из них наиболее
частым является MODY2, обусловленный присутствием гетерозиготных мутаций в гене глюкокиназы – GCK
Слайд 121Этот тип заболевания часто обнаруживается у детей с мягкой гипергликемией, а
также у женщин с диабетом беременных и семейной историей диабета. Болезнь часто протекает бессимптомно и корригируется диетой.
Инсулиновая терапия необходима только в 2% случаев
Слайд 122Часто MODY-диабет может быть связан с нарушением транскрипционного контроля, обусловленного мутациями
в генах гепатоцитарных ядерных факторов (HNF4A; HNF1A и HNF1B); панкреатического трансактиватора (PDX1);
транскрипционных факторов, участвующих в нейрогенной дифференцировке (NEUROD1) и других
(KLF11 и PAX4)
Слайд 123При других генетических типах заболевания мутации найдены в генах панкреатического липолитического
фермента (CEL);
инсулина (INS);
нерецепторной тирозинкиназы В-клеток (BLK)
Слайд 124Мутации в гене инсулинового рецептора (INSR) приводят к целой серии
аллельных заболеваний, клинические проявления которых весьма разнообразны.
Среди них ИНСД с черным акантозом, некоторые доброкачественные варианты синдрома инсулинорезистентности А, лепречаунизм и синдром Рабсона-Менденхолла
Слайд 125У больных могут наблюдаться как нарушение толерантности к глюкозе, так и
типичная симптоматика ИНСД.
В ряде случаев развивается сахарный диабет с быстрым летальным исходом
Слайд 126Лепречаунизм может проявляться задержкой внутриутробного развития, низким ростом и маленьким весом
при рождении, отсутствием подкожной жировой клетчатки и лицевым дизморфизмом.
Больные дети погибают в первый год жизни от сопутствующих рекуррентных инфекций
Слайд 127Синдром Рабсона-Менденхолла отличается более мягким течением и большей продолжительностью жизни. При
инсулинорезистентности типа А больные доживают до взрослого возраста.
При этом у них наблюдаются выраженная гипергликемия, гиперинсулинемия, черный акантоз и у женщин — гиперандрогенизм, который с возрастом может регрессировать
Слайд 128Такое разное проявление мутаций в одном и том же гене INSR
зависит от характера повреждения инсулинового рецептора.
Оказалось, что при тяжелых вариантах у больных чаще всего присутствуют нонсенс-мутации.
При этом рецептор на мембране либо полностью отсутствует, либо его количество снижено не менее,
чем на 80%
Слайд 129При мягких формах инсулинорезистентности чаще всего находят миссенс-мутации, причем в некоторых
случаях они присутствуют у больных в гетерозиготном состоянии.
Как правило, количество рецепторов сохраняется в пределах нормы, но может быть снижен их аффинитет по отношению к инсулину
Слайд 130Генетические причины развития многофакторного ИНСД очень разнообразны. В 25% случаев обнаруживается
ассоциация заболевания с аллелями гена PPARG , кодирующего
гамма-рецептор, активируемый пролифератором пероксисом
Слайд 131Продукт этого гена участвует в формировании жировой ткани и перекисном окислении
липидов. Мутации в гене PPARG приводят к тяжелым формам
ожирения и семейной липодистрофии 3 типа
Слайд 132С повышенными частотами у больных присутствуют полиморфные аллели в генах транскрипционного
фактора (PAX4), адипонектина (ADIPOQ), рецептора сульфонилмочевины, имеющего высокое сродство к бета-клеткам (ABCC8), трансмембранного белка, дефектного при синдроме Вольфрама, основными клиническими проявлениями которого является диабет в сочетании с глухотой (WFS1)
Слайд 133Найдена ассоциация сахарного диабета 2 типа с полиморфными аллелями генов калиевых
каналов (KCNQ1 и KCNJ15), транскрипционного фактора
АP2-бета (TFAP2B), интерлейкина-6 (IL6), субстрата 2 инсулинового рецептора - глобулина, связывающего половой гормон (SHBG) и др.
Число полиморфных аллелей, ассоциированных с риском развития ИНСД, достигает нескольких сотен