химии высшей категории
МОУ СОШ №66 г.Пензы
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Методика и способы решения расчетных задач презентация
Содержание
- 1. Методика и способы решения расчетных задач
- 2. Что значит научить решать задачи? Научить решать
- 3. Способы решения задач Соотношение масс веществ Сравнение
- 4. Алгебраический Задача: Вычислить массу
- 5. Na2SO3 + H2SO4 = Na2SO4 + SO2
- 6. Na2SO3 + H2SO4 = Na2SO4 + SO2 +H2O …массу 15%-ного раствора сульфита натрия…
- 7. Na2SO3 + H2SO4 = Na2SO4 + SO2
- 8. Na2SO3 + H2SO4 = Na2SO4 + SO2
- 9. Na2SO3 + H2SO4 = Na2SO4 + SO2
- 10. Задача: Вычислить массу железа, полученной из руды, содержащей 464г. магнитного железняка
- 11. Магнитный железняк- Fe3O4 Fe3O4 – 3Fe m(Fe)
- 12. Наглядно-образный
- 13. Наглядно-образный + = NaCl
- 14. Наглядно-образный Задача: Для приготовления 2л.37%-ной
- 15. Наглядно-образный Раствор 2
- 16. Таблично-схематичный Задача:
- 17. Таблично-схематичный Этапы работы:
- 18. Подготовительный этап Ca3(PO4)2 – 2P – P2O5
- 19. Основной этап P2O5 + 6KOH = 2K3PO4
- 20. Основной этап 3H2O+P2O5
- 21. Основной этап 3H2O+P2O5 +
Слайд 2Что значит научить решать задачи?
Научить решать задачи, значит:
Думать
Размышлять
Представлять
Анализировать
Делать выводы
Слайд 3Способы решения задач
Соотношение масс веществ
Сравнение масс веществ
Приведение к единице
Метод пропорции
С использованием
величины «n»
С использованием коэффициента пропорциональности
Алгебраический
Наглядно-образный
Таблично-схематичный
С использованием коэффициента пропорциональности
Алгебраический
Наглядно-образный
Таблично-схематичный
Слайд 4Алгебраический
Задача:
Вычислить массу сульфата натрия, необходимую для реакции с серной
кислотой для получения 16г. сернистого газа
Слайд 5Na2SO3 + H2SO4 = Na2SO4 + SO2 +H2O
m(Na2SO3)= n(Na2SO3)*M(Na2SO3) =
n(SO2)* M(Na2SO3)
=
m(SO2)/M(SO2)* M(Na2SO3)
m(SO2)/M(SO2)* M(Na2SO3)
Слайд 7Na2SO3 + H2SO4 = Na2SO4 + SO2 +H2O
m(р-ра Na2SO3)= m(Na2SO3)/w =
n(Na2SO3)*M(Na2SO3)/w
=
n(SO2)* M(Na2SO3)/w =
(m(SO2)*M(Na2SO3)/(M(SO2)*w)
n(SO2)* M(Na2SO3)/w =
(m(SO2)*M(Na2SO3)/(M(SO2)*w)
Слайд 8Na2SO3 + H2SO4 = Na2SO4 + SO2 +H2O
…объем 15%-ного раствора сульфита
натрия, плотность 1,07г/мл.…
Слайд 9Na2SO3 + H2SO4 = Na2SO4 + SO2 +H2O
V(р-ра Na2 SO3)= m(р-ра
Na2SO3)/g =
m(Na2 SO3)/(w*g) =
n(Na2SO3)*M(Na2SO3)/(w*g) =
n(SO2)* M(Na2SO3)/(w*g) =
(m(SO2)*M(Na2SO3)/(M(SO2)*w*g)
m(Na2 SO3)/(w*g) =
n(Na2SO3)*M(Na2SO3)/(w*g) =
n(SO2)* M(Na2SO3)/(w*g) =
(m(SO2)*M(Na2SO3)/(M(SO2)*w*g)
Слайд 11Магнитный железняк- Fe3O4
Fe3O4 – 3Fe
m(Fe) = n(Fe)*M(Fe) =
3n(Fe3O4)* M(Fe) =
3*m(Fe3O4)*
M(Fe) / M(Fe3O4)
Слайд 12Наглядно-образный
Задача:
Масса поваренной соли, которую следует растворить
в 250г. 10%-ного раствора для получения 18%-ного рассола, равна ____г.
Масса поваренной соли, которую следует растворить
в 250г. 10%-ного раствора для получения 18%-ного рассола, равна ____г.
Слайд 13Наглядно-образный
+
=
NaCl
x
Раствор 1
250
250*0,1
В-во
225
вода
Раствор 2
X+250
x+25
(в-во)
225
(вода)
W=0,18
Слайд 14Наглядно-образный
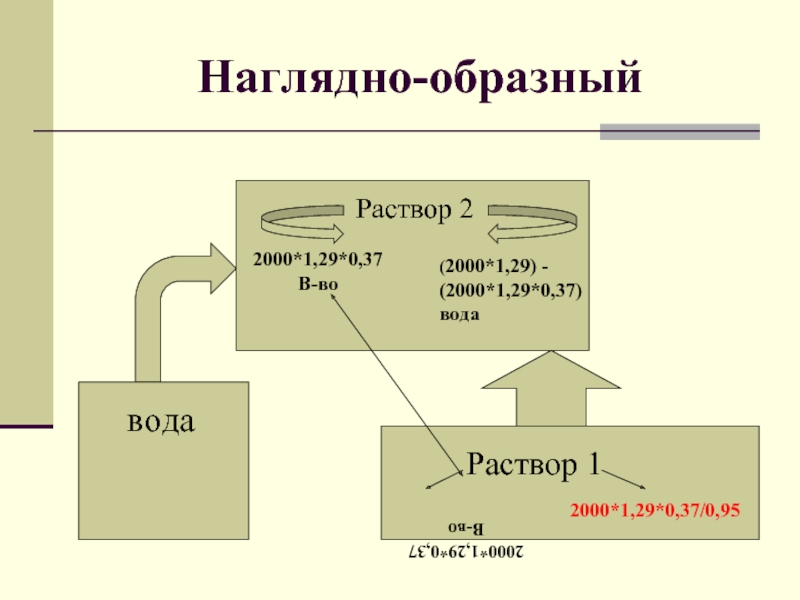
Задача:
Для приготовления 2л.37%-ной аккумуляторной серной кислоты (плотность 1,29г/мл) потребуется
95%-ная серная кислота массой _____г.
Слайд 15Наглядно-образный
Раствор 2
2000*1,29*0,37
В-во
(2000*1,29) - (2000*1,29*0,37)
вода
вода
Раствор 1
2000*1,29*0,37
В-во
2000*1,29*0,37/0,95
Слайд 16
Таблично-схематичный
Задача:
Определите состав раствора, полученного при растворении продукта окисления фосфора,
полученного из 31г. фосфата кальция, в 200г. 8,4%-ного раствора гидроксида калия.
Слайд 17
Таблично-схематичный
Этапы работы:
Подготовительный – расчет «n» веществ
Основной – определение состава раствора
Слайд 18Подготовительный этап
Ca3(PO4)2 – 2P – P2O5
n(P2O5) = n(Ca3(PO4)2)
n(P2O5)= m(Ca3(PO4)2) / M
(Ca3(PO4)2) = 31/310 = 0,1 моль
n(KOH)= 200*0,084/56 = 0,3 моль
n(KOH)= 200*0,084/56 = 0,3 моль
Слайд 20Основной этап
3H2O+P2O5 + 4K3PO4 =6K2HPO4
Было
0,05 0,1
Изр. 0,1/4 0,1
Ост. 0,025 0 0,1/4*6=0,15
Изр. 0,1/4 0,1
Ост. 0,025 0 0,1/4*6=0,15
Слайд 21Основной этап
3H2O+P2O5 + 2K2HPO4 =4KH2PO4
Было
0,025 0,15
Изр. 0,025 0,025*2
Ост. 0 0,1 0,025*4=0,1
Состав: K2HPO4 - 0,1
KH2PO4 - 0,1
Изр. 0,025 0,025*2
Ост. 0 0,1 0,025*4=0,1
Состав: K2HPO4 - 0,1
KH2PO4 - 0,1