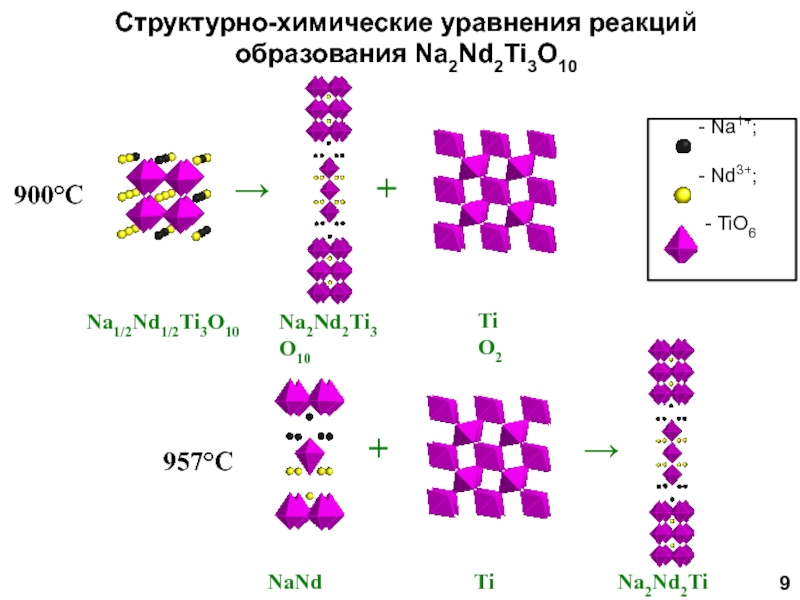
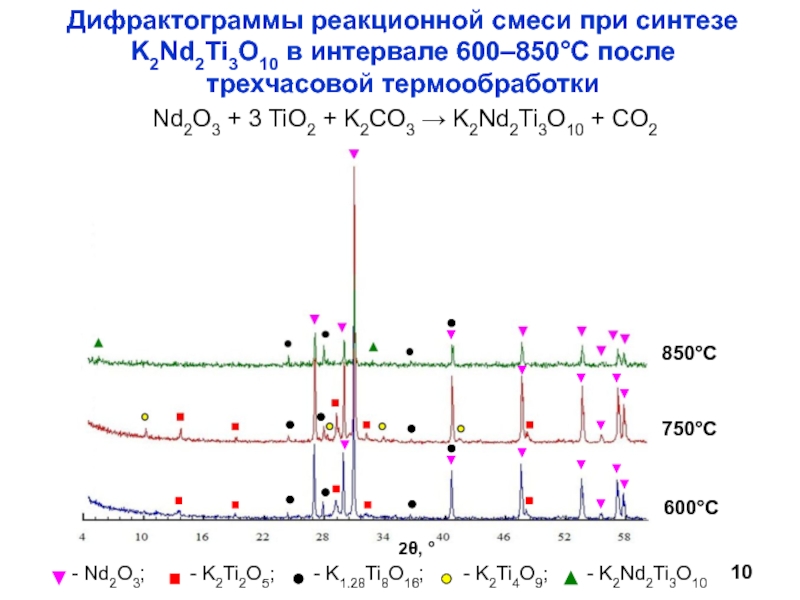
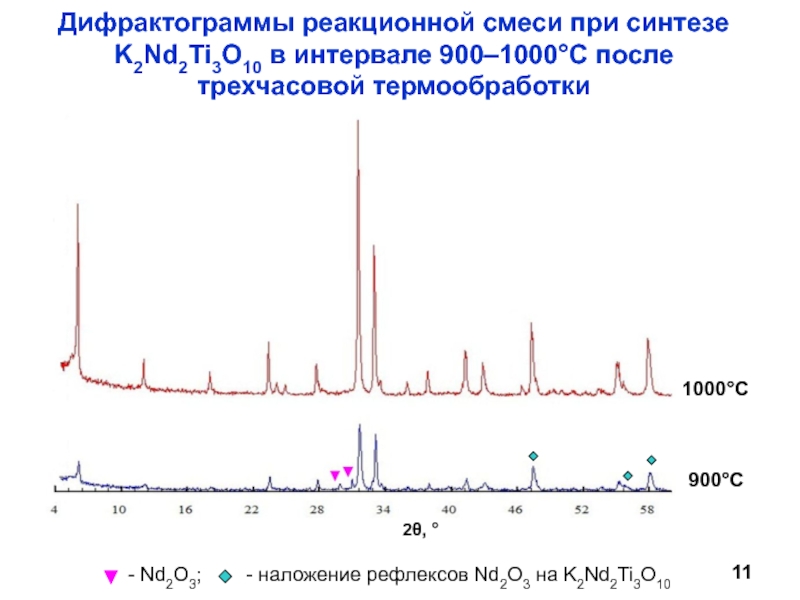
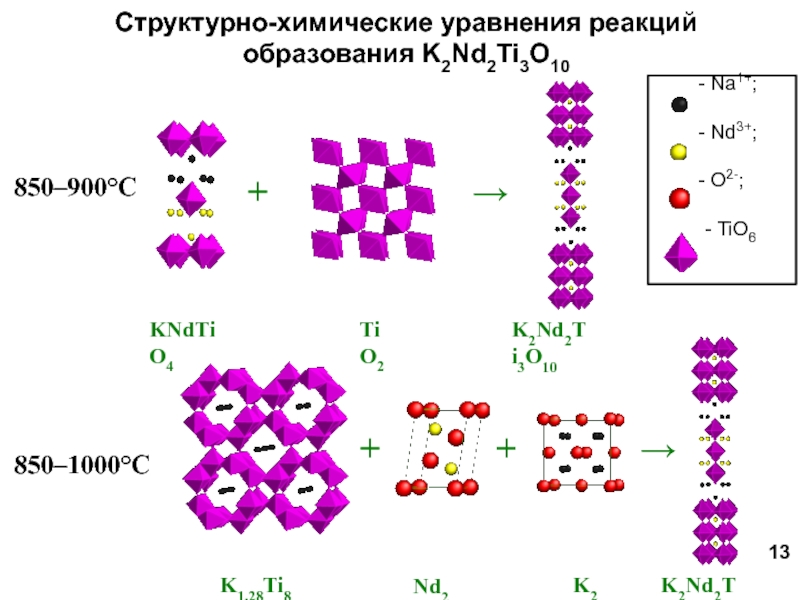
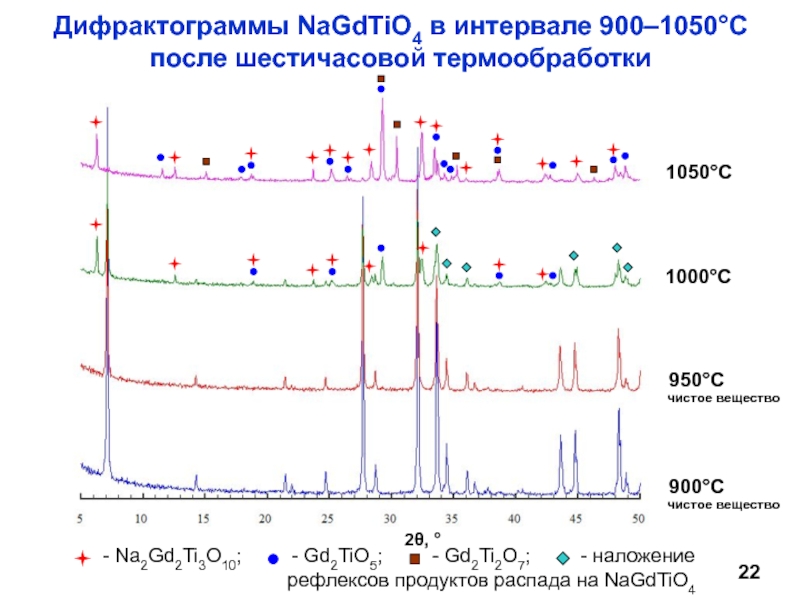
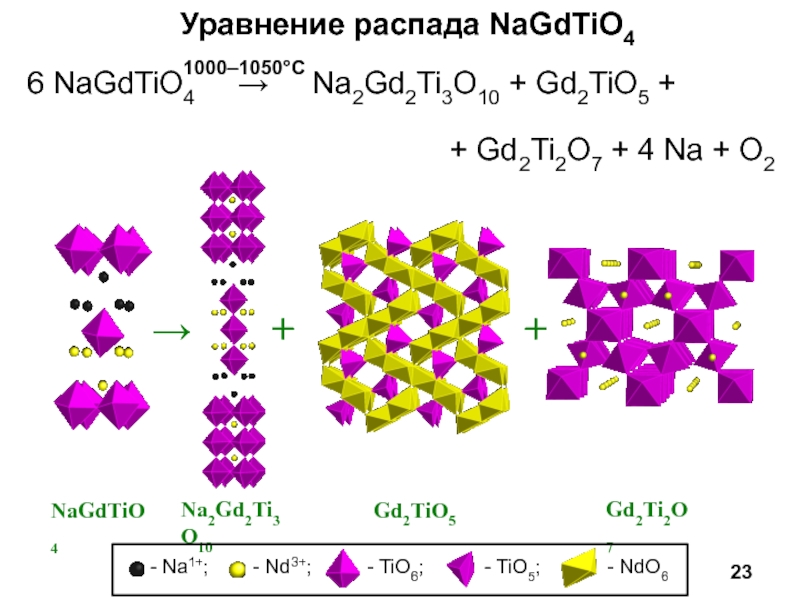
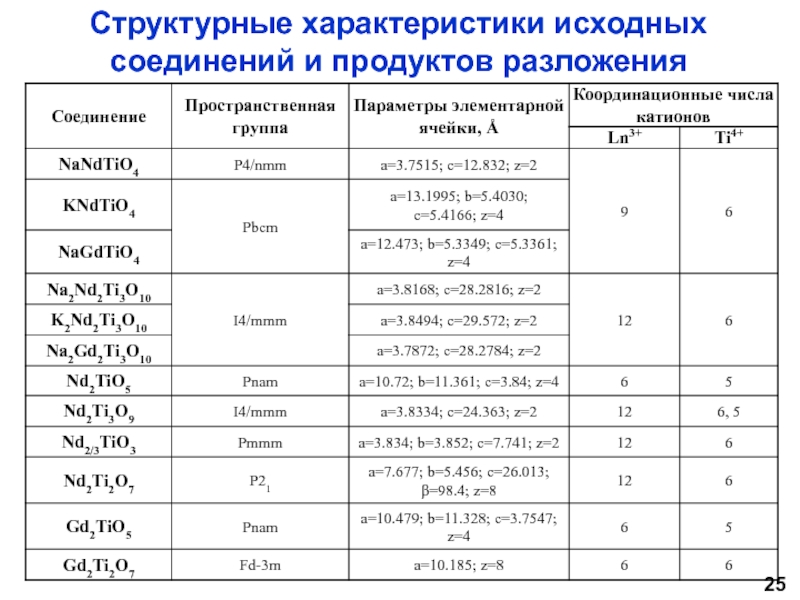
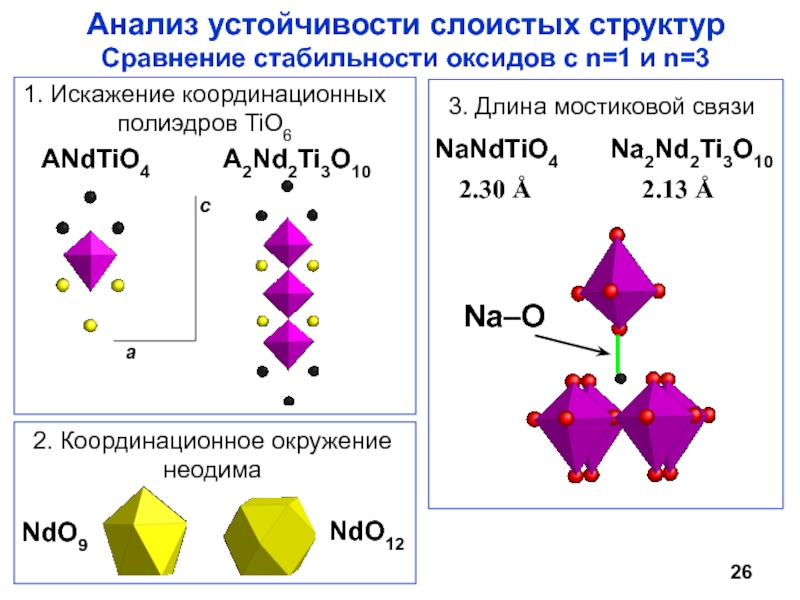
Научный руководитель: д.х.н., проф. И.А. Зверева
Официальные оппоненты: д.х.н., проф. М.Д. Бальмаков
к.х.н., доцент И.А. Успенская
Ведущая организация: Санкт-Петербургский государственный
технологический институт (Технический университет)
Санкт-Петербургский государственный университет
Химический факультет
Кафедра химической термодинамики и кинетики
Санкович Анна Михайловна
Специальности: 02.00.04 – физическая химия, 02.00.21 – химия твердого тела
Санкт-Петербург, 2012