- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 6. Химические основы инновационных технологий презентация
Содержание
- 1. Лекция 6. Химические основы инновационных технологий
- 2. Электролиз - совокупность процессов, происходящих
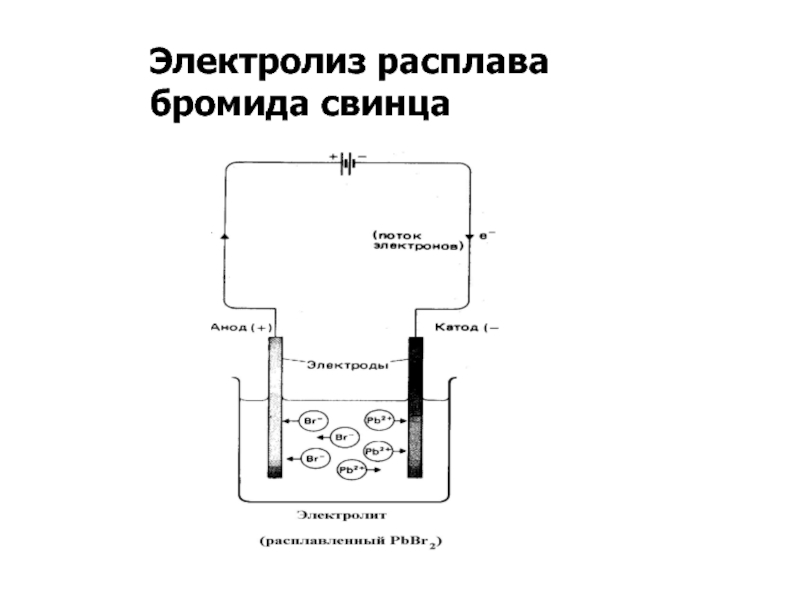
- 3. Электролиз расплава бромида свинца
- 4. Процессы на электродах электролизера Анод
- 5. Особенности электролиза водных растворов 1. Имеется несколько
- 6. Последовательность реакции на электродах различных
- 7. 1. Инертные и
- 8. 2. Окислительно-восстановительный потенциал реакции (на инертном электроде)
- 9. Решение Принципиально возможно восстановление
- 10. Б) На аноде сначала окисляются частицы, реакции
- 11. В нашем примере принципиально возможно окисление на
- 12. Перенапряжение - добавочная по отношению к
- 13. Законы Фарадея (1827) 1. Масса выделившегося
- 14. Постоянная Фарадея F = 96500
- 15. Пример Через расплавленный бромид свинца
- 16. Решение Катод (-): восстановление Pb2+ +
- 17. Задача Сколько времени нужно пропускать ток
- 18. Решение Анод (-): окисление 2Сl- -
- 19. Темы коротких сообщений Современные ингибиторы
- 20. Благодарю за внимание!
Слайд 1
Лекция 6. Химические основы инновационных технологий
Давыдов Виктор Николаевич
проф. каф. экологического менеджмента
ИНЖЭКОН
Слайд 2
Электролиз
- совокупность процессов, происходящих при прохождении постоянного электрического тока через электрохимическую
систему, состоящую из двух электродов и расплава или раствора электролита.
Слайд 4
Процессы на электродах электролизера
Анод (+): окисление 2Br- - 2ē → Br2
Катод (-): восстановление Pb2+ + 2ē → Pb
Слайд 5Особенности электролиза водных растворов
1. Имеется несколько типов частиц, которые могут окисляться
на аноде и восстанавливаться на катоде.
Пример:
Водный раствор хлорида натрия содержит анионы: Cl-, катионы: Na+, а также молекулы воды.
Какие частицы будут окисляться на аноде и восстанавливаться на катоде?
Пример:
Водный раствор хлорида натрия содержит анионы: Cl-, катионы: Na+, а также молекулы воды.
Какие частицы будут окисляться на аноде и восстанавливаться на катоде?
Слайд 6 Последовательность реакции на электродах различных ионов определяется: 1. Химической природой электродов 2.
Окислительно-восстановитель-ным (электродным) потенциалом реакции
Слайд 7
1. Инертные и активные электроды
Инертные электроды: Pt, графит в реакциях на
электродах не участвуют.
Активные электроды: Cu, Fe, Zn, Ni… принимают активное участие в реакциях.
Например, в нашем случае:
Анод (окисление): Сu - 2e = Cu2+
φо= +0,34 В
Активные электроды: Cu, Fe, Zn, Ni… принимают активное участие в реакциях.
Например, в нашем случае:
Анод (окисление): Сu - 2e = Cu2+
φо= +0,34 В
Слайд 82. Окислительно-восстановительный потенциал реакции (на инертном электроде)
А) На катоде сначала восстанавливаются
частицы, реакции которых соответствует больший окислительно-восстановительный (электродный) потенциал;
Слайд 9Решение Принципиально возможно восстановление на катоде следующих частиц: 1. Na+ + ē →
Na φо1= -2,7 В
2. 2H2O + 2ē → H2+2OH- φо2= -0,83 В
Самый большой окислительно-восстановительный потенциал имеет 2 реакция. Поэтому на катоде будет восстанавливаться вода (реакция 2).
Слайд 10Б) На аноде сначала окисляются частицы, реакции которых соответствует меньший окислительно-восстановительный
потенциал.
Сначала восстанавливаются бескислородные анионы, затем вода, затем кислородсодержашие анионы.
Слайд 11В нашем примере принципиально возможно окисление на аноде следующих частиц:
1. 2H2О
- 4ē → 4H+ + О2 φо1= +1,23 В
2. 2Cl- - 2ē → Cl2 φо2= +1,36 В φо1< φо2 Следовательно на аноде должна окисляться вода, однако на большинстве электродов окисляются хлорид-ионы.
Это связано с явлением, которое называется перенапряжение.
2. 2Cl- - 2ē → Cl2 φо2= +1,36 В φо1< φо2 Следовательно на аноде должна окисляться вода, однако на большинстве электродов окисляются хлорид-ионы.
Это связано с явлением, которое называется перенапряжение.
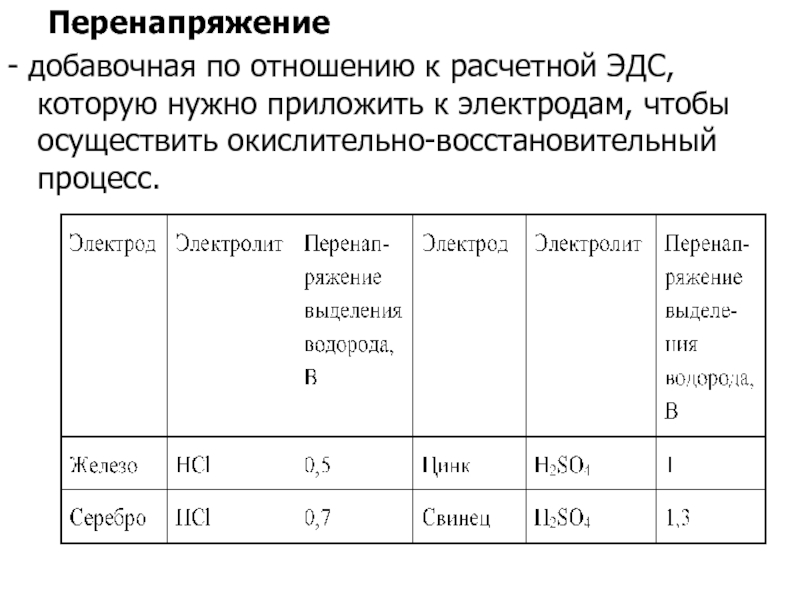
Слайд 12 Перенапряжение
- добавочная по отношению к расчетной ЭДС, которую нужно приложить
к электродам, чтобы осуществить окислительно-восстановительный процесс.
Слайд 13
Законы Фарадея (1827)
1. Масса выделившегося на электроде вещества пропорциональна количеству электричества,
прошедшего через электролит.
2. Одинаковые количества электричества выделяют на электродах массы веществ, пропорциональные молярным массам их химических эквивалентов.
2. Одинаковые количества электричества выделяют на электродах массы веществ, пропорциональные молярным массам их химических эквивалентов.
Слайд 14
Постоянная Фарадея
F = 96500 Кл/моль экв.
n экв(B) = Q/F= It/F
Q-
количество электричества, Кл
I - ток, А
t - время, с
m(B) = Mэкв n экв(B) = MэквIt/F
I - ток, А
t - время, с
m(B) = Mэкв n экв(B) = MэквIt/F
Слайд 15
Пример
Через расплавленный бромид свинца пропускали ток силой 2А в течение
30 минут.
Какая масса свинца выделилась?
Какая масса свинца выделилась?
Слайд 16
Решение
Катод (-): восстановление Pb2+ + 2ē → Pb
Из уравнения: n(Pb)/n(ē)
= ½
n(ē) = Q/F = It/F =
=2A·1800c/96500Kл/моль ē = 0,037 моль
n(Pb) = ½ ·0,037 моль= 0,0185 моль
m(Pb) = 0,0185 моль·207 г/моль = 3,83 г
Ответ: выделилось 3,83 г свинца
n(ē) = Q/F = It/F =
=2A·1800c/96500Kл/моль ē = 0,037 моль
n(Pb) = ½ ·0,037 моль= 0,0185 моль
m(Pb) = 0,0185 моль·207 г/моль = 3,83 г
Ответ: выделилось 3,83 г свинца
Слайд 17
Задача
Сколько времени нужно пропускать ток 10 А через раствор поваренной соли,
чтобы получить 44,8 л хлора (н.у.)?
Слайд 18
Решение
Анод (-): окисление 2Сl- - 2ē → Cl2
n(Cl2) = 44,8
л /22,4 л/моль = 2 моль
Из уравнения:
n(Cl2)/n(ē) = ½n(ē) n(ē) = 2 n(Cl2) = 4 моль
n(ē) = Q/F = It/F =
=10A·t c/96500Kл/моль ē = 4 моль
t c = 38600 c
Ответ: Ток следует пропускать 38600 c
Из уравнения:
n(Cl2)/n(ē) = ½n(ē) n(ē) = 2 n(Cl2) = 4 моль
n(ē) = Q/F = It/F =
=10A·t c/96500Kл/моль ē = 4 моль
t c = 38600 c
Ответ: Ток следует пропускать 38600 c
Слайд 19
Темы коротких сообщений
Современные ингибиторы коррозии: история создания, химический состав, области
применения.
Протекторная защита и электрозащита металлов от коррозии: принцип действия, области применения.
Гальванопластика: история, принцип действия, области применения.
Использование электролиза для создания газовых смесей для дыхания под водой: электроланг А.Н. Лодыгина, системы жизнеобеспечения современных подводных лодок.
Протекторная защита и электрозащита металлов от коррозии: принцип действия, области применения.
Гальванопластика: история, принцип действия, области применения.
Использование электролиза для создания газовых смесей для дыхания под водой: электроланг А.Н. Лодыгина, системы жизнеобеспечения современных подводных лодок.