- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислородные соединения азота.Оксиды азота. презентация
Содержание
- 1. Кислородные соединения азота.Оксиды азота.
- 2. Что относится к кислородным соединениям? Оксиды
- 3. Оксиды азота Степени окисления азота +1
- 5. Оксид азота (I) оксид диазота
- 6. Физические свойства При нормальной температуре это бесцветный
- 7. Характер Относится к несолеобразующим оксидам, с
- 8. Применение Средство для ингаляционного наркоза Малые концентрации
- 9. Оксид азота (II) монооксид азота окись
- 10. Физические свойства При нормальных условиях бесцветный газ,
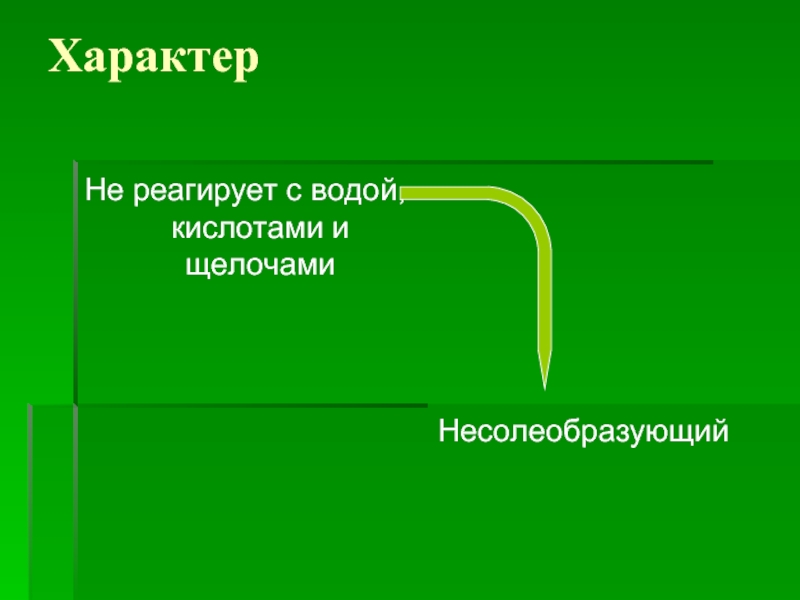
- 11. Характер Не реагирует с водой, кислотами и щелочами Несолеобразующий
- 12. Применение Получение NO является одной из стадий получения азотной кислоты.
- 13. Оксид азота(III) азотистый ангидрид N2O3 Группа 3 Сидров И. Федотов Н.
- 14. Физические свойства Жидкость синего цвета (при н. у.),
- 15. Характер При взаимодействии с водой даёт азотистую кислоту,
- 16. Применение Применяется в лаборатории для получения азотистой кислоты и её солей.
- 17. Оксид азота (IV) диоксид азота, бурый газ
- 18. Физические свойства газ, красно-бурого цвета, с
- 19. Характер Реагирует с водой, кислотами и щелочами Солеобразующий, кислотный
- 20. Применение В производстве серной и азотной кислот, в качестве окислителя в жидком ракетном топливе и смесевых взрывчатых веществах.
- 21. «Лисий хвост» «Лисий хвост» — жаргонное название выбросов
- 22. Оксид азота(V) пентаоксид диазота, нитрат нитроила, азотный ангидрид N2O5
- 23. Физические свойства Бесцветные, очень летучие кристаллы. Крайне неустойчив.
- 24. Характер Солеобразующий кислотный оксид. Соответствует азотная кислота HNO3
- 25. Применение Применяется в лаборатории для получения азотной кислоты и её солей.
- 26. Спасибо за работу!
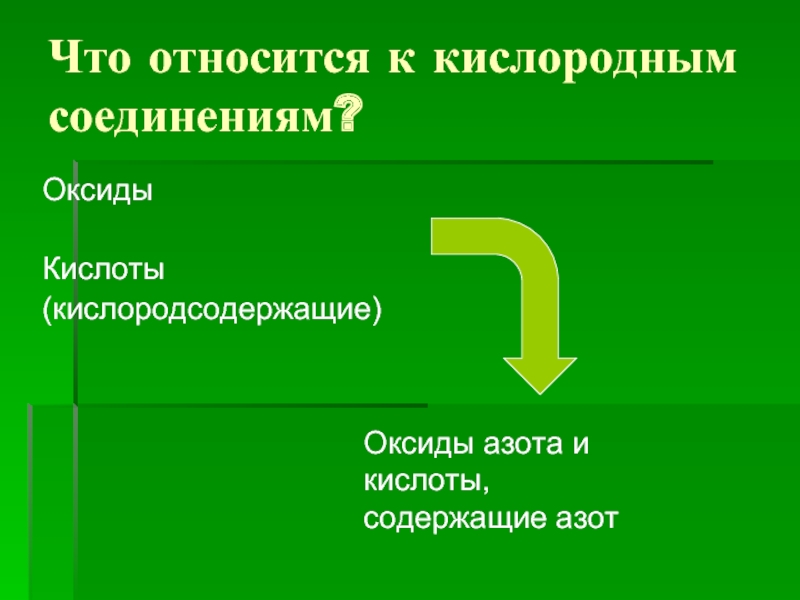
Слайд 2Что относится к кислородным соединениям?
Оксиды
Кислоты
(кислородсодержащие)
Оксиды азота и кислоты, содержащие азот
Слайд 5Оксид азота (I)
оксид диазота
закись азота
веселящий газ
N+12O-2
Группа 1
Школьникова Д.
Осипов В.
Слайд 6Физические свойства
При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом.
Растворим в воде
Из
1 кг жидкой закиси азота образуется 500 л газа.
Не воспламеняется, но поддерживает горение.
Не воспламеняется, но поддерживает горение.
Слайд 7Характер
Относится к несолеобразующим оксидам, с водой, с растворами щелочей и
кислот не взаимодействует.
Слайд 8Применение
Средство для ингаляционного наркоза
Малые концентрации закиси азота вызывают чувство опьянения (отсюда
название — «веселящий газ») и лёгкую сонливость. При вдыхании чистого газа быстро развиваются состояние наркотического опьянения, а затем асфиксия. В смеси с кислородом при правильном дозировании вызывает наркоз без предварительного возбуждения и побочных явлений.
В двигателях внутреннего сгорания
В пищевой промышленности
соединение зарегистрировано в качестве пищевой добавки E942, как пропеллент и упаковочный газ.
В двигателях внутреннего сгорания
В пищевой промышленности
соединение зарегистрировано в качестве пищевой добавки E942, как пропеллент и упаковочный газ.
Слайд 10Физические свойства
При нормальных условиях бесцветный газ,
плохо растворимый в воде,
сжижается с
трудом,
в жидком и твёрдом виде имеет голубой цвет.
в жидком и твёрдом виде имеет голубой цвет.
Слайд 14Физические свойства
Жидкость синего цвета (при н. у.), в твёрдом виде — синеватого цвета.
Устойчив только при температурах ниже −4 °C.
Без примесей NO2 и NO существует только в твёрдом виде.
Высоко токсичен. Вызывает тяжёлые ожоги кожи.
Слайд 15Характер
При взаимодействии с водой даёт азотистую кислоту,
При взаимодействии с растворами щелочей образуются соответствующие нитриты,
Солеобразующий кислотный
оксид.
Слайд 18Физические свойства
газ,
красно-бурого цвета,
с характерным острым запахом
высокотоксичен. Даже в небольших концентрациях
он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких.
Слайд 20Применение
В производстве серной и азотной кислот,
в качестве окислителя в жидком ракетном топливе и смесевых взрывчатых
веществах.
Слайд 21«Лисий хвост»
«Лисий хвост» — жаргонное название выбросов в атмосферу оксидов азота на
химических предприятиях (иногда — из выхлопных труб автомобилей). Название происходит от оранжево-бурого цвета диоксида азота.
«Лисий хвост» на
Нижнетагильском
металлургическом комбинате