- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
КИСЛОРОД презентация
Содержание
- 1. КИСЛОРОД
- 2. ОТКРЫТИЕ КИСЛОРОДА
- 3. Антуан Лоран
- 4. Кислород – самый распространенный элемент на
- 5. Физические свойства Агрегатное состояние - газ при
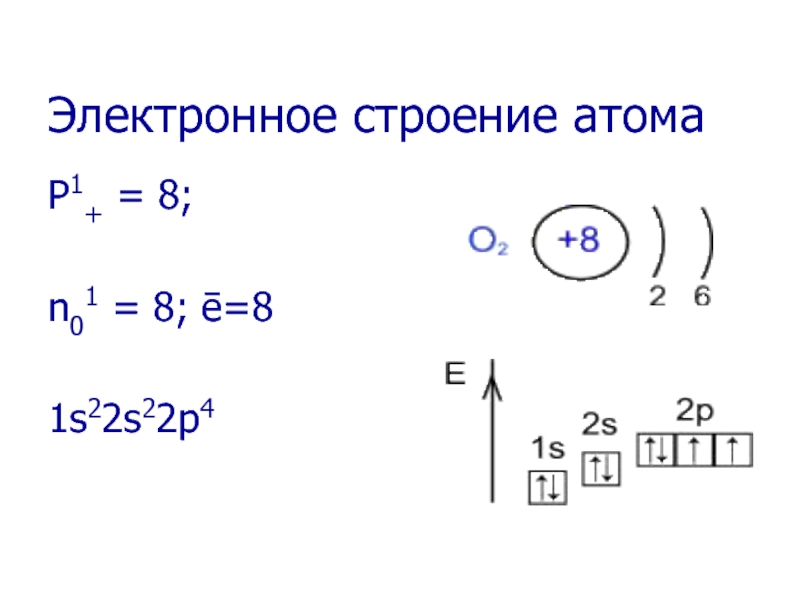
- 6. Электронное строение атома P1+ = 8; n01 = 8; ē=8 1s22s22p4
- 7. Химические свойства Кислород — очень
- 8. Реакции с металлами В результате
- 9. Реакции с неметаллами Образуется оксид неметалла.
- 10. Другие примеры реакций с неметаллами Горение серы
- 11. Реакции с некоторыми сложными веществами
- 12. Химическое взаимодействие вещества с кислородом
- 13. Получение кислорода (лабораторные способы) разложение воды электрическим
- 14. Получение кислорода (промышленный способ) В
- 15. Применение кислорода в строительстве и машиностроении
- 16. Применение кислорода в медицине
- 17. Применение кислорода в химической промышленности -
- 18. Применение кислорода в военной технике
- 19. ОЗОН Аллотропная модификация кислорода Озон О3 -
- 20. Озон - очень сильный окислитель, поэтому
- 21. Спасибо за внимание! Автор – Сарайская Марина
Слайд 2ОТКРЫТИЕ КИСЛОРОДА
К. Шееле
Дж. Пристли
Эти два великих химика независимо друг от друга во второй половине XVIII века открыли кислород.
Эти два великих химика независимо друг от друга во второй половине XVIII века открыли кислород.
Слайд 3
Антуан Лоран ЛАВУАЗЬЕ
(1743-1794)
Исследовал кислород и создал кислородную теорию горения, пришедшую на смену флогистонной теории.
Слайд 4Кислород –
самый распространенный элемент на Земле
В
воздухе 21% (по объему),
в земной коре 49% (по массе),
в гидросфере 89% (по массе),
в живых организмах до 65% массы.
в земной коре 49% (по массе),
в гидросфере 89% (по массе),
в живых организмах до 65% массы.
Слайд 5Физические свойства
Агрегатное состояние - газ при обычных условиях. При очень низких
температурах (-183°С) переходит в жидкое агрегатное состояние (голубая жидкость), а при еще более низких температурах (-219°С) становится твёрдым (синие снежные кристаллы).
Цвет – бесцветный.
Запах - без запаха.
Растворимость в воде - плохо растворяется.
Тяжелее воздуха ( М воздуха = 29 г/моль, а МО2 = 32 г/моль.
Цвет – бесцветный.
Запах - без запаха.
Растворимость в воде - плохо растворяется.
Тяжелее воздуха ( М воздуха = 29 г/моль, а МО2 = 32 г/моль.
Слайд 7Химические свойства
Кислород — очень сильный окислитель! Он окисляет многие
вещества уже при комнатной температуре (медленное окисление) и тем более при нагревании или при горении вещества (быстрое окисление).
В реакциях со всеми элементами (кроме фтора) кислород всегда ОКИСЛИТЕЛЬ.
В реакциях со всеми элементами (кроме фтора) кислород всегда ОКИСЛИТЕЛЬ.
Слайд 8Реакции с металлами
В результате реакции образуется оксид этого металла.
Например, алюминий окисляется кислородом согласно уравнению:
t° 4Al + 3O2 → 2Al2O3
Другой пример. При опускании раскалённой железной проволоки в склянку с кислородом, проволока сгорает, разбрызгивая в стороны снопы искр - раскалённых частичек железной окалины Fe3O4:
t° 3Fe + 2O2 → Fe3O4
t° 4Al + 3O2 → 2Al2O3
Другой пример. При опускании раскалённой железной проволоки в склянку с кислородом, проволока сгорает, разбрызгивая в стороны снопы искр - раскалённых частичек железной окалины Fe3O4:
t° 3Fe + 2O2 → Fe3O4
Слайд 9Реакции с неметаллами
Образуется оксид неметалла.
Горение фосфора с образованием оксида
фосфора (V):
t° 4Р + 5О2 → 2Р2О5
t° 4Р + 5О2 → 2Р2О5
Слайд 10Другие примеры реакций с неметаллами
Горение серы в кислороде с образованием сернистого
газа SO2:
t° S + O2 → SO2
Горение угля в кислороде с образованием углекислого газа:
t° С + О2 → СО2
t° S + O2 → SO2
Горение угля в кислороде с образованием углекислого газа:
t° С + О2 → СО2
Слайд 11Реакции с некоторыми сложными веществами
В этом случае образуются оксиды
элементов, из которых состоит молекула сложного вещества.
Например, при обжиге сульфида меди (II)
t° 2CuS + 3O2 → 2CuO + 2SO2
образуются два оксида — оксид меди (II) и оксид серы (IV).
При обжиге сульфидов образуется всегда оксид серы, валентность серы в котором равна IV.
Другой пример — горение метана СН4. Так как эта молекула состоит из атомов элементов углерода С и водорода Н, значит, образуется два оксида — оксид углерода (IV) СО2 и оксид водорода, то есть вода - Н2О:
t° СН4 + 2О2 → СО2 + 2Н2О
Например, при обжиге сульфида меди (II)
t° 2CuS + 3O2 → 2CuO + 2SO2
образуются два оксида — оксид меди (II) и оксид серы (IV).
При обжиге сульфидов образуется всегда оксид серы, валентность серы в котором равна IV.
Другой пример — горение метана СН4. Так как эта молекула состоит из атомов элементов углерода С и водорода Н, значит, образуется два оксида — оксид углерода (IV) СО2 и оксид водорода, то есть вода - Н2О:
t° СН4 + 2О2 → СО2 + 2Н2О
Слайд 12
Химическое взаимодействие вещества с кислородом называется реакцией окисления.
Реакции окисления, сопровождающиеся выделением
теплоты и света, называются реакциями горения.
Реакции горения веществ — это примеры быстрого окисления, а вот гниение, ржавление и т.п. — это примеры медленного окисления веществ кислородом
Реакции горения веществ — это примеры быстрого окисления, а вот гниение, ржавление и т.п. — это примеры медленного окисления веществ кислородом
Слайд 13Получение кислорода
(лабораторные способы)
разложение воды электрическим током
разложение пероксида водорода Н2О2 под
действием катализатора MnO2
разложение перманганата калия KMnO4 при нагревании.
разложение перманганата калия KMnO4 при нагревании.
Слайд 14Получение кислорода
(промышленный способ)
В промышленности для получения чистого кислорода используют
перегонку жидкого воздуха, основанную на разных температурах кипения компонентов воздуха. Воздух охлаждают примерно до -200°С и затем медленно нагревают. При достижении температуры -183°С из жидкого воздуха улетучивается кислород, остальные компоненты сжиженного воздуха при этой температуре остаются в жидком агрегатном состоянии.
Слайд 15Применение кислорода
в строительстве и машиностроении
- для кислородно - ацетиленовой газосварки
и газорезки металлов
- для напыления и наплавки металлов
в нефтедобыче
- при закачке в пласт для повышения энергии вытеснения
в металлургии и горнодобывающей промышленности
- при конвективном производстве стали, кислородном дутье в доменных печах, извлечение золота и руд, производстве ферросплавов, выплавке никеля, цинка свинца, циркония и др. цветных металлов
- при прямом восстановлении железа
- при огневой зачистке в литейном производстве
- при огневом бурении твердых пород
- для напыления и наплавки металлов
в нефтедобыче
- при закачке в пласт для повышения энергии вытеснения
в металлургии и горнодобывающей промышленности
- при конвективном производстве стали, кислородном дутье в доменных печах, извлечение золота и руд, производстве ферросплавов, выплавке никеля, цинка свинца, циркония и др. цветных металлов
- при прямом восстановлении железа
- при огневой зачистке в литейном производстве
- при огневом бурении твердых пород
Слайд 16Применение кислорода
в медицине
- в оксибарокамерах
- при
заправке кислородных масок, подушек и т.д.
- в палатах со специальным микроклиматом
- для изготовления кислородных коктейлей
- при выращивании микроорганизмов
в экологии
- при очистке питьевой воды
- при вторичной переработке металлов
- при продувке сточных вод кислородом
- при обезвреживании химически активных отходов в очистных установках в мусоросжигательных печах
- в палатах со специальным микроклиматом
- для изготовления кислородных коктейлей
- при выращивании микроорганизмов
в экологии
- при очистке питьевой воды
- при вторичной переработке металлов
- при продувке сточных вод кислородом
- при обезвреживании химически активных отходов в очистных установках в мусоросжигательных печах
Слайд 17Применение кислорода
в химической промышленности
- при производстве ацетилена, целлюлозы, метилового спирта,
аммиака, азотной и серной кислоты
- при каталитической конверсии природного газа (при производстве синтетического аммиака)
- при высокотемпературной конверсии метана
в энергетике
- при газификации твердого топлива
- для обогащения воздуха для бытовых и промышленных котлов
- для сжатия водно-угольной смеси
- при каталитической конверсии природного газа (при производстве синтетического аммиака)
- при высокотемпературной конверсии метана
в энергетике
- при газификации твердого топлива
- для обогащения воздуха для бытовых и промышленных котлов
- для сжатия водно-угольной смеси
Слайд 18Применение кислорода
в военной технике
- в барокамерах
- для работы дизельных
двигателей под водой
- в качестве окислителя топлива для ракетных двигателей
в сельском хозяйстве
- для обогащения кислородом водной среды в рыболовстве
- при изготовлении кислородных коктейлей
- для прибавки животных в весе
- в качестве окислителя топлива для ракетных двигателей
в сельском хозяйстве
- для обогащения кислородом водной среды в рыболовстве
- при изготовлении кислородных коктейлей
- для прибавки животных в весе
Слайд 19ОЗОН
Аллотропная модификация кислорода
Озон О3 - газ голубого цвета с резким запахом.
Каждый, кто обратил внимание на то, как пахнет воздух после грозы или вблизи источника электрического разряда, знает запах этого газа очень хорошо.
В природе озон образуется под действием ультрафиолетового излучения Солнца, а также получается при электрических разрядах в атмосфере:
В природе озон образуется под действием ультрафиолетового излучения Солнца, а также получается при электрических разрядах в атмосфере:
Слайд 20
Озон - очень сильный окислитель, поэтому его используют при обеззараживании питьевой
воды. При контакте с большинством способных окисляться веществ происходит взрыв.
Озон образуется в атмосфере Земли на высоте 25 км под действием солнечной радиации, он поглощает опасное излучение Солнца.
Однако в озоновом "зонтике" Земли, толщиной всего около 30 метров, то и дело возникают "дыры". В воздух попадает все больше "вредных" для озона газов, вроде монооксида азота NO или тех веществ, которые используются для наполнения холодильных установок и аэрозольных баллончиков. Даже частичное исчезновение озонового слоя над Землей грозит всему живому гибелью...
Озон образуется в атмосфере Земли на высоте 25 км под действием солнечной радиации, он поглощает опасное излучение Солнца.
Однако в озоновом "зонтике" Земли, толщиной всего около 30 метров, то и дело возникают "дыры". В воздух попадает все больше "вредных" для озона газов, вроде монооксида азота NO или тех веществ, которые используются для наполнения холодильных установок и аэрозольных баллончиков. Даже частичное исчезновение озонового слоя над Землей грозит всему живому гибелью...