- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
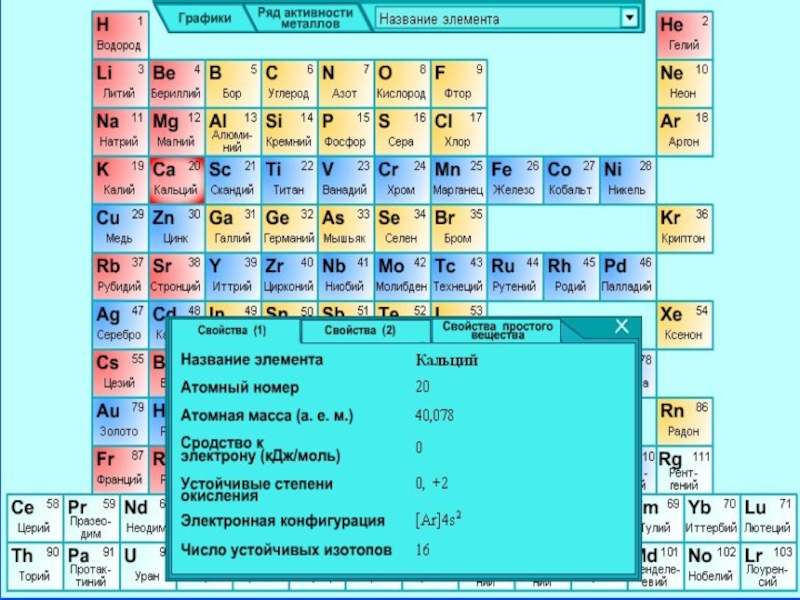
Кальций презентация
Содержание
- 1. Кальций
- 2. Вспомните: Что такое металл? Где в периодической
- 3. В латинском языке слово «calx» обозначает известь
- 5. Вильгельм Бунзен Немецкий химик. Разработал ряд
- 6. Нахождение в природе Кальций относится к
- 7. Физические свойства Ca: Кальций – серебристо
- 8. Соединения кальция Оксид Негашёная известь
- 9. Оксид кальция Оксид кальция CaO - «негашеная
- 10. Гидроксид кальция Гидроксид кальция Ca(OH)2 - «гашеная
- 11. Гидроксид кальция – известковая вода, известковое молоко
- 12. Гипс Минерал из класса сульфатов, по составу
- 13. Мел Белая горная порода, мягкая и рассыпчатая. Мел не растворяется в воде.
- 14. Соли кальция Соли кальция, как хлорид CaCl2,
- 15. Жёсткость воды Жёсткость воды — совокупность химических и
- 16. Жёсткая вода при умывании сушит кожу, в
- 17. Потребление жёсткой или мягкой воды обычно не
- 18. Методы устранения: ОБРАТНЫЙ ОСМОС; ЭЛЕКТРОДИАЛИЗ; ТЕРМИЧЕСКИЙ СПОСОБ; РЕАГЕНТНОЕ УМЯГЧЕНИЕ; КАТИОНИРОВАНИЕ.
- 19. Применение кальция использование его как восстановителя при
- 20. Кальций, а также его сплавы с алюминием
- 21. Соединения кальция широко применяются в качестве антигистаминного
- 22. Ответьте на вопросы: Какими физическими свойствами обладает
- 23. Домашнее задание: Выучить конспект в тетради; Написать сообщение на тему: «Способы применения кальция.»
Слайд 2Вспомните:
Что такое металл?
Где в периодической системе находятся металлы?
Что такое коррозия?
Какие щелочные
Сравните строение и физические особенности атомов калия и кальция.
Слайд 3 В латинском языке слово «calx» обозначает известь и сравнительно мягкие, легко
Слайд 5Вильгельм Бунзен
Немецкий химик. Разработал ряд методов исследования химических веществ. Получил посредством
1811-1899 гг.
Слайд 6Нахождение в природе
Кальций относится к распространенным элементам. общее содержание его
Слайд 7Физические свойства Ca:
Кальций – серебристо белый и довольно твердый металл,
Слайд 8Соединения
кальция
Оксид
Негашёная
известь
СаО
Гидроксид
Гашёная известь,
известковая вода,
известковое молоко
Са(ОН)2
Соли
Сульфат кальция
СаSО4 – гипс,
алебастр
Карбонат
мел, мрамор,
известняк
СаСО3
Слайд 9Оксид кальция
Оксид кальция CaO - «негашеная известь»
Получение:CaCO3 =CaO+CO2 (обжиг)
Химические свойства:CaO –
CaO+H2O=Ca(OH)2 – гашеная известь
CaO+SiO2 =CaSiO3
CaO+CO2 =CaCO3
CaO+2HCl = CaCl2+H2O
CaO+3C=CaC2 +CO (нагревание)
Слайд 10Гидроксид кальция
Гидроксид кальция Ca(OH)2 - «гашеная известь».
Получение: CaO+H2O=Ca(OH)2
Физические свойства: твердое вещество
Слайд 12Гипс
Минерал из класса сульфатов, по составу CaSO4•2H2O. Волокнистая разновидность гипса называется
Слайд 14Соли кальция
Соли кальция, как хлорид CaCl2, бромид CaBr2, иодид CaI2 и
Слайд 15Жёсткость воды
Жёсткость воды — совокупность химических и физических свойств воды, связанных с
Слой накипи, образовавшийся внутри трубы теплообменника
Слайд 16 Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена
Жёсткость воды
Накипь под сканирующим электронным микроскопом, поле зрения 64 x 90 мкм
Слайд 17 Потребление жёсткой или мягкой воды обычно не является опасным для здоровья,
Жёсткость воды
Слайд 18Методы устранения:
ОБРАТНЫЙ ОСМОС;
ЭЛЕКТРОДИАЛИЗ;
ТЕРМИЧЕСКИЙ СПОСОБ;
РЕАГЕНТНОЕ УМЯГЧЕНИЕ;
КАТИОНИРОВАНИЕ.
Слайд 19Применение кальция
использование его как восстановителя при получении металлов, особенно никеля, меди
сплавы кальция со свинцом находят применение в аккумуляторных батареях и подшипниковых сплавах;
чистый металлический кальций широко применяется в металлотермии при получении редких металлов
Слайд 20Кальций, а также его сплавы с алюминием и магнием используются в
Оксид кальция, как в свободном виде, так и в составе керамических смесей, применяется в производстве огнеупорных материалов.
Применение кальция
Слайд 21Соединения кальция широко применяются в качестве антигистаминного средства.
Кроме того, соединения кальция
Применение кальция
Слайд 22Ответьте на вопросы:
Какими физическими свойствами обладает кальций?
Кто был первооткрывателем кальция?
С какими
Какие способы применения кальция вы знаете?