- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
История о том, как заставили работать химическую реакцию презентация
Содержание
- 1. История о том, как заставили работать химическую реакцию
- 2. Введение Свойство металлов отдавать электроны в окислительно-восстановительных
- 3. Электрод сравнения Электрод сравнения – водородный электрод,
- 4. Соберём гальванический элемент из водородного электрода
- 5. H+ Соберём гальванический элемент из
- 6. Вопросы Как по-другому называют ряд стандартных потенциалов?
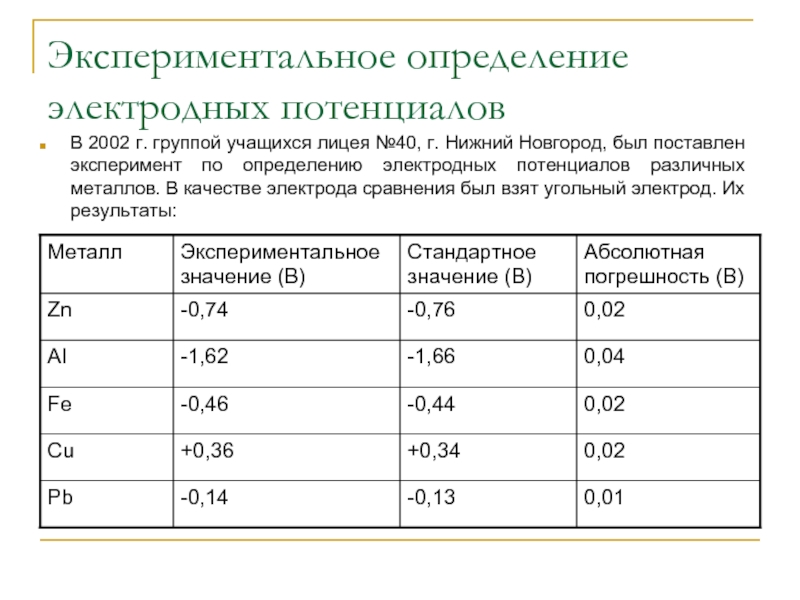
- 7. Экспериментальное определение электродных потенциалов В 2002 г.
Слайд 1История о том, как заставили работать химическую реакцию
Часть III. Стандартные электродные
Слайд 2Введение
Свойство металлов отдавать электроны в окислительно-восстановительных реакциях количественно характеризуется значениями их
Электродные потенциалы
металлов измеряют, создавая гальванический элемент из определённого металла и электрода сравнения.
Как измеряют электродные потенциалы?
Стандартный электродный потенциал равен ЭДС гальванического элемента, составленного из металла и стандартного водородного электрода.
Что такое стандартный электродный потенциал?
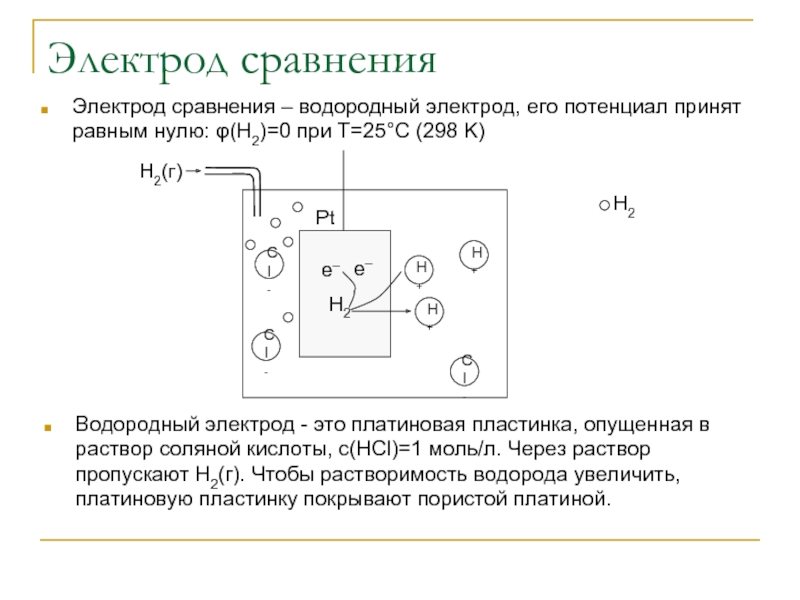
Слайд 3Электрод сравнения
Электрод сравнения – водородный электрод, его потенциал принят равным нулю:
Водородный электрод - это платиновая пластинка, опущенная в раствор соляной кислоты, с(HCl)=1 моль/л. Через раствор пропускают Н2(г). Чтобы растворимость водорода увеличить, платиновую пластинку покрывают пористой платиной.
H+
H+
H+
Cl-
Cl-
Cl-
Pt
H2(г)
H2
e–
e–
H2
Слайд 4
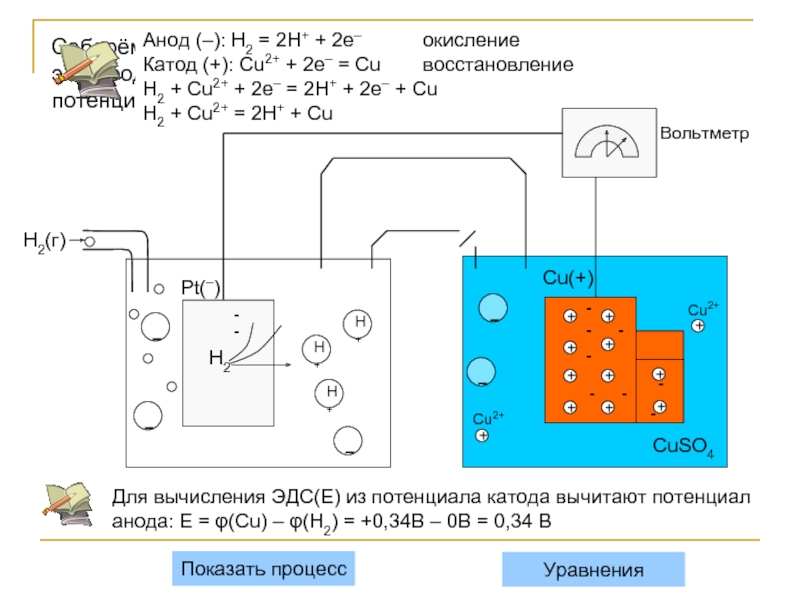
Соберём гальванический элемент из водородного электрода (слева) и медного электрода (справа),
H+
–
Pt(–)
H2(г)
CuSO4
+
+
+
+
+
+
+
+
+
+
+
-
-
-
-
-
-
Cu2+
Cu2+
–
–
Показать процесс
H+
H+
Анод (–): H2 = 2H+ + 2e– окисление
Катод (+): Cu2+ + 2e– = Cu восстановление
H2 + Cu2+ + 2e– = 2H+ + 2e– + Cu
H2 + Cu2+ = 2H+ + Cu
Уравнения
Для вычисления ЭДС(Ε) из потенциала катода вычитают потенциал анода: Ε = φ(Cu) – φ(H2) = +0,34В – 0В = 0,34 В
Вольтметр
H2
-
–
–
+
-
-
-
Cu(+)
Слайд 5 H+
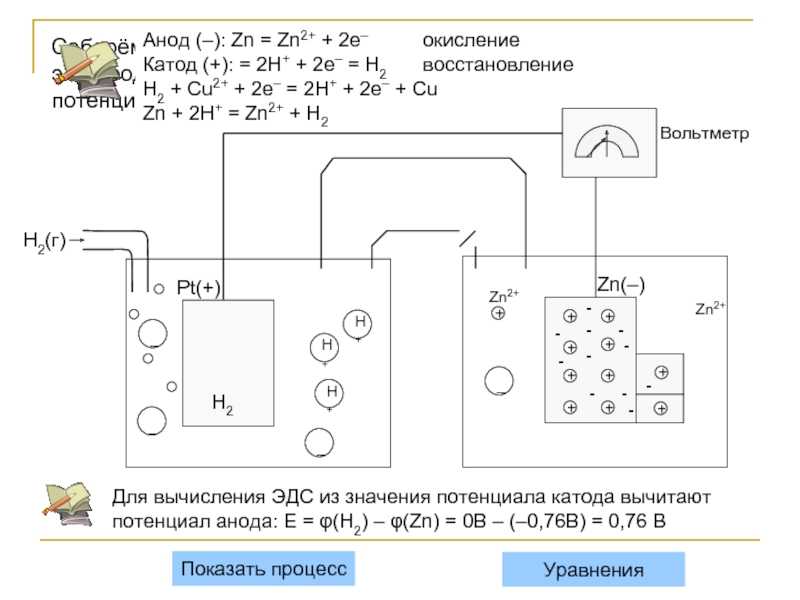
Соберём гальванический элемент из водородного электрода (слева) и цинкового
H+
–
Pt(+)
H2(г)
+
+
+
+
+
+
+
+
+
+
-
-
-
-
-
-
-
-
Zn2+
Zn2+
Показать процесс
H+
Анод (–): Zn = Zn2+ + 2e– окисление
Катод (+): = 2H+ + 2e– = H2 восстановление
H2 + Cu2+ + 2e– = 2H+ + 2e– + Cu
Zn + 2H+ = Zn2+ + H2
-
Уравнения
Для вычисления ЭДС из значения потенциала катода вычитают потенциал анода: Ε = φ(H2) – φ(Zn) = 0В – (–0,76В) = 0,76 В
Вольтметр
Zn(–)
-
H2
–
–
–
-
+
Слайд 6Вопросы
Как по-другому называют ряд стандартных потенциалов?
Какие свойства отражены в этом ряду:
металлов
ионов
Ключевые слова:
Стандартный водородный электрод, стандартный электродный потенциал, гальванический элемент, ряд стандартных электродных потенциалов.
Восстановительные свойства
Окислительные свойства
Электрохимический ряд напряжений металлов