- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Хлор презентация
Содержание
- 1. Хлор
- 2. История открытия Хлор был получен шведским химиком
- 3. Положение в Периодической системе и строение атома
- 4. Нахождение в природе Хлор – активный неметалл
- 5. Получение хлора Все способы получения хлора сводятся
- 6. В лаборатории 4 2
- 7. Физические свойства Газ желто-зеленого цвета, почти в
- 8. Химические свойства Хлор взаимодействует с простыми
- 9. Fe + Cl2 =
- 10. Химические свойства Взаимодействует со сложными веществами
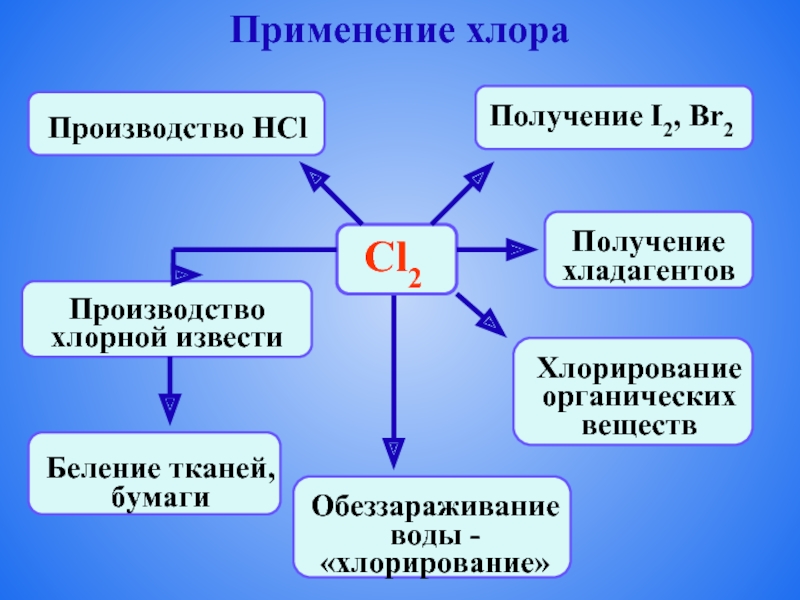
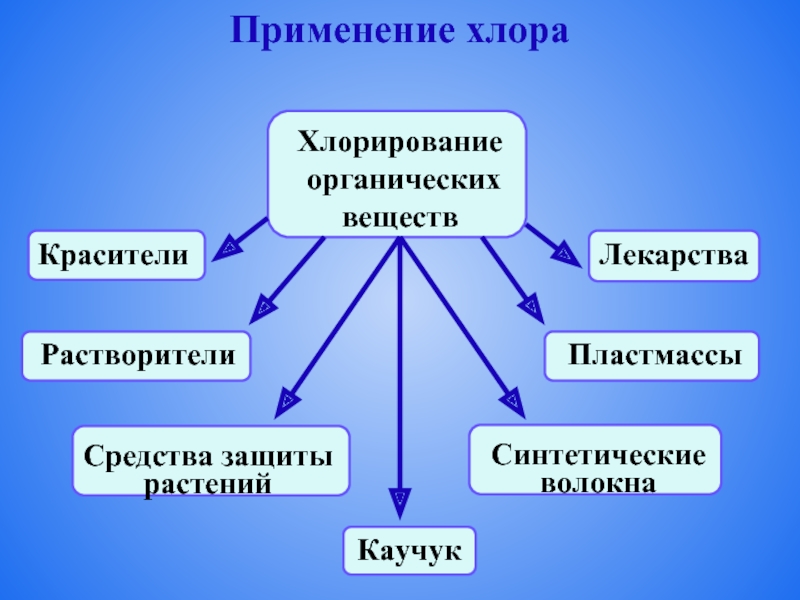
- 11. Применение хлора
- 12. Применение хлора
- 13. Оконный профиль изготовленный из хлорсодержащих полимеров Основным компонентом отбеливателей является хлорная вода
- 14. Хлор — токсичный газ, при попадании в лёгкие вызывает ожог лёгочной
- 15. Хлор был одним из первых химических отравляющих
- 16. Домашнее задание
Слайд 2История открытия
Хлор был получен шведским химиком и фармацевтом К. Шееле в
К. Шееле (1742-1786гг)
Слайд 3Положение в Периодической системе и строение атома
Хлор – элемент главной подгруппы
Cl )2е )8е )7е
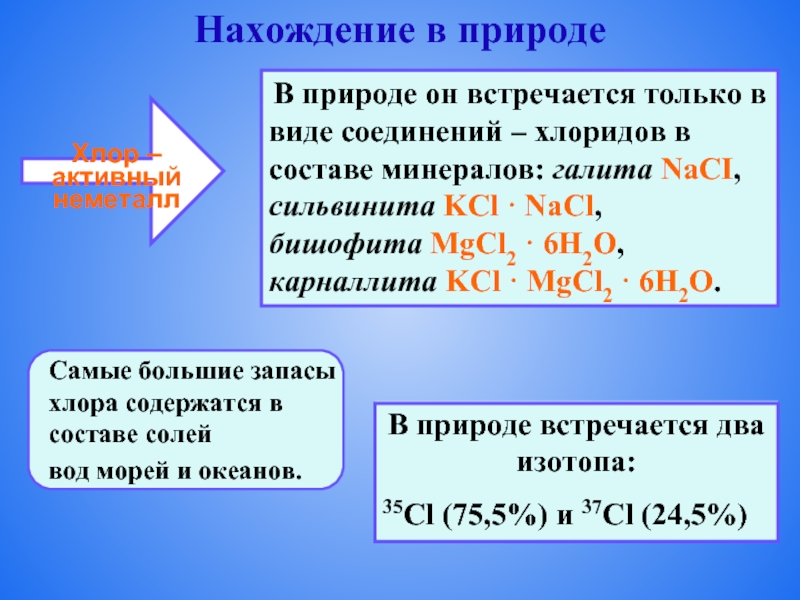
Слайд 4Нахождение в природе
Хлор – активный неметалл
В природе он встречается только в
сильвинита KCl · NaCl,
бишофита MgCl2 · 6H2O,
карналлита KCl · MgCl2 · 6Н2O.
Слайд 5Получение хлора
Все способы получения хлора сводятся к окислению его ионов:
2Cl -1
В промышленности
Слайд 7Физические свойства
Газ желто-зеленого цвета, почти в 2,5 раза тяжелее воздуха, с
Легко сжижается.
В 1 объеме воды растворяется 2,5 объема хлора, этот раствор называется хлорной водой.
Слайд 8Химические свойства
Хлор взаимодействует
с простыми веществами:
с активными металлами
K
2
2
Слайд 9 Fe + Cl2 = FeCI3
Cu
Au + Cl2 = AuCI3
с водородом
H2 + Cl2 = HCl
2
с неметаллами
P + Cl2 = PCl5
2 5 2
Хлор непосредственно не реагирует с кислородом, азотом и углеродом.
H2 + Cl2 = HCl
с металлами при нагревании
Слайд 10Химические свойства
Взаимодействует со сложными веществами
с водой
H2О + Cl2
0 -1 +1
соляная хлорноватистая
кислота кислота
Хлорноватистая кислота неустойчива и разлагается с образованием атомарного кислорода
HClO = HCl + O
атомарный
кислород
+1 -2 -1 0
вытесняет из солей бром и йод
Слайд 13Оконный профиль изготовленный из хлорсодержащих полимеров
Основным компонентом отбеливателей является хлорная вода
Слайд 14Хлор — токсичный газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье.
Раздражающее действие на
При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками.
Слайд 15Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну.
На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3.