- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая кинетика презентация
Содержание
- 1. Химическая кинетика
- 2. Скорость химической реакции Скорость химической реакции это
- 3. Зависимость концентрации реагентов от времени (кинетическая кривая)
- 4. Основной постулат химической кинетики: Скорость химической реакции
- 5. Молекулярность элементарных реакций Элементарными (простыми) называют реакции,
- 6. Мономолекулярные – реакции, в которых происходит химическое
- 7. Классификация сложных реакций Последовательные реакции. Сложные реакции,
- 8. Параллельные реакции. Параллельными называют химические реакции, в
- 9. Сопряжённые реакции Сопряжёнными принято называть сложные реакции,
- 10. Цепные реакции Цепными называют реакции, состоящие из
- 11. 1. Зарождение цепи (инициация): Сl2 + h
- 12. Влияние температуры на константу скорости реакции Повышение
- 13. Правило Вант-Гоффа Величина, показывающая, во сколько раз
- 14. Прибор для определения скорости реакции
- 15. Уравнение Аррениуса Аррениус постулировал, что столкновения молекул
- 16. Элементарная реакция А + В ––> С
- 17. Энергии активации прямой и обратной реакции связаны
- 18. КАТАЛИТИЧЕСКИЕ ПРОЦЕССЫ Катализ – явление изменения скорости
- 19. заключается в его способности ускорять только одну
- 20. Селективность катализатора Способность ускорять одну из возможных
- 21. Гомогенный катализ. Гомогенный катализ – каталитические реакции,
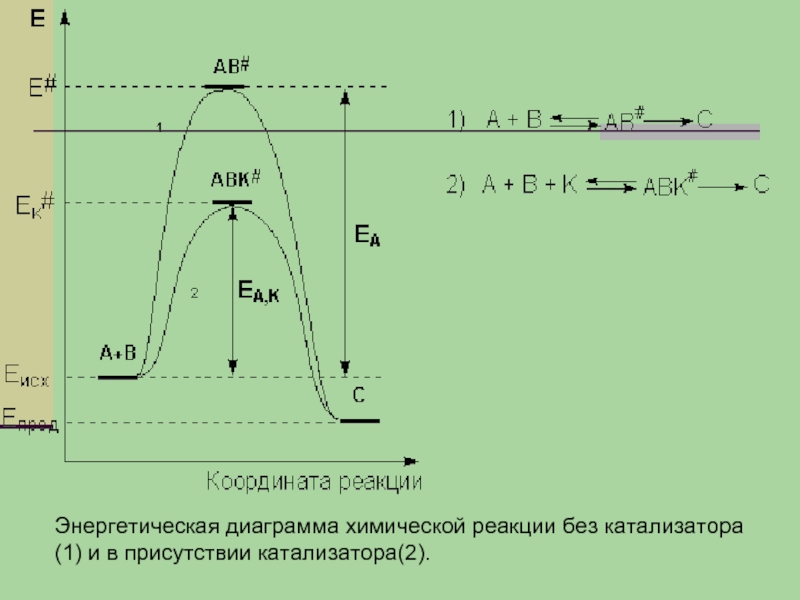
- 22. Энергетическая диаграмма химической реакции без катализатора (1) и в присутствии катализатора(2).
- 23. Автокатализ. Автокатализ – процесс каталитического ускорения химической
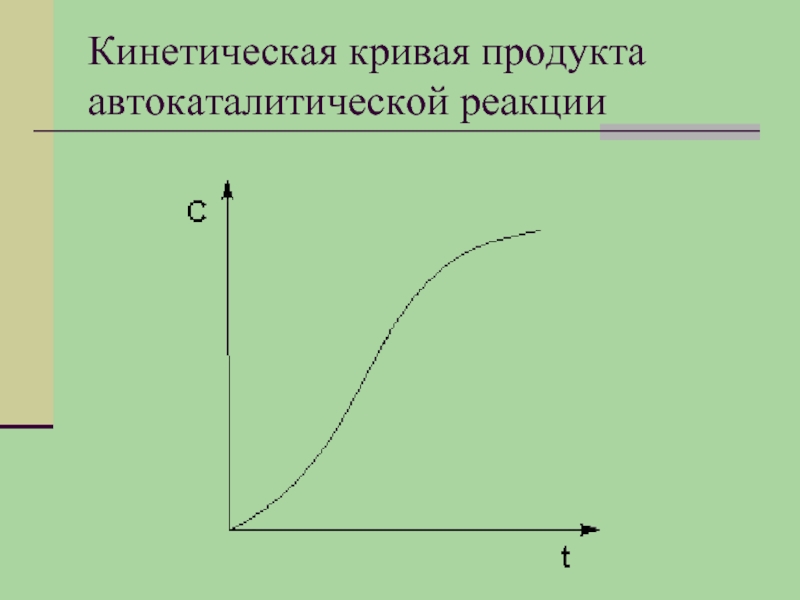
- 24. Кинетическая кривая продукта автокаталитической реакции
- 25. Гетерогенный катализ. Гетерогенный катализ – каталитические реакции,
- 26. Специфической особенностью гетерокаталитических процессов является способность катализатора
- 27. Ферментативный катализ. Ферментативный катализ – каталитические реакции,
- 28. 1. Высокая активность, на несколько порядков превышающая
- 29. Характерной особенностью действия ферментов является также высокая
- 30. Спасибо за внимание!!!
Слайд 2Скорость химической реакции
Скорость химической реакции это число элементарных актов химической реакции,
происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Слайд 3Зависимость концентрации реагентов от времени (кинетическая кривая)
Кинетические кривые для исходных
веществ (А)
и продуктов реакции (В).
и продуктов реакции (В).
Слайд 4Основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих
веществ, взятых в некоторых степенях.
Т. е. для реакции
а А + b В + d D + ... ––> е Е + ...
можно записать:
Коэффициент пропорциональности k есть константа скорости химической реакции.
Т. е. для реакции
а А + b В + d D + ... ––> е Е + ...
можно записать:
Коэффициент пропорциональности k есть константа скорости химической реакции.
Слайд 5Молекулярность элементарных реакций
Элементарными (простыми) называют реакции, идущие в одну стадию. Их
принято классифицировать по молекулярности:
Молекулярность элементарной реакции – число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Молекулярность элементарной реакции – число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Слайд 6Мономолекулярные – реакции, в которых происходит химическое превращение одной молекулы (изомеризация,
диссоциация):
I2 ––> I• + I•
Бимолекулярные – реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН ––> СН3ОН + КВr
Тримолекулярные – реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО ––> 2NО2
I2 ––> I• + I•
Бимолекулярные – реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН ––> СН3ОН + КВr
Тримолекулярные – реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО ––> 2NО2
Слайд 7Классификация сложных реакций
Последовательные реакции.
Сложные реакции, протекающие таким образом, что вещества, образующиеся
в результате одной стадии (т.е. продукты этой стадии), являются исходными веществами для другой стадии.
Схематически :
А ––> В ––> С ––> ...
Число стадий и веществ, принимающих участие в каждой из стадий, может быть различным.
Схематически :
А ––> В ––> С ––> ...
Число стадий и веществ, принимающих участие в каждой из стадий, может быть различным.
Слайд 8Параллельные реакции.
Параллельными называют химические реакции, в которых одни и те же
исходные вещества одновременно могут образовывать различные продукты реакции, например, два или более изомера:
Слайд 9Сопряжённые реакции
Сопряжёнными принято называть сложные реакции, протекающие следующим образом:
1) А +
В ––> С
2) А + D ––> Е,
причём одна из реакций может протекать самостоятельно, а вторая возможна только при наличии первой.
Вещество А, общее для обеих реакций, носит название актор, вещество В – индуктор, вещество D, взаимодействующее с А только при наличии первой реакции – акцептор.
2) А + D ––> Е,
причём одна из реакций может протекать самостоятельно, а вторая возможна только при наличии первой.
Вещество А, общее для обеих реакций, носит название актор, вещество В – индуктор, вещество D, взаимодействующее с А только при наличии первой реакции – акцептор.
Слайд 10Цепные реакции
Цепными называют реакции, состоящие из ряда взаимосвязанных стадий, когда частицы,
образующиеся в результате каждой стадии, генерируют последующие стадии.
Как правило, цепные реакции протекают с участием свободных радикалов.
Как правило, цепные реакции протекают с участием свободных радикалов.
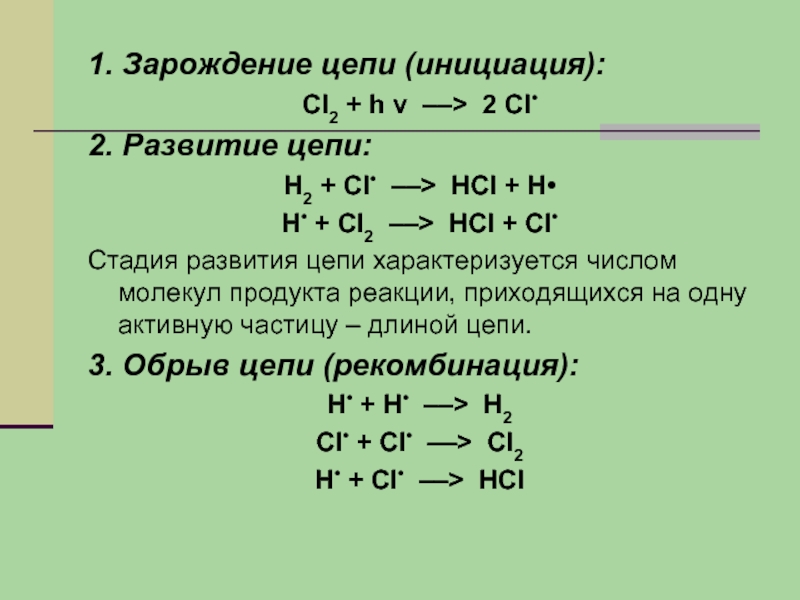
Слайд 111. Зарождение цепи (инициация):
Сl2 + h ν ––> 2 Сl•
2. Развитие
цепи:
Н2 + Сl• ––> НСl + Н•
Н• + Сl2 ––> НСl + Сl•
Стадия развития цепи характеризуется числом молекул продукта реакции, приходящихся на одну активную частицу – длиной цепи.
3. Обрыв цепи (рекомбинация):
Н• + Н• ––> Н2
Сl• + Сl• ––> Сl2
Н• + Сl• ––> НСl
Н2 + Сl• ––> НСl + Н•
Н• + Сl2 ––> НСl + Сl•
Стадия развития цепи характеризуется числом молекул продукта реакции, приходящихся на одну активную частицу – длиной цепи.
3. Обрыв цепи (рекомбинация):
Н• + Н• ––> Н2
Сl• + Сl• ––> Сl2
Н• + Сl• ––> НСl
Слайд 12Влияние температуры на константу скорости реакции
Повышение температуры, как правило, увеличивает константу
скорости. Первая попытка учесть влияние температуры была сделана Вант-Гоффом, сформулировавшим следующее эмпирическое правило:
При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2 – 4 раза.
При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2 – 4 раза.
Слайд 13Правило Вант-Гоффа
Величина, показывающая, во сколько раз увеличивается константа скорости при повышении
температуры на 10 градусов, есть температурный коэффициент константы скорости реакции γ. Математически правило Вант-Гоффа можно записать следующим образом:
Слайд 15Уравнение Аррениуса
Аррениус постулировал, что столкновения молекул будут эффективны (т.е. будут приводить
к реакции) только в том случае, если сталкивающиеся молекулы обладают некоторым запасом энергии – энергией активации.
Энергия активации есть минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию.
Энергия активации есть минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию.
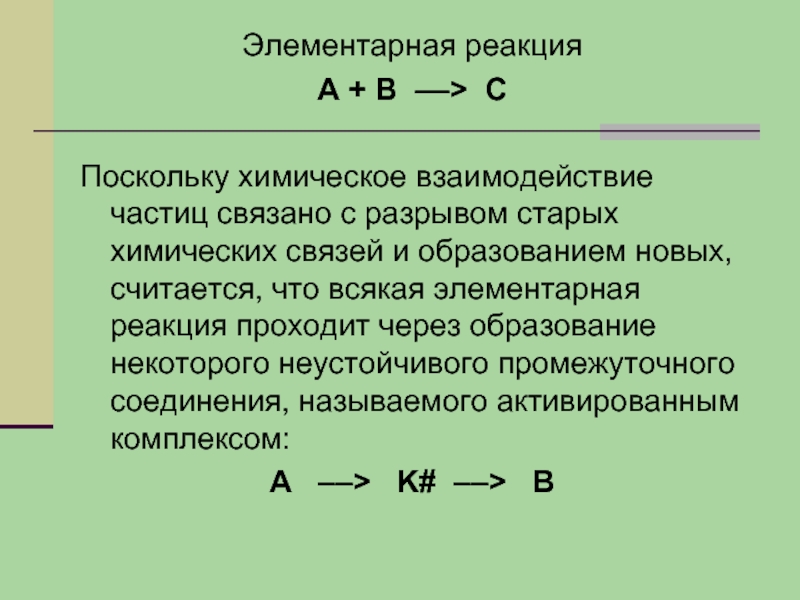
Слайд 16Элементарная реакция
А + В ––> С
Поскольку химическое взаимодействие частиц связано с
разрывом старых химических связей и образованием новых, считается, что всякая элементарная реакция проходит через образование некоторого неустойчивого промежуточного соединения, называемого активированным комплексом:
А ––> K# ––> B
А ––> K# ––> B
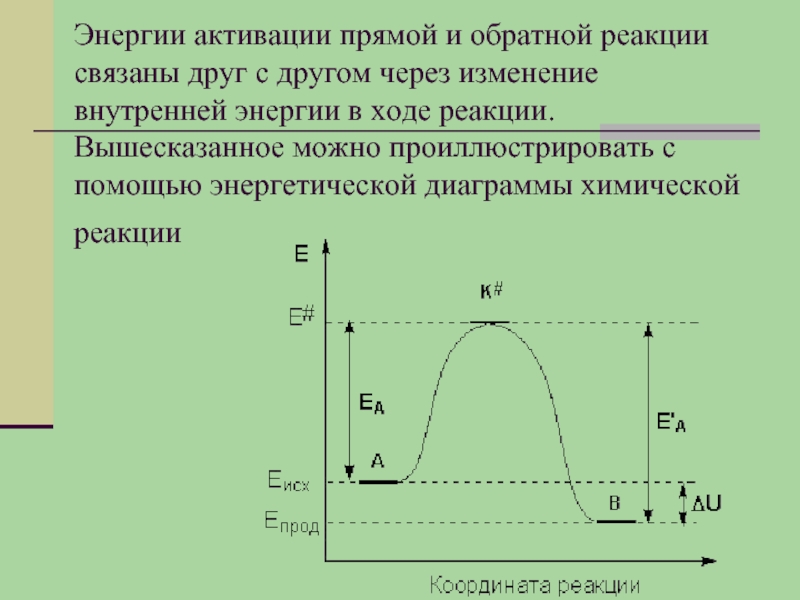
Слайд 17Энергии активации прямой и обратной реакции связаны друг с другом через
изменение внутренней энергии в ходе реакции. Вышесказанное можно проиллюстрировать с помощью энергетической диаграммы химической реакции
Слайд 18КАТАЛИТИЧЕСКИЕ ПРОЦЕССЫ
Катализ – явление изменения скорости химической реакции в присутствии веществ,
состояние и количество которых после реакции остаются неизменными.
Различают положительный и отрицательный катализ (соответственно увеличение и уменьшение скорости реакции), хотя часто под термином "катализ" подразумевают только положительный катализ; отрицательный катализ называют ингибированием.
Различают положительный и отрицательный катализ (соответственно увеличение и уменьшение скорости реакции), хотя часто под термином "катализ" подразумевают только положительный катализ; отрицательный катализ называют ингибированием.
Слайд 19заключается в его способности ускорять только одну реакцию или группу однотипных
реакций и не влиять на скорость других реакций.
Так, например, многие переходные металлы (платина, медь, никель, железо и т.д.) являются катализаторами для процессов гидрирования; оксид алюминия катализирует реакции гидратации и т.д.
Так, например, многие переходные металлы (платина, медь, никель, железо и т.д.) являются катализаторами для процессов гидрирования; оксид алюминия катализирует реакции гидратации и т.д.
Специфичность катализатора
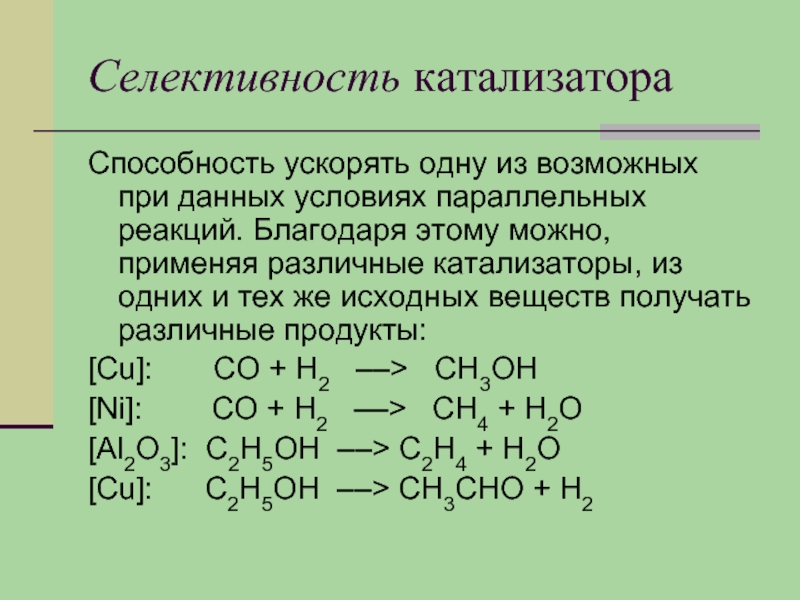
Слайд 20Селективность катализатора
Способность ускорять одну из возможных при данных условиях параллельных реакций.
Благодаря этому можно, применяя различные катализаторы, из одних и тех же исходных веществ получать различные продукты:
[Cu]: СО + Н2 ––> СН3ОН
[Ni]: СО + Н2 ––> СН4 + Н2О
[Al2О3]: С2Н5ОН ––> С2Н4 + Н2О
[Cu]: С2Н5ОН ––> СН3СНО + Н2
[Cu]: СО + Н2 ––> СН3ОН
[Ni]: СО + Н2 ––> СН4 + Н2О
[Al2О3]: С2Н5ОН ––> С2Н4 + Н2О
[Cu]: С2Н5ОН ––> СН3СНО + Н2
Слайд 21Гомогенный катализ.
Гомогенный катализ – каталитические реакции, в которых реагенты и катализатор
находятся в одной фазе. Рассмотрим некоторую реакцию
А + В ––> С
В присутствии катализатора осуществляются две быстро протекающие стадии, в результате которых образуются частицы промежуточного соединения АК и затем (через активированный комплекс АВК#) конечный продукт реакции с регенерацией катализатора:
А + К ––> АК
АК + В ––> С + К
А + В ––> С
В присутствии катализатора осуществляются две быстро протекающие стадии, в результате которых образуются частицы промежуточного соединения АК и затем (через активированный комплекс АВК#) конечный продукт реакции с регенерацией катализатора:
А + К ––> АК
АК + В ––> С + К
Слайд 22Энергетическая диаграмма химической реакции без катализатора (1) и в присутствии катализатора(2).
Слайд 23Автокатализ.
Автокатализ – процесс каталитического ускорения химической реакции одним из её продуктов.
Особенность автокаталитической реакции состоит в том, что данная реакция протекает с постоянным возрастанием концентрации катализатора. Поэтому в начальный период реакции скорость её возрастает, а на последующих стадиях в результате убыли концентрации реагентов скорость начинает уменьшаться
Слайд 25Гетерогенный катализ.
Гетерогенный катализ – каталитические реакции, идущие на поверхности раздела фаз,
образуемых катализатором и реагирующими веществами. Механизм гетерогенно-каталитических процессов значительно более сложен, чем в случае гомогенного катализа.
Слайд 26Специфической особенностью гетерокаталитических процессов является способность катализатора к промотированию и отравлению.
Промотирование
– увеличение активности катализатора в присутствии веществ, которые сами не являются катализаторами данного процесса (промоторов).
Отравление – резкое снижение активности катализатора в присутствии некоторых веществ (т. н. каталитических ядов).
Отравление – резкое снижение активности катализатора в присутствии некоторых веществ (т. н. каталитических ядов).
Слайд 27Ферментативный катализ.
Ферментативный катализ – каталитические реакции, протекающие с участием ферментов –
биологических катализаторов белковой природы. Ферментативный катализ имеет две характерные особенности:
Слайд 281. Высокая активность, на несколько порядков превышающая активность неорганических катализаторов, что
объясняется очень значительным снижением энергии активации процесса ферментами.
2. Высокая специфичность. Например, амилаза катализирует процесс расщепления крахмала, представляющего собой цепь одинаковых глюкозных звеньев, но не катализирует гидролиз сахарозы, молекула которой составлена из глюкозного и фруктозного фрагментов.
2. Высокая специфичность. Например, амилаза катализирует процесс расщепления крахмала, представляющего собой цепь одинаковых глюкозных звеньев, но не катализирует гидролиз сахарозы, молекула которой составлена из глюкозного и фруктозного фрагментов.
Слайд 29Характерной особенностью действия ферментов является также высокая чувствительность активности ферментов к
внешним условиям – рН среды и температуре.
Ферменты активны лишь в достаточно узком интервале рН и температуры, причем для ферментов характерно наличие в этом интервале максимума активности при некотором оптимальном значении рН или температуры; по обе стороны от этого значения активность ферментов быстро снижается.
Ферменты активны лишь в достаточно узком интервале рН и температуры, причем для ферментов характерно наличие в этом интервале максимума активности при некотором оптимальном значении рН или температуры; по обе стороны от этого значения активность ферментов быстро снижается.