- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
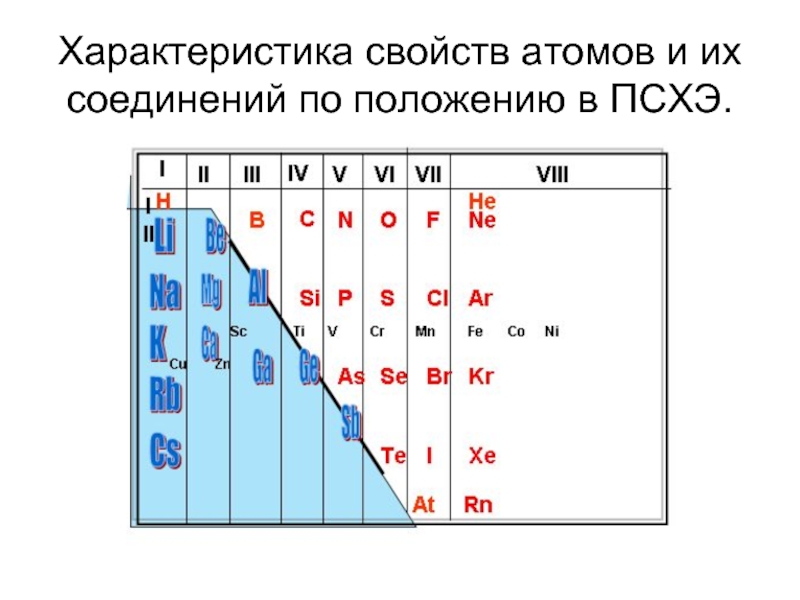
Характеристика свойств атомов и их соединений по положению в ПСХЭ. презентация
Содержание
- 1. Характеристика свойств атомов и их соединений по положению в ПСХЭ.
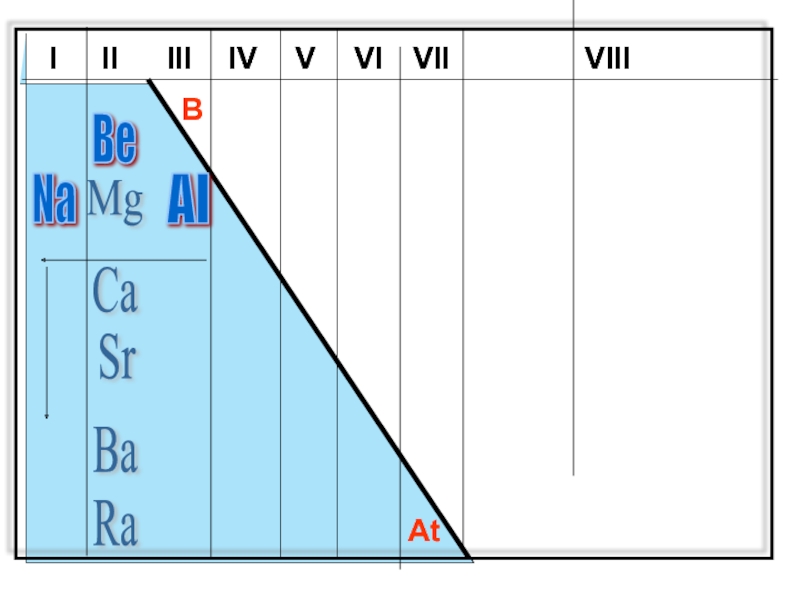
- 2. Металлические свойства усиливаются (восстановительные свойства- отдача электронов)
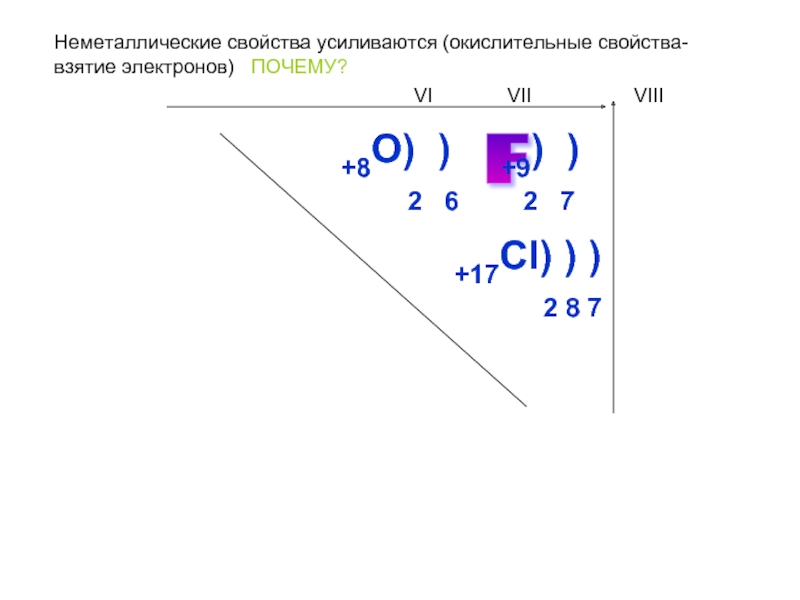
- 3. Неметаллические свойства усиливаются (окислительные свойства- взятие электронов)
- 4. Неметаллические свойства усиливаются, кислотные свойства соединений тоже
- 5. Работа с учебником стр.5 1.Положение в
- 6. I II III IV V
- 7. 5. Сравнение с соседями по
- 8. +
- 9. 7. Оксид магния является основным оксидом MgO
- 10. Работа с учебником стр.5 1.Положение в
- 11. 5. Сравнение с соседями по
- 12. 7. Оксид cеры(IV) является кислотным оксидом
- 13. 9.Неметаллы образуют водородные соединения Общие формулы Водородных
Слайд 2Металлические свойства усиливаются (восстановительные свойства-
отдача электронов) ПОЧЕМУ?
Cs
+3Li) )
+4Be) )
2 2
+11Na) ) )
2 8 1
I
II
Слайд 3Неметаллические свойства усиливаются (окислительные свойства-
взятие электронов) ПОЧЕМУ?
F
+8О) )
+9) )
2 7
VI
VII
VIII
+17Cl) ) )
2 8 7
Слайд 4Неметаллические свойства усиливаются, кислотные свойства соединений тоже
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
основные
амфотерный
кислотные
Составьте соответствующие гидроксиды: основания и
Мет.свойства усиливаются и
основные свойства тоже
Немет.свойства усиливаются
и кислотные свойства тоже
Высшие оксиды (с.о. = № группы)
Слайд 5Работа с учебником стр.5
1.Положение в ПСХЭ.
2.Строение атома
2 8 2
3. Mg – металл( с.о. +2)
4. Сравнение с соседями по периоду:
Магний обладает восстановительными
cвойствами и : Na >Mg > Al
Mg
- магний
Слайд 7
5. Сравнение с соседями по подгруппе:
Магний обладает восстановительными
cвойствами
6.Как простое вещество Mg – металл и у него металлич. кристалическая решётка.
Слайд 8
+
В узлах кристаллической решётки металлов находятся атомы и положительные ионы, связанные
Слайд 97. Оксид магния является основным оксидом MgO
видео
8. Гидроксид магния является основанием
Напишите уравнения реакций оксида магния
и гидроксида с любой кислотой
Общие формулы
высших оксидов
в таблице Менделеева
Слайд 10Работа с учебником стр.5
1.Положение в ПСХЭ.
2.Строение атома
2 8 6
3. S – неметалл. Обладает и восстановительными ( с.о. +4,+6) и окислительными свойствами ( -2)
4. Сравнение с соседями по периоду:
по окислительным свойствам :
O >S > Se
S
- сера
Слайд 11
5. Сравнение с соседями по подгруппе:
по окислительным свойствам :
6.Как простое вещество S – неметалл и у неё молекулярная решётка.
Слайд 127. Оксид cеры(IV) является кислотным оксидом
SO2 и получается при
Высший оксид SO3 получают
окислением SO2 на катализаторе
SO2 + O2 → SO3.Почему сера
в природе не окисляется сразу до SO3 ?
видео
Гидроксид cеры(VI) является очень сильной
серной кислотой Н2SO4
8. Гидроксид cеры(IV) является очень слабой
сернистой кислотой Н2SO3
видео
Слайд 139.Неметаллы образуют водородные соединения
Общие формулы
Водородных соединений
в таблице Менделеева
H2S
Напишите уравнения реакций оксида
и оксида серы (VI) cо щёлочью - гидроксидом
натрия, а также серной кислоты с гидроксидом железа(III)
§1 №1,5,6 стр.8
Домашнее задание