- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гидролиз презентация
Содержание
- 1. Гидролиз
- 2. Гидролиз- это реакция обменного разложения веществ водой.
- 3. Значение гидролиза
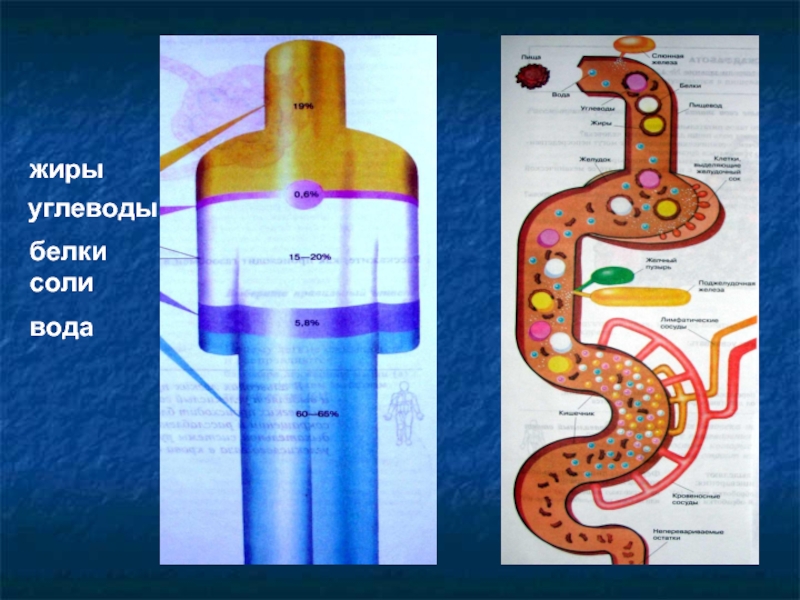
- 4. жиры углеводы белки соли вода
- 6. Значение гидролиза
- 7. Значение гидролиза
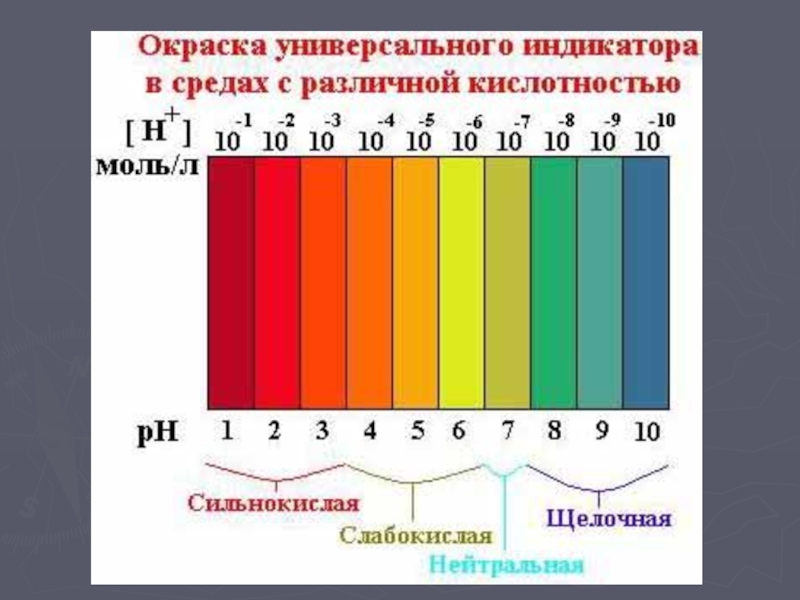
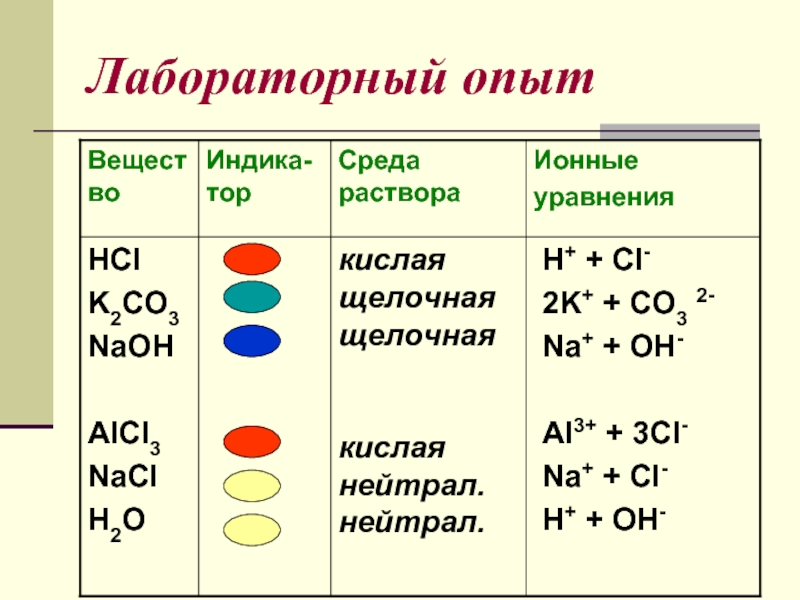
- 8. Лабораторный опыт Испытайте растворы выданных вам веществ универсальным индикатором.
- 10. Лабораторный опыт
- 12. Проверь себя Выберите формулы слабых кислот:
- 13. 3. Какие вещества являются слабыми основаниями:
- 14. 5. Вещество FeCl2 является солью:
- 15. Алгоритм написания гидролиза 1. Определяем каким основанием
- 16. Алгоритм написания гидролиза соли 5. Записываем уравнение
- 17. 1. Соли, образованные сильным основанием и слабой
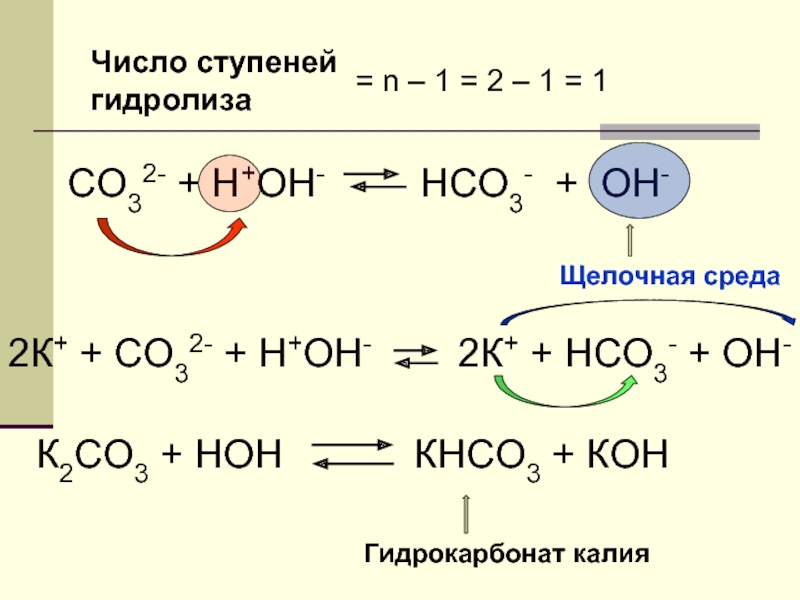
- 18. СО32- + Н+ОН- НСО3- +
- 19. ВЫВОД Соли, образованные сильным основа- нием и
- 20. 2. Соли, образованные слабым основанием и сильной
- 21. Число ступеней гидролиза = n – 1
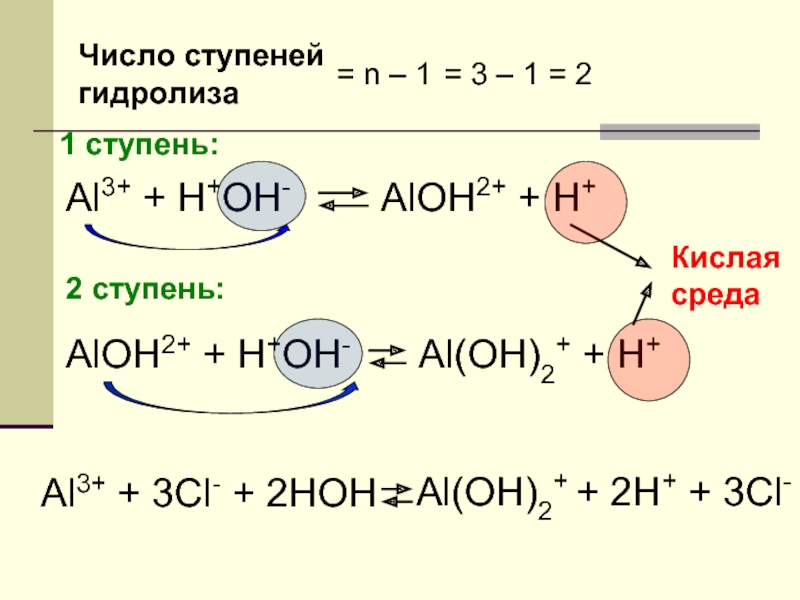
- 22. Al3+ + 3Cl- + 2HOH Al(OH)2+ +
- 23. ВЫВОД Соли, образованные слабым ос- нованием и
- 24. 3. Соли, образованные слабым основанием и слабой
- 25. 2NH4+ + S2- + 2Н+ОН- 2NH4OH+ H2S
- 26. ВЫВОД Гидролиз соли, образованной слабым основанием и
- 27. 4. Соли, образованные сильным основанием и сильной
- 28. ВЫВОД Соли, образованные сильной кислотой и
- 29. Заполните таблицу, ответив на вопросы:
- 30. Проверь себя
- 31. Упражнение Напишите уравнения реакций гидро- лиза солей:
- 32. Проверь себя 1. Гидролизу по аниону подвергаются
- 33. 3. Водный раствор какой соли подвергается
- 34. Упражнение Определите реакцию среды в раст- воре солей: FeCl2, Ba(NO3)2, Na2CO3, K2S, Mn(NO3)2.
- 35. Проверь себя FeCl2 -
Слайд 11
Гидролиз -
процесс
с водой, в результате которого
образуется слабый электролит.
Слайд 12Проверь себя
Выберите формулы слабых кислот:
HCl
HNO3 H2CO3
H2SiO3 H2SO4
.
2. Какие вещества относятся к сильным кислотам:
НCN НNO3
HCl Н2O
HF HI
Слайд 133. Какие вещества являются слабыми
основаниями:
KOH
NH4ОН Ca(OH)2
RbOH Fe(OH)3
4. Выберите из приведенного списка формул
веществ сильные основания:
Al(OH)3 Ba(OH)2
Cu(OH)2 Zn(OH)2
Ca(OH)2 NaOH
Слайд 145. Вещество FeCl2 является солью:
сильного основания и сильной кислоты
сильного основания и слабой кислоты
слабого основания и сильной кислоты
слабого основания и слабой кислоты
6. Вещество K2SO3 является солью:
сильного основания и сильной кислоты
сильного основания и слабой кислоты
слабого основания и сильной кислоты
слабого основания и слабой кислоты
Слайд 15Алгоритм написания гидролиза
1. Определяем каким основанием и какой кислотой образована соль.
2. Записываем диссоциацию соли и подчеркиваем ион слабого электролита.
3. Записываем диссоциацию воды.
4. Определяем число ступеней гидролиза: (n - 1), где n – численное значение заряда иона слабого электролита.
Слайд 16Алгоритм написания гидролиза соли
5. Записываем уравнение взаимодействия иона слабого электролита с
6. Определяем среду раствора соли.
7. Записываем полное ионное уравнение гидролиза соли.
8. Записываем молекулярное уравнение гидролиза соли.
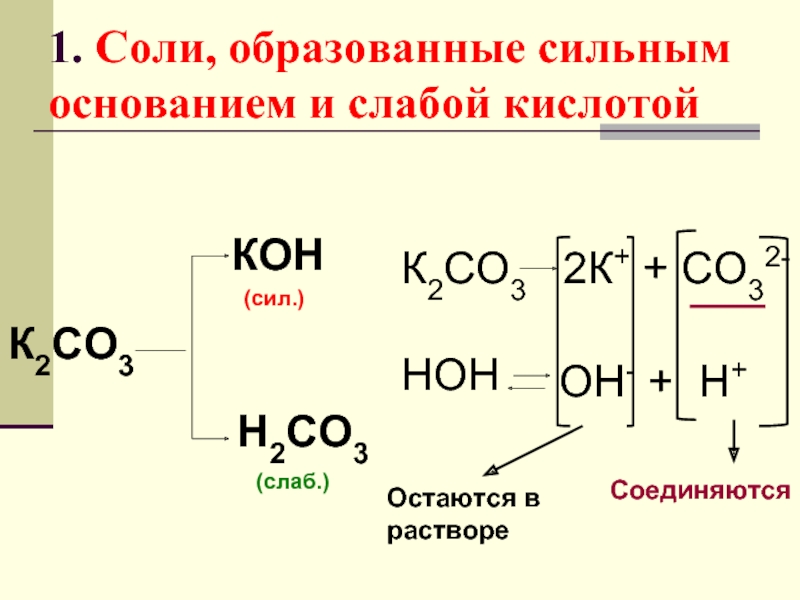
Слайд 171. Соли, образованные сильным основанием и слабой кислотой
К2СО3
КОН
Н2СО3
(сил.)
(слаб.)
К2СО3
2К+ + СО32-
НОН
ОН- +
Остаются в
растворе
Соединяются
Слайд 18СО32- + Н+ОН-
НСО3- + ОН-
2К+ + СО32- + Н+ОН-
2К+
Щелочная среда
К2СО3 + НОН
КНСО3 + КОН
Гидрокарбонат калия
Число ступеней
гидролиза
= n – 1 = 2 – 1 = 1
Слайд 19ВЫВОД
Соли, образованные сильным основа-
нием и слабой кислотой, в водном ра-
створе имеют
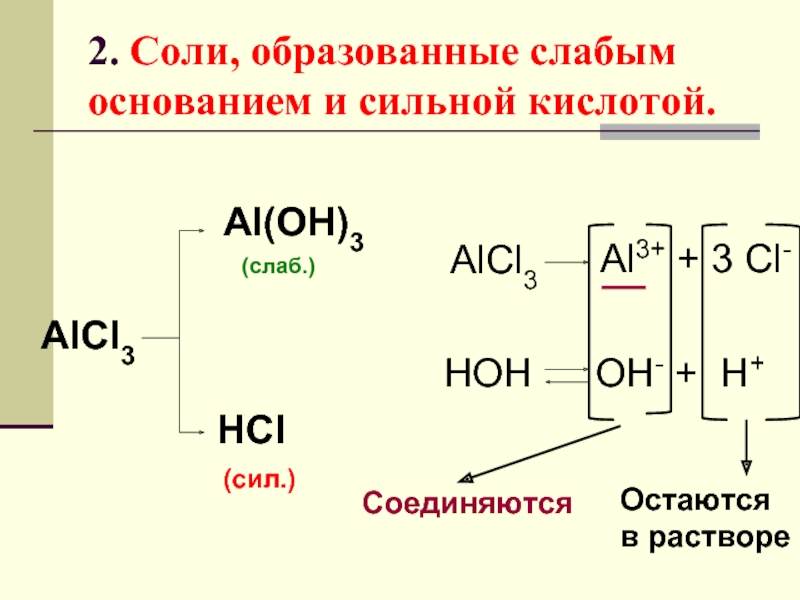
Слайд 202. Соли, образованные слабым основанием и сильной кислотой.
AlCl3
Al(OH)3
HCl
(слаб.)
(сил.)
AlCl3
Al3+ + 3 Cl-
HOH
OH-
Соединяются
Остаются
в растворе
Слайд 21Число ступеней
гидролиза
= n – 1
= 3 – 1 = 2
1 cтупень:
Al3+
AlOH2+ + H+
2 ступень:
AlOH2+ + H+OH-
Al(OH)2+ + H+
Кислая
среда
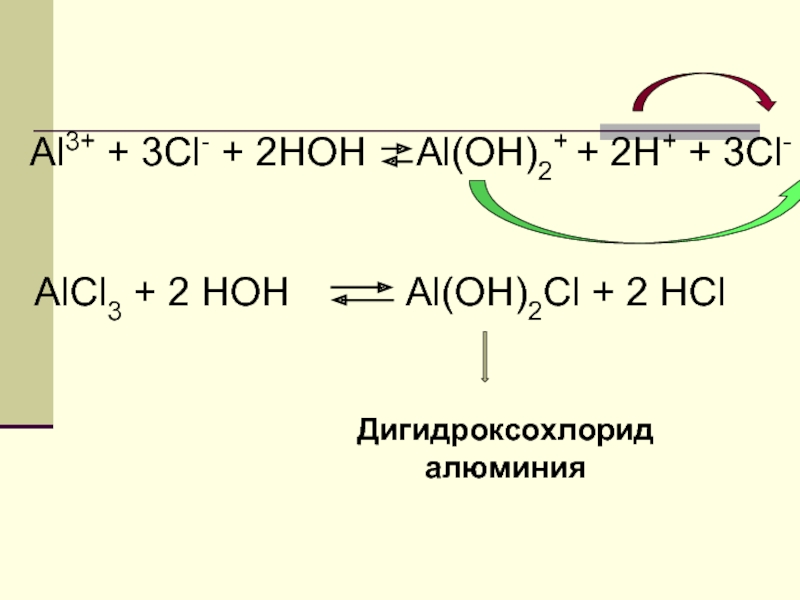
Al3+ + 3Cl- + 2HOH
Al(OH)2+ + 2H+ + 3Cl-
Слайд 22Al3+ + 3Cl- + 2HOH
Al(OH)2+ + 2H+ + 3Cl-
AlCl3 + 2
Al(OH)2Cl + 2 HCl
Дигидроксохлорид
алюминия
Слайд 23ВЫВОД
Соли, образованные слабым ос-
нованием и сильной кислотой,
в водном растворе имеют кислую
реакцию
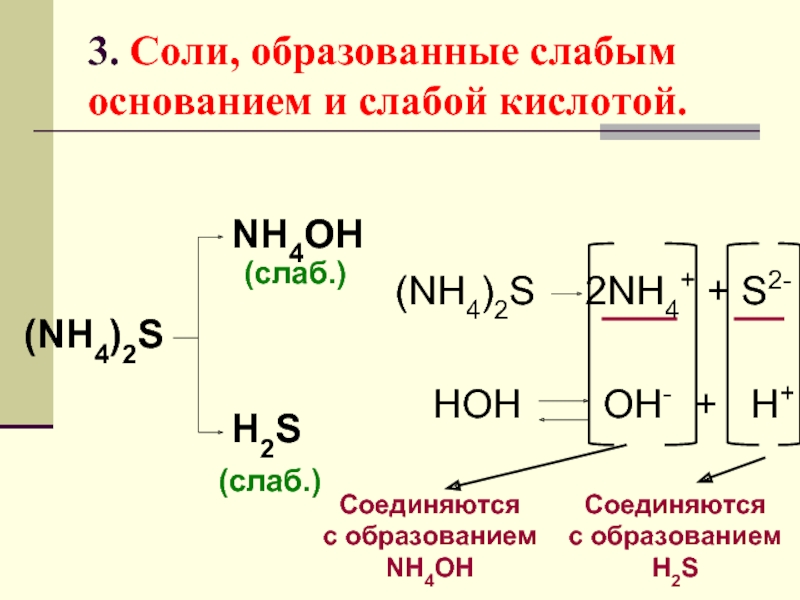
Слайд 243. Соли, образованные слабым основанием и слабой кислотой.
(NH4)2S
NH4OH
(слаб.)
H2S
(слаб.)
(NH4)2S
2NH4+ + S2-
HOH
OH- +
Соединяются
c образованием
NH4OH
Соединяются
c образованием
H2S
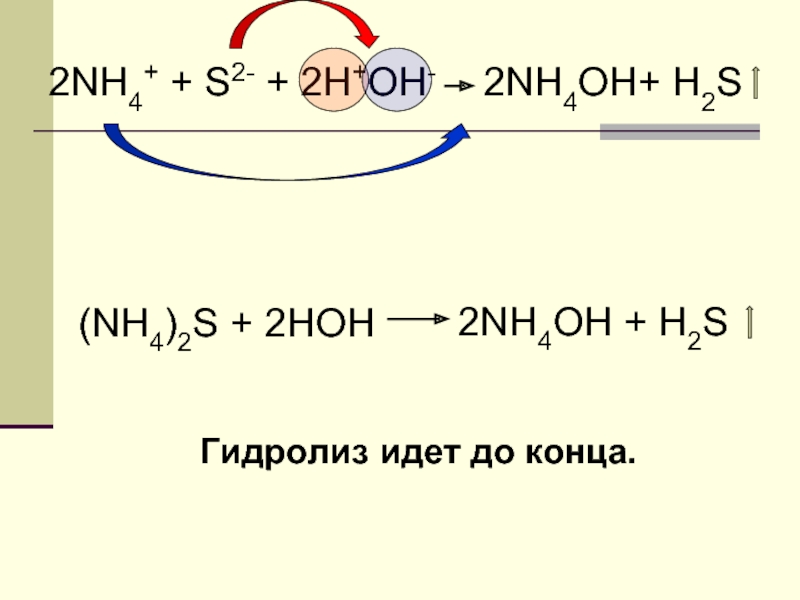
Слайд 26ВЫВОД
Гидролиз соли, образованной слабым
основанием и слабой кислотой, идет
до конца. Реакция
силы этих электролитов.
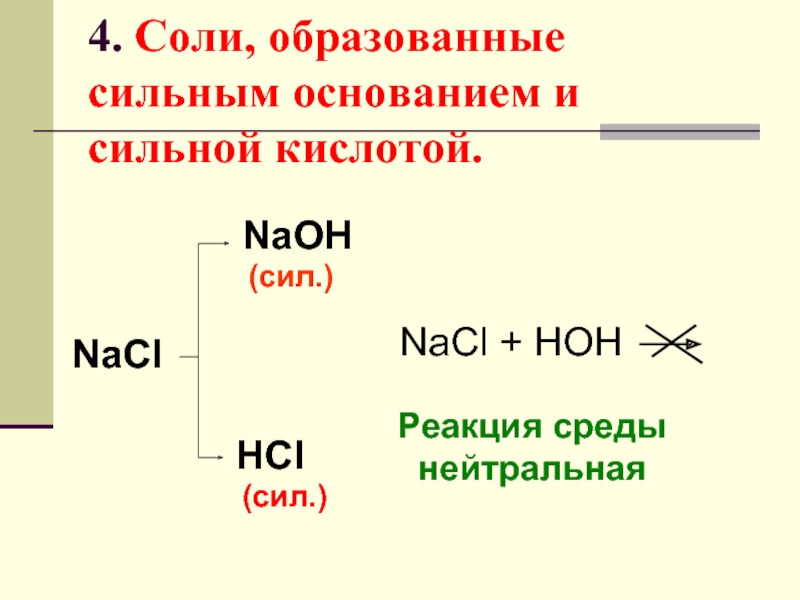
Слайд 274. Соли, образованные сильным основанием и сильной кислотой.
NaCl
NaOH
HCl
(сил.)
(сил.)
NaCl + HOH
Реакция среды
нейтральная
Слайд 28ВЫВОД
Соли, образованные сильной кислотой
и сильным основанием, не гидролизу-
ются. Реакция среды
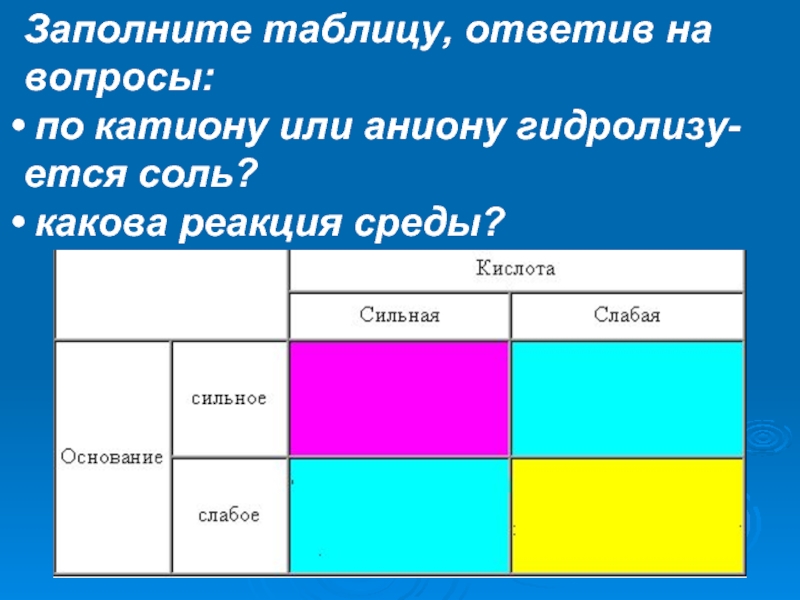
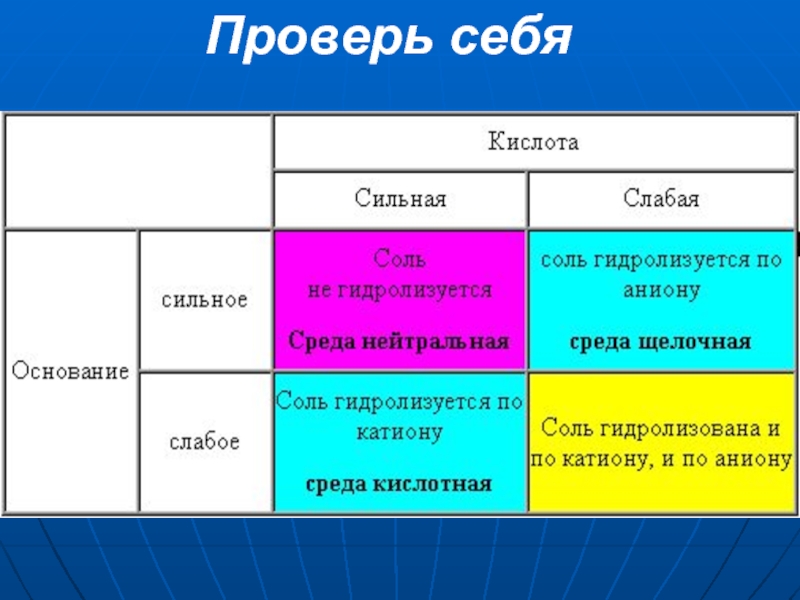
Слайд 29Заполните таблицу, ответив на
вопросы:
по катиону или аниону гидролизу-
ется соль?
Слайд 31Упражнение
Напишите уравнения реакций гидро-
лиза солей: CuCl2, Na2SO4, K3PO4,
Fe(NO3)3, Al2S3, Na2SO3.
Определите
ре.
Слайд 32Проверь себя
1. Гидролизу по аниону подвергаются водные
растворы следующих солей:
карбоната калия сульфата аммония
2. Какие из перечисленных солей подвергаются гидролизу по катиону:
CaCl2 Fe2(SO4)3
NaNO3 CrCl3
Na2CO3
Слайд 333. Водный раствор какой соли подвергается
гидролизу и по катиону, и
бромид алюминия ацетат натрия
карбонат аммония сульфат хрома
4. Гидролиз протекает при растворении в
воде соли:
CaBr2 Ba(NO3)2
Na2SO4 AlCl3
Слайд 34Упражнение
Определите реакцию среды в раст-
воре солей: FeCl2, Ba(NO3)2, Na2CO3,
K2S, Mn(NO3)2.
Слайд 35Проверь себя
FeCl2 - кислая
Ba(NO3)2 - нейтральная
Na2CO3
K2S - щелочная
Mn(NO3)2 - кислая