- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гидролиз презентация
Содержание
- 1. Гидролиз
- 2. Содержание урока 1. Понятие : гидролиз Классификация
- 3. Гидролиз – это реакция обменного разложения веществ
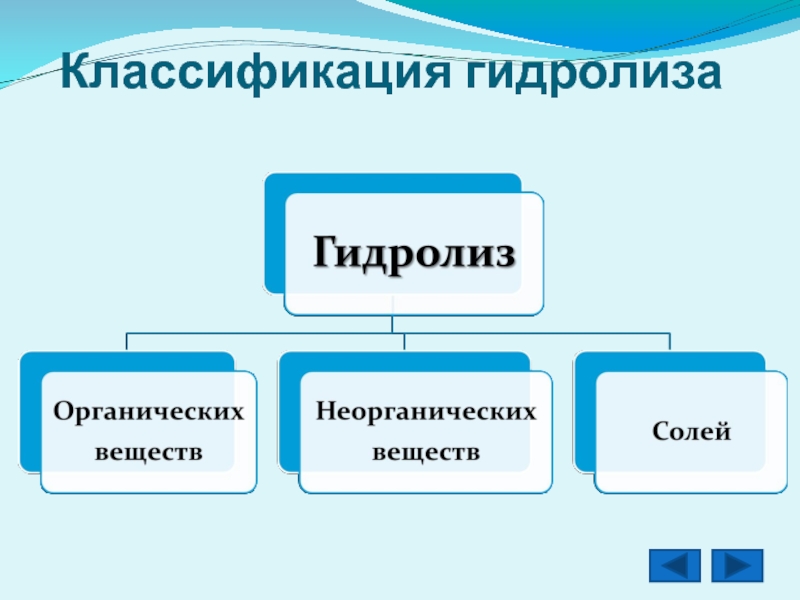
- 4. Классификация гидролиза
- 5. гидролиз
- 6. Гидролиз органических веществ Гидролиз галагеналканов Гидролиз сложных
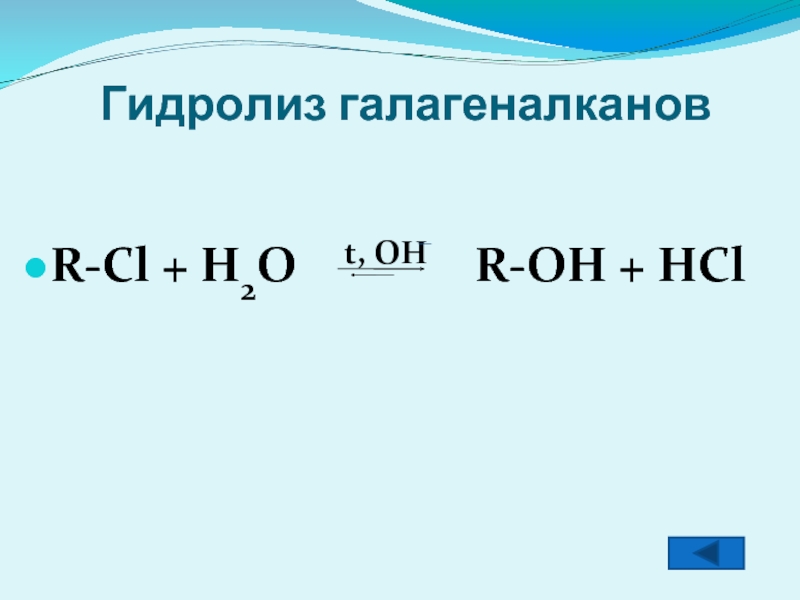
- 7. Гидролиз галагеналканов R-Cl + H2O
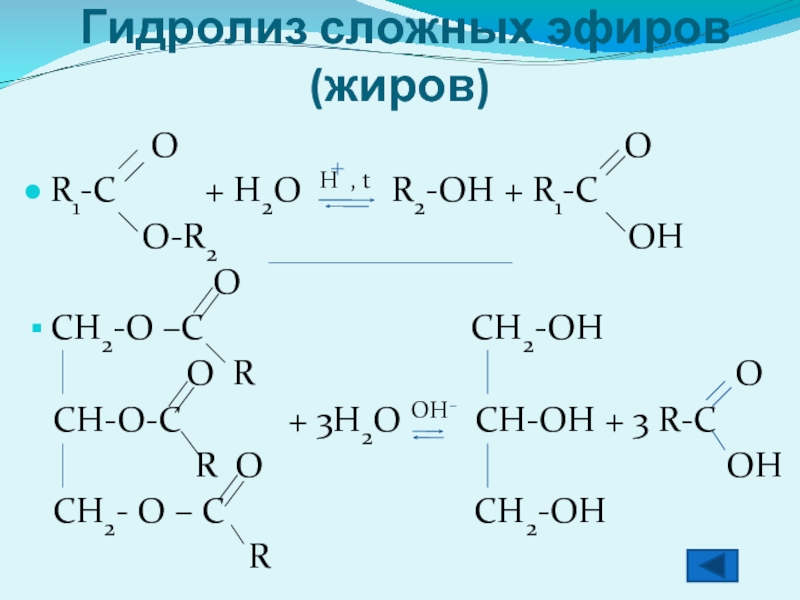
- 8. Гидролиз сложных эфиров (жиров)
- 9. Гидролиз углеводов Крахмал пищи Глюкоза
- 10. Гидролиз белков
- 11. Гидролиз АТФ (аденозинтрифосфорная кислота) АТФ + Н2О Н3РО4 + АДФ + энергия
- 12. Гидролиз солей Сущность гидролиза сводится к обменному
- 13. Классификация солей
- 14. Слабые кислоты: HCOOH, CH3COOH, HCN, H2S, HF,
- 15. KNO2 = K+
- 16. Гидролиз солей, образованных слабым основанием и
- 17. Гидролиз солей, образованных слабым основанием
- 18. Гидролиз солей, образованных сильным основанием и сильной
- 19. Гидролиз солей
- 20. Гидролиз неорганических соединений Полному
- 21. Гидролиз карбидов CaC2 + 2H2O =
- 22. Гидролиз галогенидов SiCl4 + 3H2O = H2SiO4
Слайд 1Гидролиз
2010
Муниципальное общеобразовательное учреждение
Скугареевская средняя (полная) общеобразовательная школа.
Слайд 2Содержание урока
1. Понятие :
гидролиз
Классификация гидролиза
2. Гидролиз органических веществ
3. Гидролиз солей
4. Гидролиз
Слайд 3Гидролиз – это реакция обменного разложения веществ водой
Частицы растворенного вещества в
hydro – вода, lysis - распад
Слайд 6Гидролиз органических веществ
Гидролиз галагеналканов
Гидролиз сложных эфиров (жиров)
Гидролиз углеводов
Гидролиз белков
Гидролиз АТФ (аденозинтрифосфорная
Слайд 8
Гидролиз сложных эфиров (жиров)
R1-C + H2O H , t R2-OH + R1-C
O-R2 OH
O
CH2-O –C CH2-OH
O R O
CH-O-C + 3H2O OH CH-OH + 3 R-C
R O OH
CH2- O – C CH2-OH
R
Слайд 9
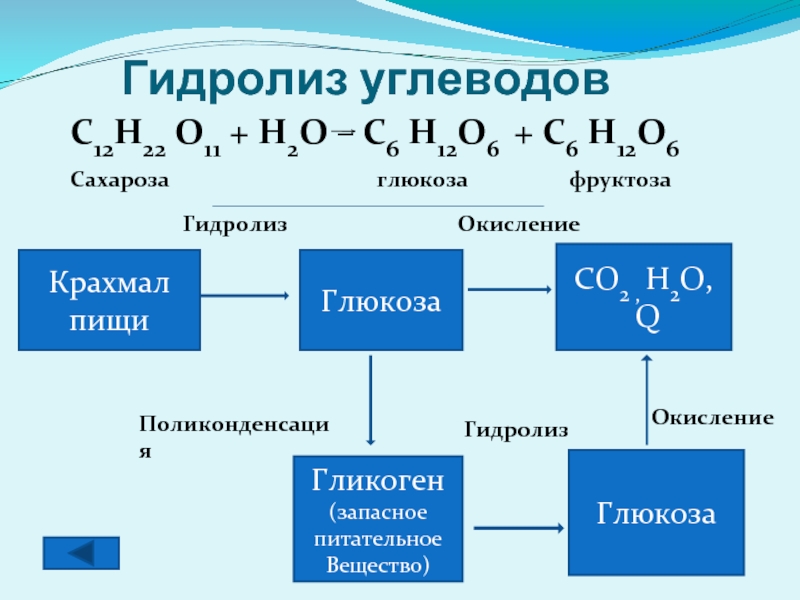
Гидролиз углеводов
Крахмал пищи
Глюкоза
CO2 , H2O,
Q
Гликоген
(запасное
питательное
Вещество)
Глюкоза
Гидролиз
Окисление
Поликонденсация
Гидролиз
Окисление
C12H22 O11 + H2O
Сахароза глюкоза фруктоза
Слайд 10Гидролиз белков
H2N – CH2 – C – N – CH – C – N – CH – COOH
CH2 CH2
OH OH трипептид
HO H HO H
O O O
H2N – CH2 – C + H2N – CH – C + H2N – CH – C
OH OH OH
CH2 CH2
OH SH
аминокислоты
Слайд 12Гидролиз солей
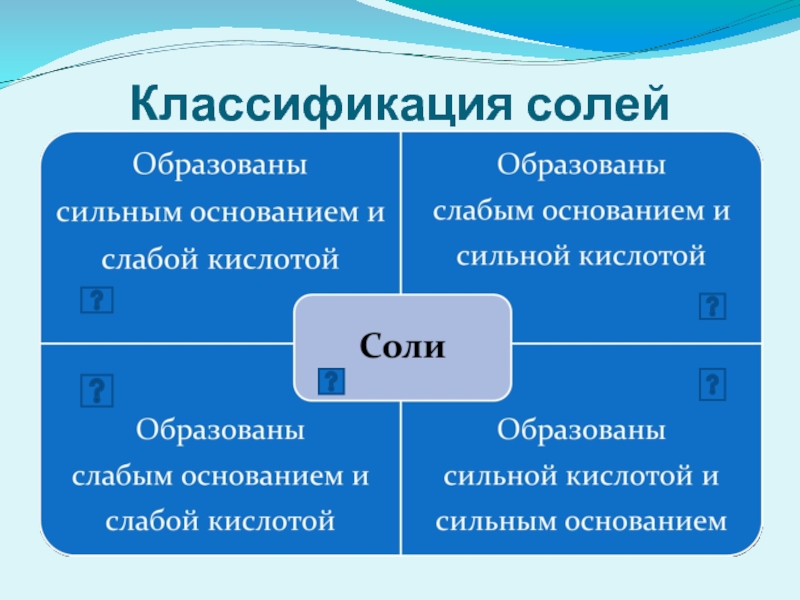
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов
Любая соль – это продукт взаимодействия основания с кислотой. В зависимости от силы основания и кислоты выделяют 4 типа солей.
Слайд 14Слабые кислоты:
HCOOH, CH3COOH, HCN, H2S, HF,
H2CO3, H2 SO3, H3PO4 , HNO2
Слабые основания:
основания (за исключением щелочей), NH4 OH
Слайд 15
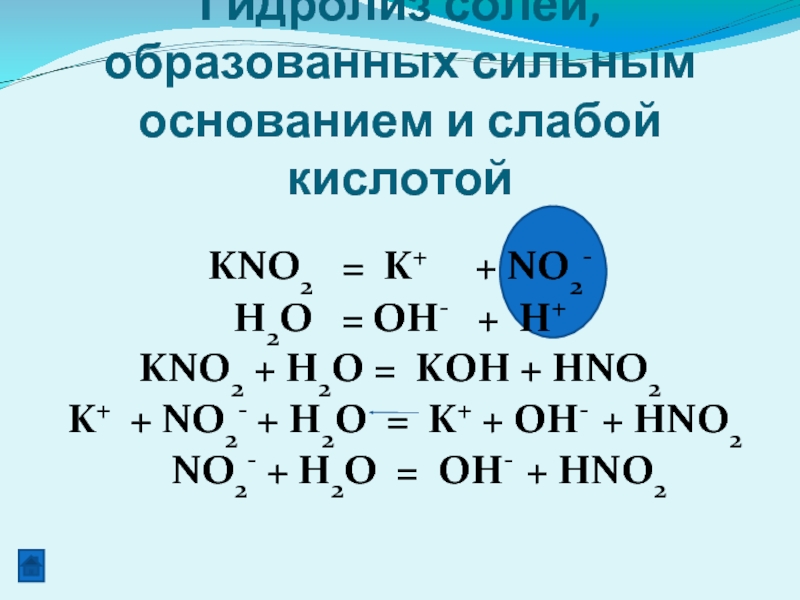
KNO2 = K+ + NO2-
H2O =
KNO2 + H2O = KOH + HNO2
K+ + NO2- + H2O = K+ + OH- + HNO2
NO2- + H2O = OH- + HNO2
Гидролиз солей, образованных сильным основанием и слабой кислотой
Слайд 16
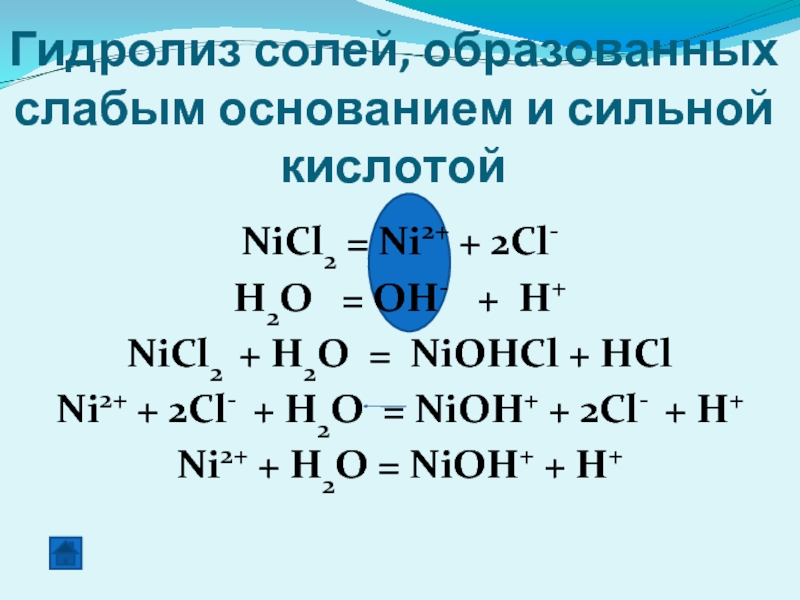
Гидролиз солей, образованных слабым основанием и сильной кислотой
NiCl2 = Ni2+
H2O = OH- + H+
NiCl2 + H2O = NiOHCl + HCl
Ni2+ + 2Cl- + H2O = NiOH+ + 2Cl- + H+
Ni2+ + H2O = NiOH+ + H+
Слайд 17
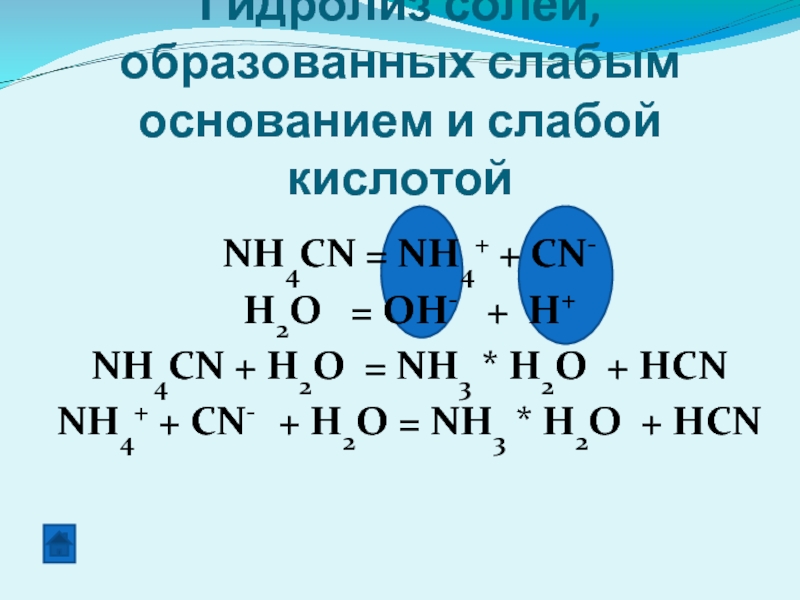
Гидролиз солей, образованных слабым основанием и слабой кислотой
NH4CN = NH4+
H2O = OH- + H+
NH4CN + H2O = NH3 * H2O + HCN
NH4+ + CN- + H2O = NH3 * H2O + HCN
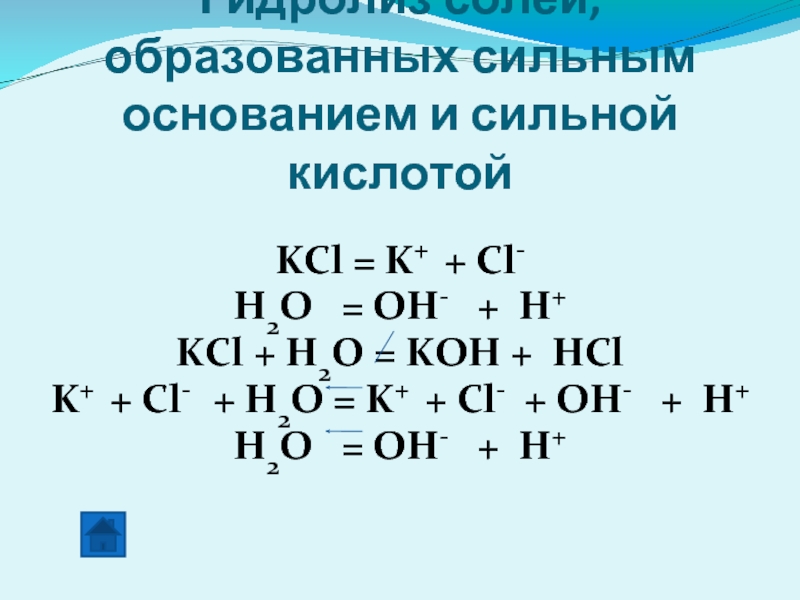
Слайд 18Гидролиз солей, образованных сильным основанием и сильной кислотой
KCl = K+
H2O = OH- + H+
KCl + H2O = KOH + HCl
K+ + Cl- + H2O = K+ + Cl- + OH- + H+
H2O = OH- + H+
Слайд 20Гидролиз неорганических соединений
Полному и необратимому гидролизу в водном
карбиды;
галогениды;
фосфиды;
нитриды
Слайд 21Гидролиз карбидов
CaC2 + 2H2O = Ca(OH)2 +C2 H2
Карбид кальция
Al4C3 + 12 H2O = 4 Al(OH)3 + 3 CH4
Карбид алюминия метан
Слайд 22Гидролиз галогенидов
SiCl4 + 3H2O = H2SiO4 + 4 HСl
кремния кислота
Гидролиз фосфидов
Mg3P2 + 6 H2O = 3Mg(OH)2 + 2PH3
Фосфид
магния