- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физика соли(Только в физике соль…) презентация
Содержание
- 1. Физика соли(Только в физике соль…)
- 2. Цель исследования: Рассмотреть физические свойства соли; Проделать опыты, в которых используется соль.
- 3. Физические свойства соли: Плотность, при 20
- 4. Как изменяется температура замерзания и кипения воды
- 5. Холодный снег. Оборудование и материалы: полчашки снега, поваренная соль, дощечка, термометр.
- 6. Выполнение опыта: 1. Наберите полчашки снега. (Если
- 7. 2. Положите немного снега на дощечку. Пусть он растает, превратившись в маленькую лужицу.
- 8. 3. Поставьте чашку на лужицу и измерьте
- 9. 4. Насыпьте ложку поваренной соли (NaCl) в снег и перемешайте.
- 10. 5. Измерьте температуру. Она резко понизится до минус 18ºС!
- 11. 6. Подождите 5 минут. Температура медленно будут расти, а вот дощечка примерзнет к чашке!
- 13. Вопросики: 1. Почему снег тает при 0ºС?
- 14. Что же происходило? В свойствах смесей
- 15. Соединим последовательно с электрической лампочкой
- 17. Проводимость жидкостей и газов
- 18. Из опыта следует вывод, что сухая соль
- 19. Архимедова сила
- 20. Выращивание кристаллов соли
- 21. Информационные ресурсы: http://www.fizika.ru/theory/tema-09/09f.htm http://phys-exp.livejournal.com/ http://www.optotl.ru/mat/NaCl
Слайд 2Цель исследования:
Рассмотреть физические свойства соли;
Проделать опыты, в которых используется соль.
Слайд 3Физические свойства соли:
Плотность, при 20 °С, г/см3- 2.17
Температура плавления,
ºС-801
Температура кипения- 1465 °C
Удельная теплоемкость, Дж/(кг • °С) при 24 ºС-870.9
Теплопроводность, Вт/(м • °С) при 35 ºС-6.15
Температурный коэффициент линейного расширения αt, °С-1 в интервале +/-60ºС-(36.4-40.8)• 10-6
Показатель преломления, n - 1.5467
Диэлектрическая проницаемость NaCl — 6,3
Температура кипения- 1465 °C
Удельная теплоемкость, Дж/(кг • °С) при 24 ºС-870.9
Теплопроводность, Вт/(м • °С) при 35 ºС-6.15
Температурный коэффициент линейного расширения αt, °С-1 в интервале +/-60ºС-(36.4-40.8)• 10-6
Показатель преломления, n - 1.5467
Диэлектрическая проницаемость NaCl — 6,3
Слайд 4Как изменяется температура замерзания и кипения воды при добавлении соли?
При растворении
соли в воде температура замерзания уменьшается, а температура кипения увеличивается.
К примеру, если растворить около 30 граммов соли в одном литре чистой воды, то температура замерзания понижается на 1,85 градуса Цельсия (то есть до -1,85 градуса), а температура кипения поднимается на 0,5 градуса (то есть до 100,5 градусов
Слайд 5Холодный снег. Оборудование и материалы: полчашки снега, поваренная соль, дощечка,
термометр.
Слайд 6Выполнение опыта:
1. Наберите полчашки снега. (Если нет на улице, заморозьте пластиковую бутыль
на 0,5л с водой в морозилке, а потом раскрошите лед ударами молотка.)
Слайд 83. Поставьте чашку на лужицу и измерьте температуру тающего снега. По
теории она должна быть 0ºС.
Слайд 13Вопросики:
1. Почему снег тает при 0ºС?
2. Почему резко понизилась температура смеси?
3.
Где можно применить данное явление?
Слайд 14Что же происходило? В свойствах смесей есть интересная закономерность: температура плавления смеси
нескольких веществ ниже, чем температура плавления каждого из чистых веществ по отдельности. Так для нашего случая, температура плавления чистой воды (в виде льда или снега) 0°С. Если внести в лед примесь поваренной соли, то лед начинает плавиться при более низких минусовых температурах. Температура плавления зависит от соотношения льда и соли, скорости перемешивания и даже степени измельчения льда.
Самая низкая температура замерзания данного раствора соли называется криогидратной температурой (точкой). Для раствора NaCl криогидратная температура минус 21,2°C при концентрации 23,1%.
Чтобы расплавить кристаллы льда нужно огромное количество энергии, которая берется из окружающей среды (помните, как замерзла лужица), из самой смеси. В итоге, температура смеси резко падает.
Применяют это явление в гололед. Посыпав лед, солью получаем пограничный слой, в котором смесь льда и соли начинает плавиться, потому что температура замерзания этого слоя ниже. В результате образуется пленка из водного раствора соли, что увеличивает площадь соприкосновения соли со льдом, пока весь лед не растопится, отобрав энергию у воздуха. Стоять на солевой каше холоднее, чем просто на льду, зато не скользко!
Еще это явление применяли в средние века для изготовления мороженного. Бочку со снегом и солью применяли, как морозильник.
Слайд 15 Соединим последовательно с электрической лампочкой сосуд, содержащий дистиллированную воду
и два металлических электрода, и включим их в осветительную сеть. Лампочка светиться не будет, так как дистиллированная вода практически не является проводником: в ней растворено лишь ничтожное количество примесей, а сами молекулы воды почти недиссоциированы. Бросим теперь в воду щепотку поваренной соли, то лампочка начинает светиться: водный раствор соли проводит электричество.
Водный раствор соли проводит электрический ток
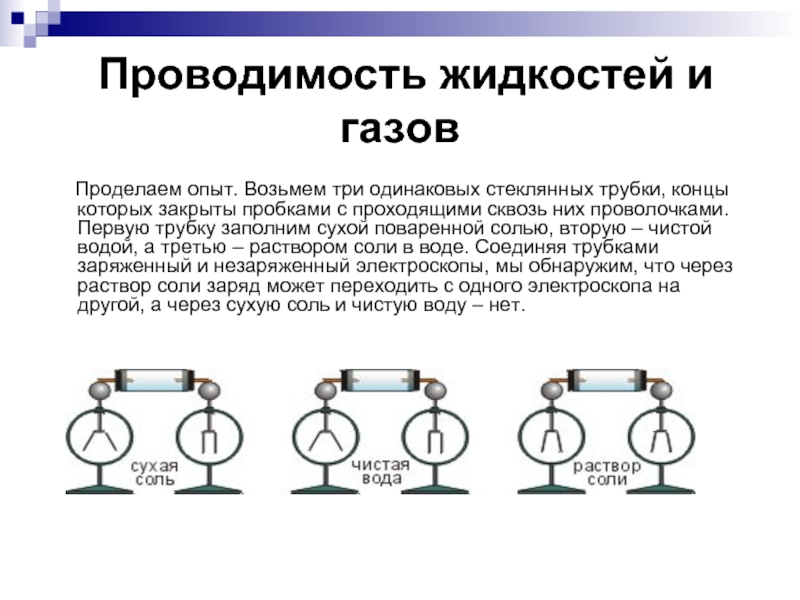
Слайд 17 Проводимость жидкостей и газов
Проделаем опыт. Возьмем
три одинаковых стеклянных трубки, концы которых закрыты пробками с проходящими сквозь них проволочками. Первую трубку заполним сухой поваренной солью, вторую – чистой водой, а третью – раствором соли в воде. Соединяя трубками заряженный и незаряженный электроскопы, мы обнаружим, что через раствор соли заряд может переходить с одного электроскопа на другой, а через сухую соль и чистую воду – нет.
Слайд 18Из опыта следует вывод, что сухая соль и чистая вода не
содержат свободных заряженных частиц. Однако при растворении соли в воде такие частицы образуются. Именно поэтому раствор соли является проводником электричества. Схема диссоциации соли:
NaCl→Na++ Cl–
Многочисленными опытами установлено, что при растворении или расплавлении многие вещества-диэлектрики становятся жидкими проводниками. Свободными (то есть подвижными) заряженными частицами в них являются положительные и отрицательные ионы. Как правило, они являются одно- или двухзарядными, то есть несут на себе один или два элементарных заряда.
NaCl→Na++ Cl–
Многочисленными опытами установлено, что при растворении или расплавлении многие вещества-диэлектрики становятся жидкими проводниками. Свободными (то есть подвижными) заряженными частицами в них являются положительные и отрицательные ионы. Как правило, они являются одно- или двухзарядными, то есть несут на себе один или два элементарных заряда.