- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ФИЗИЧЕСКАЯ ХИМИЯ презентация
Содержание
- 1. ФИЗИЧЕСКАЯ ХИМИЯ
- 2. Основные разделы курса Химическая термодинамика Фазовое равновесие Растворы Электрохимия Кинетика химических реакций Катализ
- 3. Электростатическая теория Позволила теоретически вычислить: Средний
- 4. Правила записи реакций на электродах при электролизе
- 5. Правила записи реакций на электродах при электролизе
- 6. Правила записи реакций на электродах при электролизе
- 7. Правила записи реакций на электродах при электролизе
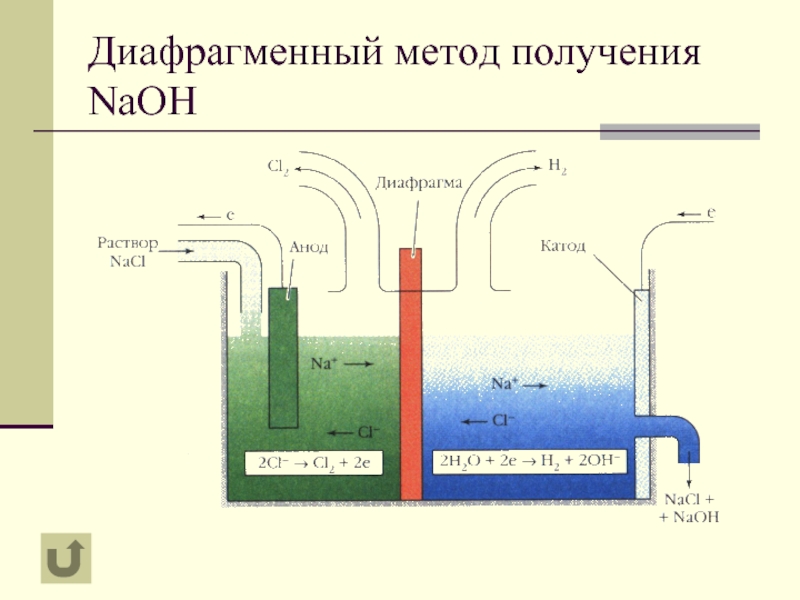
- 8. Диафрагменный метод получения NaOH
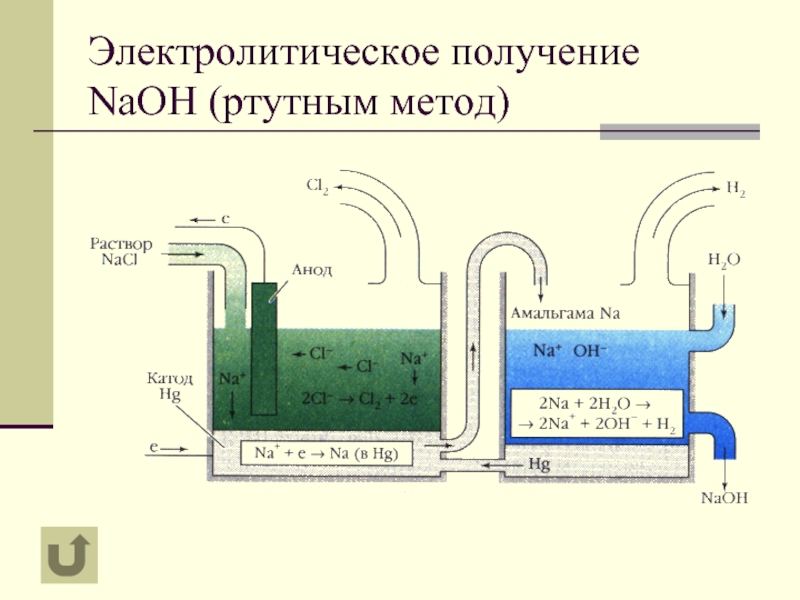
- 9. Электролитическое получение NaOH (ртутным метод)
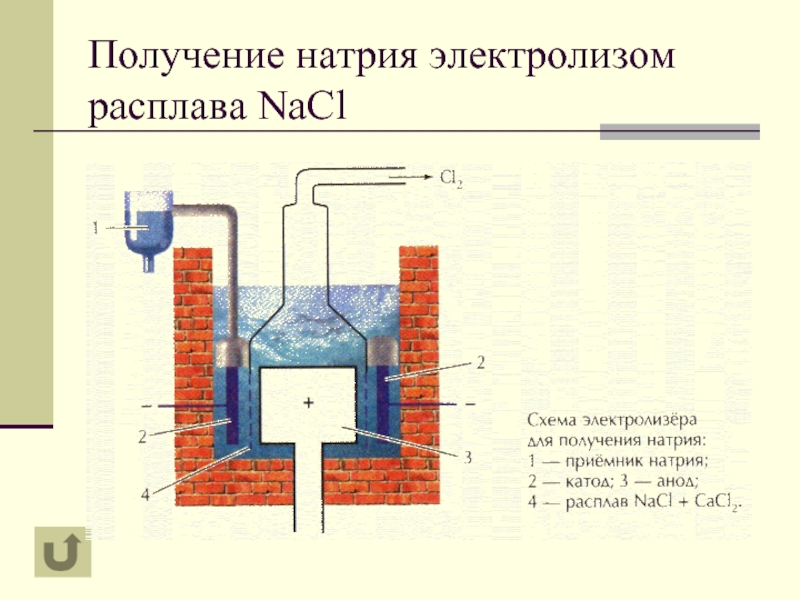
- 10. Получение натрия электролизом расплава NaCl
- 11. Типы электродов Первого рода Второго рода Газовые Амальгамные Окислительно-восстановительные
- 12. Электроды первого рода (неметаллические) Se2- | Se
- 13. Электроды первого рода (неметаллические) Br - | Br2 (ж) Br2 + 2е =2Br-
Слайд 2 Основные разделы курса
Химическая термодинамика
Фазовое равновесие
Растворы
Электрохимия
Кинетика химических реакций
Катализ
Слайд 3Электростатическая теория
Позволила теоретически вычислить:
Средний коэффициент активности сильных электролитов γ±.
Эквивалентную электрическую проводимость
сильных электролитов λ.
Теоретически обосновала правило ионной силы.
Теоретически обосновала правило ионной силы.
Слайд 4Правила записи реакций на электродах при электролизе
Записать все теоретически возможные реакции.
По величине электродного потенциала в ряду напряжения выбрать наиболее вероятную реакцию для данного электрода. Чем меньше электродный потенциал (по модулю!), тем вероятнее реакция.
Все кислоты на любом катоде разряжаются с выделением водорода
Все кислоты на любом катоде разряжаются с выделением водорода
2H+ + 2e = H2↑ φº =0 В
Слайд 5Правила записи реакций на электродах при электролизе
Щелочные и щелочно-земельные металлы
(Li,
Na, K, Rb, Cs, Mg, Ca, Sr, Ba)
на катоде не восстанавливаются из-за высокого своего потенциала (~ -2,7 В).
На катоде идет разряд воды.
2H2O +2e = H2 + 2OH-
φº= -0,828 B
на катоде не восстанавливаются из-за высокого своего потенциала (~ -2,7 В).
На катоде идет разряд воды.
2H2O +2e = H2 + 2OH-
φº= -0,828 B
Слайд 6Правила записи реакций на электродах при электролизе
Все кислородсодержащие анионы
(SO42-, NO3- и
др.) на аноде не разряжаются из-за высокого своего потенциала.
Идет разряд воды с выделением кислорода
2H2O – 4e = O2 + 4H+
φº =1,229 В
Идет разряд воды с выделением кислорода
2H2O – 4e = O2 + 4H+
φº =1,229 В
Слайд 7Правила записи реакций на электродах при электролизе
Аноды из растворимых металлов
(Cu, Ag,
Pb, Cd, Zn, Sn, Fe, Ni и др.)
в первую очередь участвуют в анодной реакции.
Zn – 2e → Zn2+ φº = – 0,763 B
Ag – e → Ag+ φº = 0,799 B
Cu – 2e → Cu2+ φº = – 0,763 B
в первую очередь участвуют в анодной реакции.
Zn – 2e → Zn2+ φº = – 0,763 B
Ag – e → Ag+ φº = 0,799 B
Cu – 2e → Cu2+ φº = – 0,763 B