- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ФЕНОЛ презентация
Содержание
- 1. ФЕНОЛ
- 2. Содержание Классификация Физические свойства Строение фенола Химические свойства Получение Источники информации
- 3. Классификация Фенолами называют гидроксильные производные бензола,
- 4. Физические свойства Фенол – бесцветное кристаллическое
- 5. Строение фенола Молекула фенола является классическим
- 6. Ослабление её настолько существенно, что в
- 7. Химические свойства I. По группе OH.
- 8. Фенол не вступает в реакции дегидратации, не
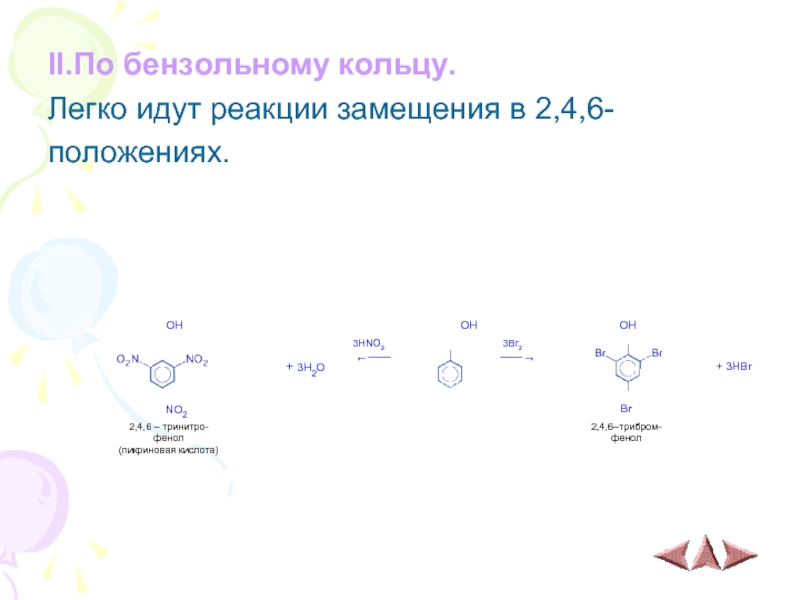
- 9. II.По бензольному кольцу. Легко идут реакции замещения в 2,4,6- положениях.
- 10. 4) Под действием бромной воды образуется осадок
- 11. 6) При гидрировании в присутствии катализаторов
- 12. 8) За счёт атомов водорода в 2,4,6-положениях
- 13. Получение Фенол в промышленности получают: 1) Сплавление
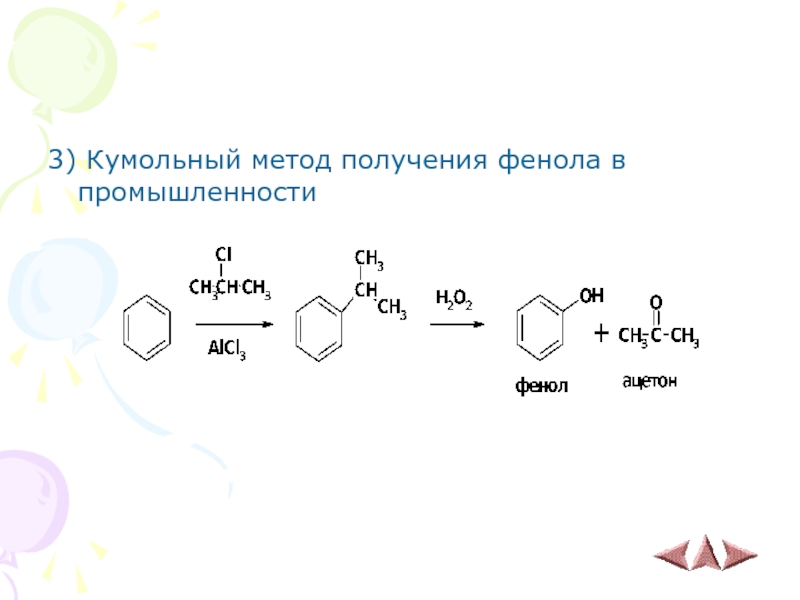
- 14. 3) Кумольный метод получения фенола в промышленности
- 15. Источники информации 1. Петров А.А., Бальян
- 16. 5. Оганесян Э.Т. Руководство по химии
- 17. 9. Штремплер Г.И. Тесты, вопросы и ответы
Содержание Классификация Физические свойства Строение фенола Химические свойства Получение Источники информации
Слайд 2Содержание
Классификация
Физические свойства
Строение фенола
Химические свойства
Получение
Источники информации
Слайд 3Классификация
Фенолами называют гидроксильные
производные бензола, в которых OH–группы
соединяются с бензольным
кольцом
непосредственно. По числу гидроксильных групп,
присоединенных к кольцу, фенолы
подразделяются на одно-, двух- и многоатомные.
OH OH OH
OH HO OH
гидроксибензол 1,3 – дигидроксибензол 1,3,5 –тригидроксибензол
фенол
непосредственно. По числу гидроксильных групп,
присоединенных к кольцу, фенолы
подразделяются на одно-, двух- и многоатомные.
OH OH OH
OH HO OH
гидроксибензол 1,3 – дигидроксибензол 1,3,5 –тригидроксибензол
фенол
Слайд 4Физические свойства
Фенол – бесцветное кристаллическое
легкоплавкое вещество, с резким характерным
запахом,
мало растворим в холодной воде.
Хорошо растворяется в органических
растворителях. Кристаллы фенола на воздухе
вследствие окисления розовеют. Фенол ядовит.
При попадании на кожу вызывает ожоги.
Хорошо растворяется в органических
растворителях. Кристаллы фенола на воздухе
вследствие окисления розовеют. Фенол ядовит.
При попадании на кожу вызывает ожоги.
Слайд 5Строение фенола
Молекула фенола является классическим
примером взаимного влияния атомов. Одна из
неподелённых пар кислорода сопрягается с π–
электронной системой бензольного кольца, в
результате чего она становится общей для вновь
образующейся при этом π–системы.
Оттягивание p–электронной пары от кислорода
приводит к появлению на нём электронного
дефицита (σ +). Чтобы компенсировать его,
кислород очень сильно (гораздо сильнее, чем в
спиртах) притягивает к себе пару связи O-H.
Слайд 6 Ослабление её настолько существенно, что в
растворе фенол может диссоциировать
с
образованием катиона водорода, т.е. вести
себя как типичная кислота.
C6H5–OH ↔ C6H5–O- + H+
Влияние OH–группы на реакционную
способность фенильного радикала состоит в
том, что она облегчает реакции замещения в
его орто- и пара-положениях (положения 2,4,6)
за счёт повышения здесь электронной
плотности.
образованием катиона водорода, т.е. вести
себя как типичная кислота.
C6H5–OH ↔ C6H5–O- + H+
Влияние OH–группы на реакционную
способность фенильного радикала состоит в
том, что она облегчает реакции замещения в
его орто- и пара-положениях (положения 2,4,6)
за счёт повышения здесь электронной
плотности.
Слайд 7Химические свойства
I. По группе OH.
1) с активными металлами
2C6H5OH + 2Na → 2C6H5ONa + H2↑
2) оксидами металлов
2C6H5OH + Na2O → 2C6H5ONa + H2O
3) щелочами.
C6H5OH + NaOH → C6H5ONa + H2O
фенолят натрия
Фенол слабая кислота, его можно
вытеснить из фенолятов оксидом углерода (IV).
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
2) оксидами металлов
2C6H5OH + Na2O → 2C6H5ONa + H2O
3) щелочами.
C6H5OH + NaOH → C6H5ONa + H2O
фенолят натрия
Фенол слабая кислота, его можно
вытеснить из фенолятов оксидом углерода (IV).
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
Слайд 8Фенол не вступает в реакции дегидратации, не взаимодействует с галогенпроизводными, спиртами,
кислотами, так как сопряжение делает более прочной связь C – O.
Слайд 104) Под действием бромной воды образуется осадок белого цвета со специфическим
запахом трибромфенола. Этой реакцией часто пользуются для качественного и количественного определения фенола.
5) Фенол без нагревания и без катализатора энергично взаимодействует с азотной кислотой, образуя пикриновую кислоту (2,4,6-тринитрофенол).
Бензол же с бромом и азотной кислотой взаимодействует лишь при нагревании и в присутствии катализаторов.
5) Фенол без нагревания и без катализатора энергично взаимодействует с азотной кислотой, образуя пикриновую кислоту (2,4,6-тринитрофенол).
Бензол же с бромом и азотной кислотой взаимодействует лишь при нагревании и в присутствии катализаторов.
Слайд 116) При гидрировании в присутствии
катализаторов фенол превращается в спирт
ряда
циклогексана.
Ni
С6H5OH + H2 → C6H11OH (циклогексанол)
7) Качественной реакцией на фенол является
взаимодействие с хлоридом железа (III),
появляется фиолетовое окрашивание из-за
образования комплексного соединения.
6C6H5OH + FeCl3 → H3[ Fe(C6H5O)6] + 3HCl
фиолетовый
Ni
С6H5OH + H2 → C6H11OH (циклогексанол)
7) Качественной реакцией на фенол является
взаимодействие с хлоридом железа (III),
появляется фиолетовое окрашивание из-за
образования комплексного соединения.
6C6H5OH + FeCl3 → H3[ Fe(C6H5O)6] + 3HCl
фиолетовый
Слайд 128) За счёт атомов водорода в 2,4,6-положениях фенол вступает в реакция
полимеризации с формальдегидом с образованием фенолформальдегидной пластмассы.
Слайд 13Получение
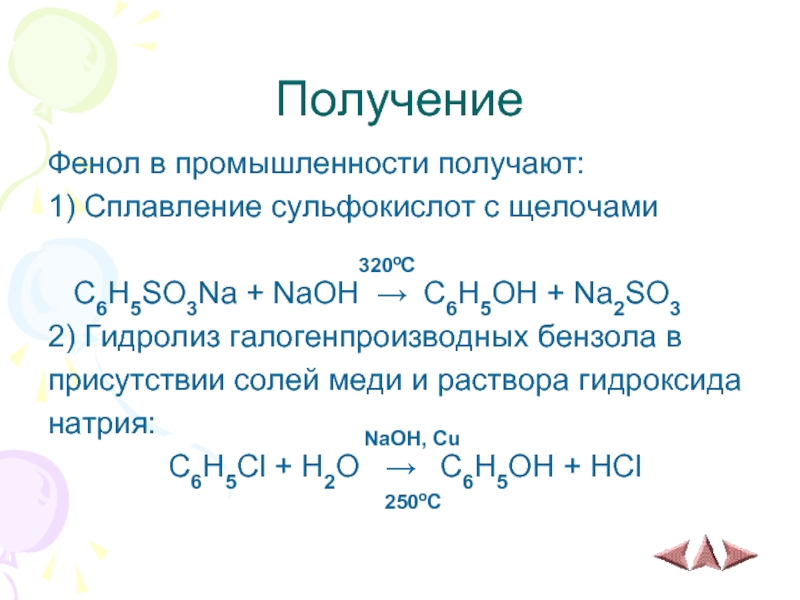
Фенол в промышленности получают:
1) Сплавление сульфокислот с щелочами
320ºC
C6H5SO3Na + NaOH → C6H5OH + Na2SO3
2) Гидролиз галогенпроизводных бензола в
присутствии солей меди и раствора гидроксида
натрия: NaOH, Cu
C6H5Cl + H2O → C6H5OH + HCl
250ºC
C6H5SO3Na + NaOH → C6H5OH + Na2SO3
2) Гидролиз галогенпроизводных бензола в
присутствии солей меди и раствора гидроксида
натрия: NaOH, Cu
C6H5Cl + H2O → C6H5OH + HCl
250ºC
Слайд 15Источники информации
1. Петров А.А., Бальян Х.В., Трощенко А.Т.
Органическая химия. Учебник
для вузов./ Под
ред. Петрова А.А. – М.: Высшая школа, 1981.
2. Хомченко Г.П. Пособие по химии для
поступающих в вузы. – М.: ООО «Издательство
Новая Волна», 2002.
3. Курмашева К.К. Химия в таблицах и схемах.
Серия «Школа в клеточку». – М.: «Лист», 1997.
4. Потапов В.М., Чертков И.Н. Строение и
свойства органических веществ. Пособие для
учащихся 10 кл. – М.: Просвещение, 1980.
ред. Петрова А.А. – М.: Высшая школа, 1981.
2. Хомченко Г.П. Пособие по химии для
поступающих в вузы. – М.: ООО «Издательство
Новая Волна», 2002.
3. Курмашева К.К. Химия в таблицах и схемах.
Серия «Школа в клеточку». – М.: «Лист», 1997.
4. Потапов В.М., Чертков И.Н. Строение и
свойства органических веществ. Пособие для
учащихся 10 кл. – М.: Просвещение, 1980.
Слайд 16 5. Оганесян Э.Т. Руководство по химии
поступающим в вузы. Справочное пособие.
М.:
Высшая школа,1991.
6. Иванова Р.Г., Осокина Г.Н. Изучение
химии в 9-10 классах. Книга для учителя. – М.:
Просвещение, 1983.
7. Денисов В.Г. Химия. 10 класс. Поурочные
планы. – Волгоград: Учитель, 2004.
8. Аргишева А.И., Задумина Э.А. Химия:
Подготовка к государственному
централизованному тестированию. – Саратов:
Лицей, 2002.
Высшая школа,1991.
6. Иванова Р.Г., Осокина Г.Н. Изучение
химии в 9-10 классах. Книга для учителя. – М.:
Просвещение, 1983.
7. Денисов В.Г. Химия. 10 класс. Поурочные
планы. – Волгоград: Учитель, 2004.
8. Аргишева А.И., Задумина Э.А. Химия:
Подготовка к государственному
централизованному тестированию. – Саратов:
Лицей, 2002.
Слайд 17 9. Штремплер Г.И. Тесты, вопросы и ответы по химии: Книга для
учащихся 8-11 классов общеобразовательных учреждений. – М.: Просвещение, 1999.
10. Малыхин З.В. Тестовые задания для проверки знаний учащихся по органической химии. – М.: ТЦ «Сфера», 2001.
11. Городничева И.Н. Контрольные и проверочные работы по химии. 8-11 класс. – М.: Аквариум, 1997.
12. Гаврусейко Н.П. Проверочные работы по органической химии: Дидактический материал: Пособие для учителя. – М.: Просвещение, 1991.
10. Малыхин З.В. Тестовые задания для проверки знаний учащихся по органической химии. – М.: ТЦ «Сфера», 2001.
11. Городничева И.Н. Контрольные и проверочные работы по химии. 8-11 класс. – М.: Аквариум, 1997.
12. Гаврусейко Н.П. Проверочные работы по органической химии: Дидактический материал: Пособие для учителя. – М.: Просвещение, 1991.