- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Энтальпия. Тепловой эффект химической реакции презентация
Содержание
- 1. Энтальпия. Тепловой эффект химической реакции
- 2. Термодинамика Наука о взаимных превращениях различных видов
- 3. При химических реакциях происходят глубокие качественные
- 4. При химических реакциях происходят глубокие качественные
- 5. При любом процессе соблюдается закон
- 6. Внутренняя энергия системы U – это
- 7. Изохорный процесс При химических реакциях А –
- 8. Изобарный процесс (p-const) теплота Qp = ΔU
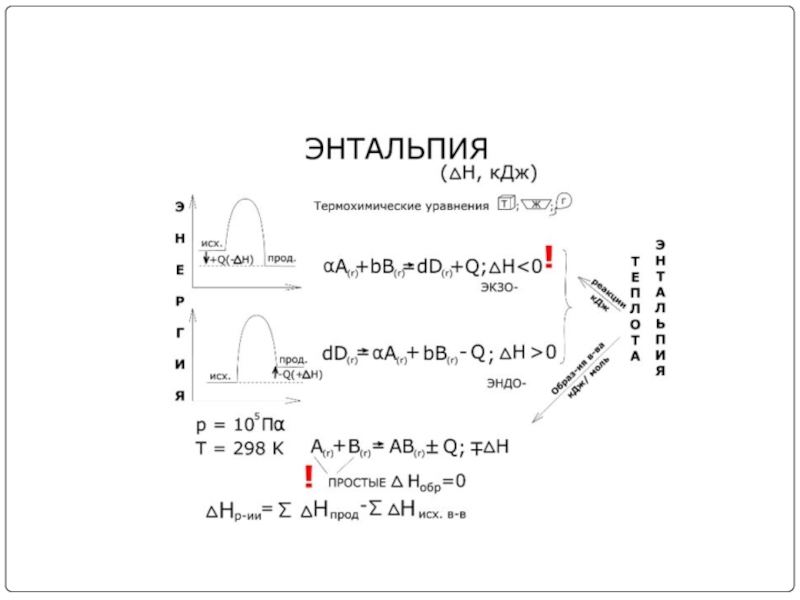
- 9. Величину Н называют энтальпией. Таким образом,
- 10. Энтальпия, как и внутренняя энергия, является
- 11. Теплоты химических процессов, протекающих при p, T=const
- 12. Если тепловой эффект реакции Q измерен
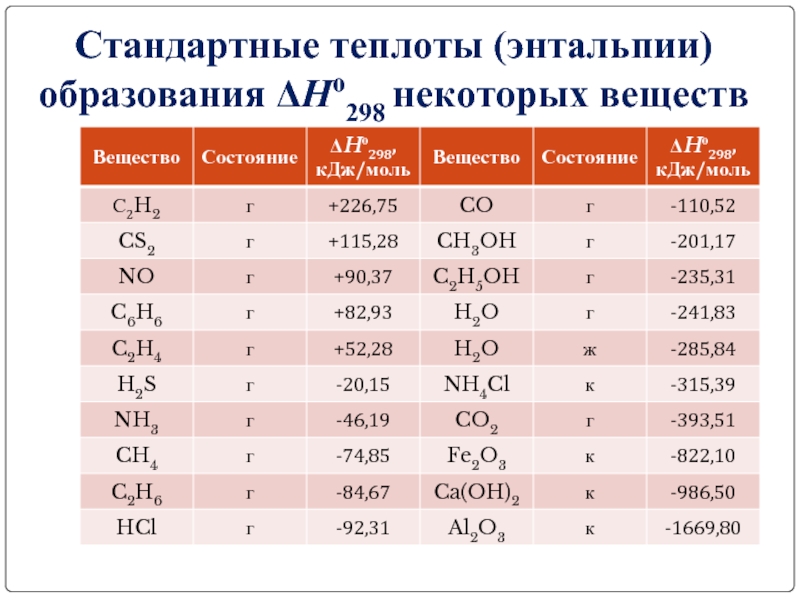
- 13. Стандартные теплоты (энтальпии) образования ΔHо298 некоторых веществ
- 14. Часто в термохимических расчетах применяют следствие
- 16. Энтальпии очень многих реакций найдены экспериментально,
- 17. Энтальпией образования вещества fH называется энтальпия реакции
- 18. Рассмотрим ряд реакций, в которых может получиться
Слайд 1Урок химии в 11 классе
Учитель: Герасименко Е.В.
Энтальпия.
Тепловой эффект химической реакции
*
Слайд 2Термодинамика
Наука о взаимных превращениях различных видов энергии.
Термодинамика устанавливает законы этих
Слайд 3
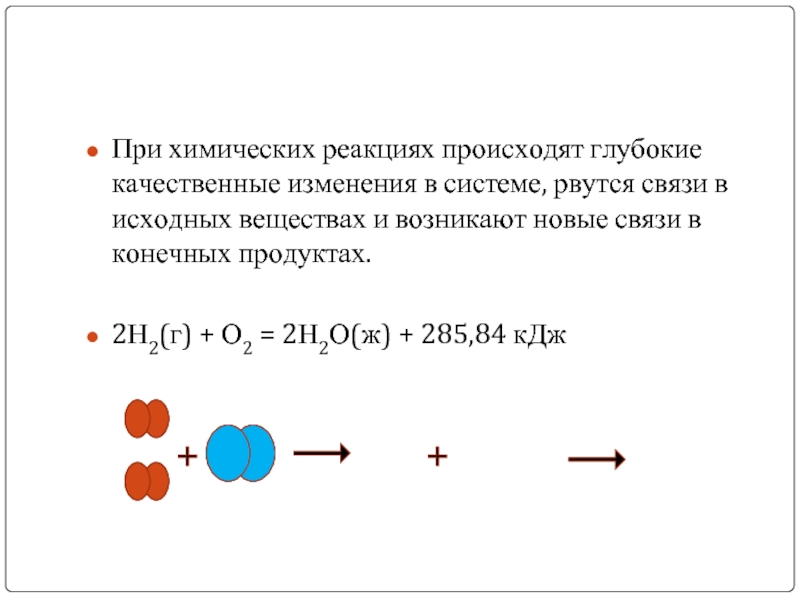
При химических реакциях происходят глубокие качественные изменения в системе, рвутся связи
Слайд 4
При химических реакциях происходят глубокие качественные изменения в системе, рвутся связи
2Н2(г) + О2 = 2Н2О(ж) + 285,84 кДж
Слайд 5
При любом процессе соблюдается закон сохранения энергии как проявление более общего
Q = ΔU + A
Слайд 6
Внутренняя энергия системы U – это общий ее запас, включающий энергию
Слайд 7Изохорный процесс
При химических реакциях А – это работа против внешнего давления,
где ΔV – изменение объема системы (V2 – V1).
При изохорном процессе (V-const):
(V2 – V1)=0, тогда А=0; теплота
QV = ΔU + 0,
QV = (U2 – U1) = ΔU
Слайд 8Изобарный процесс
(p-const) теплота
Qp = ΔU + pΔV,
Qp = (U2 – U1)
Qp = (U2 + pV2) – (U1 + pV1).
Сумма U + pV обозначим через Н, тогда:
Qp = Н2 – Н1 = ΔН.
Слайд 9
Величину Н называют энтальпией. Таким образом, теплота при p=const и T=const
Qp = ΔН.
Слайд 10
Энтальпия, как и внутренняя энергия, является функцией состояния; ее изменение (ΔН)
QV = ΔU
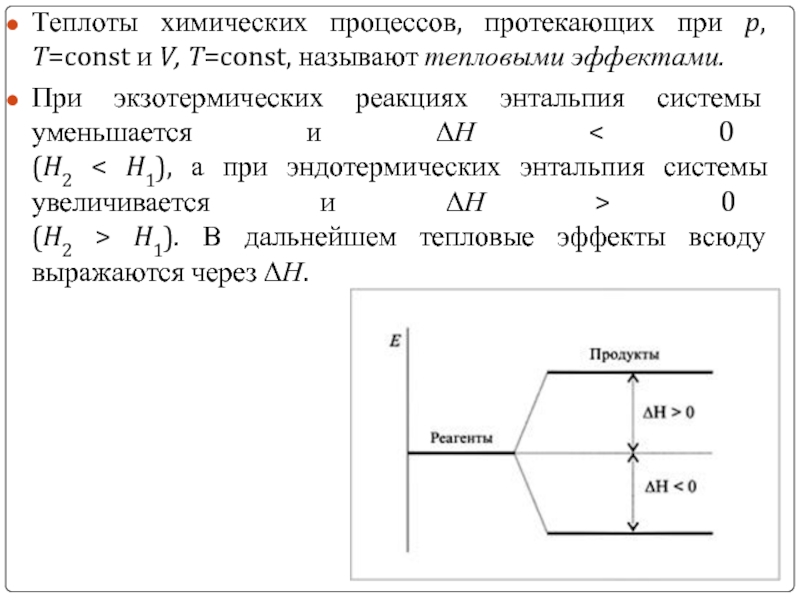
Слайд 11Теплоты химических процессов, протекающих при p, T=const и V, T=const, называют
При экзотермических реакциях энтальпия системы уменьшается и ΔН < 0 (H2 < H1), а при эндотермических энтальпия системы увеличивается и ΔН > 0 (H2 > H1). В дальнейшем тепловые эффекты всюду выражаются через ΔН.
Слайд 12
Если тепловой эффект реакции Q измерен при постоянном давлении (а это
Слайд 14
Часто в термохимических расчетах применяют следствие из закона Гесса: тепловой эффект
Слайд 16
Энтальпии очень многих реакций найдены экспериментально, часто с использованием калориметров. Однако
Слайд 17Энтальпией образования вещества fH называется энтальпия реакции образования 1 моль этого
Слайд 18Рассмотрим ряд реакций, в которых может получиться карбонат кальция. Энтальпия какой
1) Ca(OH)2 + CO2 = CaCO3 + H2O;
2) CaO + CO2 = CaCO3;
3) 2Ca + O2 + 2CO2 = 2CaCO3;
4) Ca + 3O + С = CaCO3;
5) 2Ca + 3O2 + 2С = 2CaCO3;
6) Ca + 3/2O2 + С = CaCO3.
Энтальпии образования некоторых веществ при 298 К
В реакциях 1, 2 и 3 принимают участие не только простые вещества. В реакции 4 кислород — не простое вещество, а находится в атомарном состоянии. В реакции 5 образуется не 1 моль карбоната. Таким образом, нашему определению соответствует только реакция 6.