- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электронное строение атомов элементов презентация
Содержание
- 1. Электронное строение атомов элементов
- 2. Повторение Число электронов в атоме элемента =
- 3. Повторение Число электронов в наружном слое атомов
- 4. Распределение электронов по уровням N=2n2 формула для
- 5. Распределение электронов по уровням 1 уровень: 2ē
- 6. Распределение электронов по уровням 1 уровень: 2ē 2 уровень:8ē
- 7. Распределение электронов по уровням 1 уровень-2 2 уровень-8 3 уровень-18
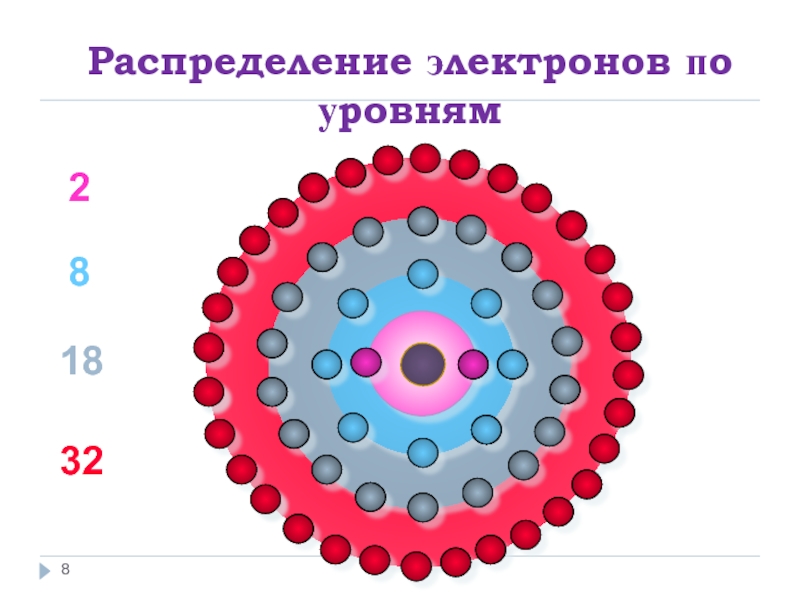
- 8. Распределение электронов по уровням 2 8 18 32
- 9. s- электронное облако Форма s-электронного облака - шар. На нем 1-2 электрона.
- 10. p- электронное облако Форма p-электронного облака -
- 11. d- электронное облако Форма d-электронных облаков -
- 12. f- электронное облако Форма f-электронных облаков сложная
- 13. Атом водорода Электрон этого атома при вращении
- 14. Атом гелия +2 Не )2 это
- 15. Атом лития +3 Li )2)1 это схема
- 16. Атом бериллия +4 Be )2 )2 это
- 17. Атом углерода +6 С ) 2 )
- 18. Атом хлора +17 Cl )2 )8 )7
- 19. Заключение Существуют s, p, d, f электроны.
- 20. Домашнее задание Выучить параграф 8. Ответить на
Слайд 2Повторение
Число электронов в атоме элемента = числу протонов = заряду ядра
атома = порядковому номеру элемента.
Электроны в атомах располагаются слоями; число слоёв (энергетических уровней) = номеру периода, в котором находится элемент.
Электроны в атомах располагаются слоями; число слоёв (энергетических уровней) = номеру периода, в котором находится элемент.
Слайд 3Повторение
Число электронов в наружном слое атомов элементов = номеру группы, в
котором находится элемент. (Для элементов главных подгрупп)
Электроны движутся вокруг ядра с огромной скоростью по орбиталям. Часть пространства, где наиболее вероятно нахождение электрона, называют электронным облаком.
Электроны движутся вокруг ядра с огромной скоростью по орбиталям. Часть пространства, где наиболее вероятно нахождение электрона, называют электронным облаком.
Слайд 4Распределение электронов по уровням
N=2n2 формула для вычисления количества электронов на энергетических
уровнях.
1Й уровень - 2 электрона.
2Й уровень - 8 электронов.
3Й уровень - 18 электронов.
4Й уровень - 32 электрона.
1Й уровень - 2 электрона.
2Й уровень - 8 электронов.
3Й уровень - 18 электронов.
4Й уровень - 32 электрона.
Слайд 10p- электронное облако
Форма p-электронного облака - объёмная восьмёрка. На нем от
1 до 6 электронов.
Слайд 11d- электронное облако
Форма d-электронных облаков - две объемные восьмёрки. На нем
от 1 до 10 электронов.
Слайд 12f- электронное облако
Форма f-электронных облаков сложная и в школьных учебниках не
приводится. На них от 1 до 14 электронов.
Слайд 13Атом водорода
Электрон этого атома при вращении образует сферическое облако.
+1 Н )1
это схема строения атома. Здесь на первом месте - заряд ядра, на втором месте - химическое обозначение, далее - одна орбиталь и электроны на ней.
1s1 это электронная формула атома.
1s1 это электронная формула атома.
Слайд 14Атом гелия
+2 Не )2 это схема строения атома.
1s2 это электронная
формула атома.
Здесь два s-электрона. Облака их одинаковой формы и при совмещении образуют общее двухэлектронное облако.
Про такие электроны говорят, что они спарены.
Здесь два s-электрона. Облака их одинаковой формы и при совмещении образуют общее двухэлектронное облако.
Про такие электроны говорят, что они спарены.
Слайд 15Атом лития
+3 Li )2)1 это схема строения атома.
1s2 2s1 это электронная
формула.
Элемент располагается во втором периоде, имеет два электронных слоя.
Элемент располагается во втором периоде, имеет два электронных слоя.
Слайд 16Атом бериллия
+4 Be )2 )2 это схема строения атома.
1s2 2s2
это электронная формула.
В этом атоме имеется два спаренных s-электрона во внутреннем слое и два спаренных s-электрона в наружном.
В этом атоме имеется два спаренных s-электрона во внутреннем слое и два спаренных s-электрона в наружном.
Слайд 17Атом углерода
+6 С ) 2 ) 4 схема строения атома.
1s2 2s
2 2p2 электронная формула.
В обычном состоянии атом углерода двухвалентен.
1s2 2s 1 2p3
В возбужденном состоянии (получил дополнительное количество энергии) атом углерода четырёхвалентен.
В обычном состоянии атом углерода двухвалентен.
1s2 2s 1 2p3
В возбужденном состоянии (получил дополнительное количество энергии) атом углерода четырёхвалентен.
Слайд 18Атом хлора
+17 Cl )2 )8 )7 схема строения атома.
1s2 2s2 2p6
3s2 3p5 это электронная формула.
Атом располагается в III периоде, и имеет три энергетических уровня.
Атом располагается в VII группе, главной подгруппе - на внешнем энергетическом уровне 7 электронов.
Атом располагается в III периоде, и имеет три энергетических уровня.
Атом располагается в VII группе, главной подгруппе - на внешнем энергетическом уровне 7 электронов.
Слайд 19Заключение
Существуют s, p, d, f электроны.
Электроны располагаются вокруг ядра слоями
(уровнями).
Электроны распределяются по уровням 2, 8, 18, 32.
Электроны распределяются по уровням 2, 8, 18, 32.
Слайд 20Домашнее задание
Выучить параграф 8.
Ответить на вопросы 1 и 2.
Если есть большое
желание получить хорошую оценку, то необходимо выполнить упражнения 3 и 4.