- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролитическая диссоциация презентация
Содержание
- 1. Электролитическая диссоциация
- 2. Электролитическая диссоциация - это процесс распада электролита на ионы в растворе или расплаве
- 3. ОПЫТЫ МАЙКЛА ФАРАДЕЯ Разложение веществ под действием
- 4. ЭЛЕКТРОЛИТЫ – вещества водные растворы
- 5. НЕЭЛЕКТРОЛИТЫ – вещества водные растворы
- 6. ФИЗИЧЕСКАЯ ТЕОРИЯ СВАНТЕ АРРЕНИУСА Шведский физико-химик
- 7. ФИЗИЧЕСКАЯ ТЕОРИЯ СВАНТЕ АРРЕНИУСА 1. Не представлял
- 8. 1 моль HCl «разбросать» на
- 9. ХИМИЧЕСКАЯ ТЕОРИЯ ДМИТРИЯ МЕНДЕЛЕЕВА Химическое взаимодействие
- 10. ХИМИЧЕСКАЯ ТЕОРИЯ ДМИТРИЯ МЕНДЕЛЕЕВА H+ + aH2O
- 11. ХИМИЧЕСКАЯ ТЕОРИЯ ДМИТРИЯ МЕНДЕЛЕЕВА Na+ + aH2O
- 12. ФИЗИКО – ХИМИЧЕСКАЯ ТЕОРИЯ И.А. КАБЛУКОВА
- 13. Классификация ионов По заряду: -) Катионы (+):
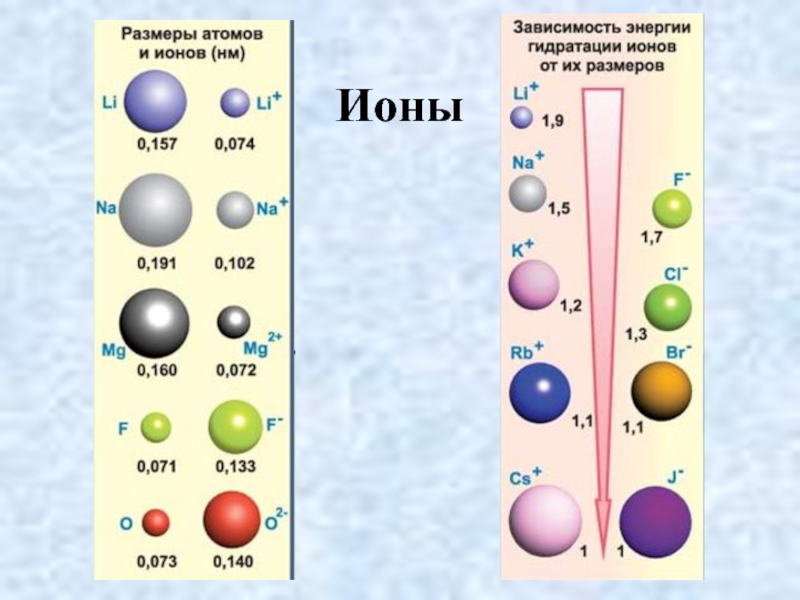
- 14. Ионы
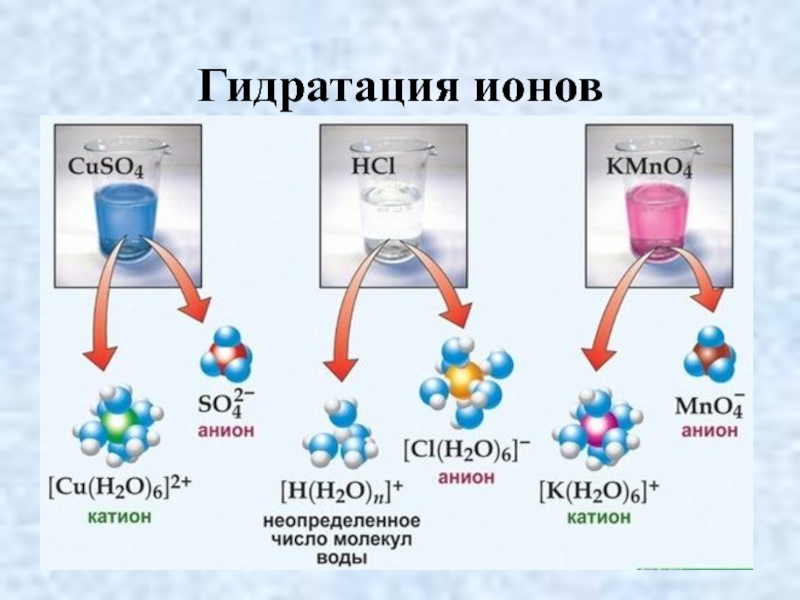
- 15. Гидратация ионов
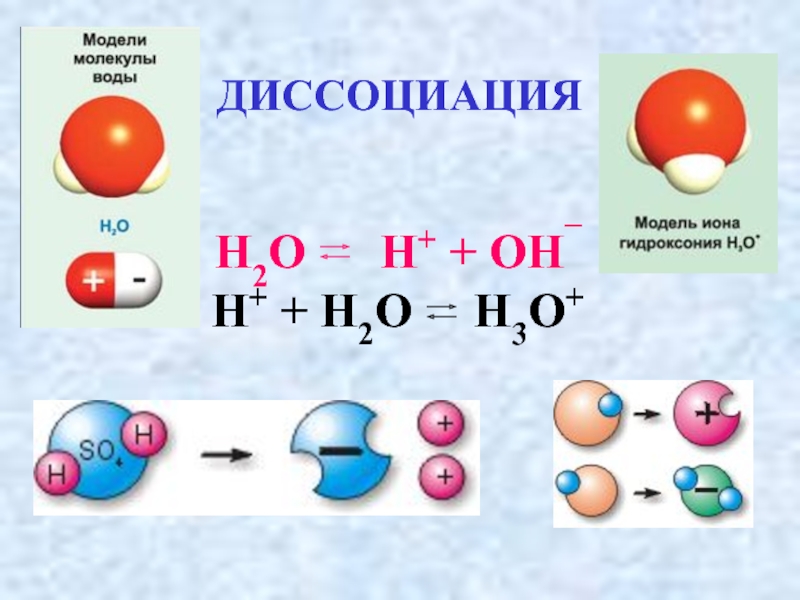
- 16. ДИССОЦИАЦИЯ Н2О Н+ + ОН¯
- 17. Электролитами могут быть только вещества с ионной или ковалентной полярной связью
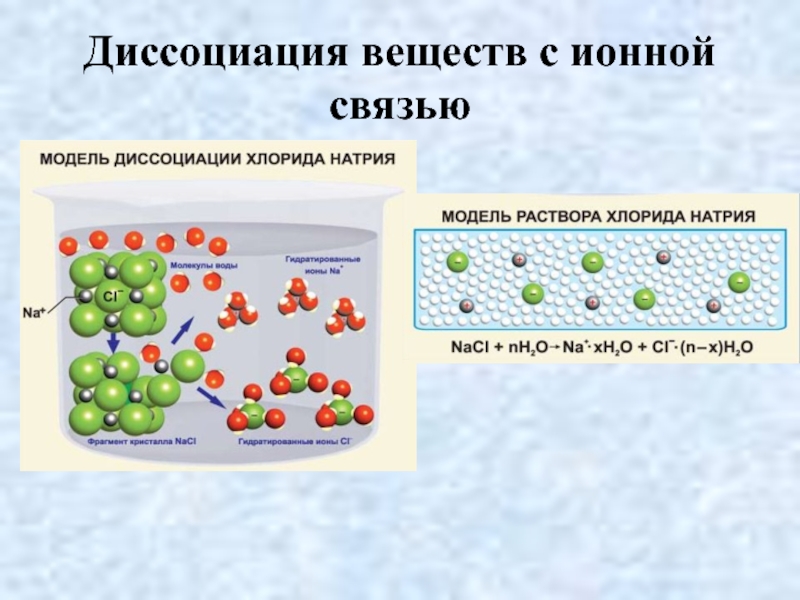
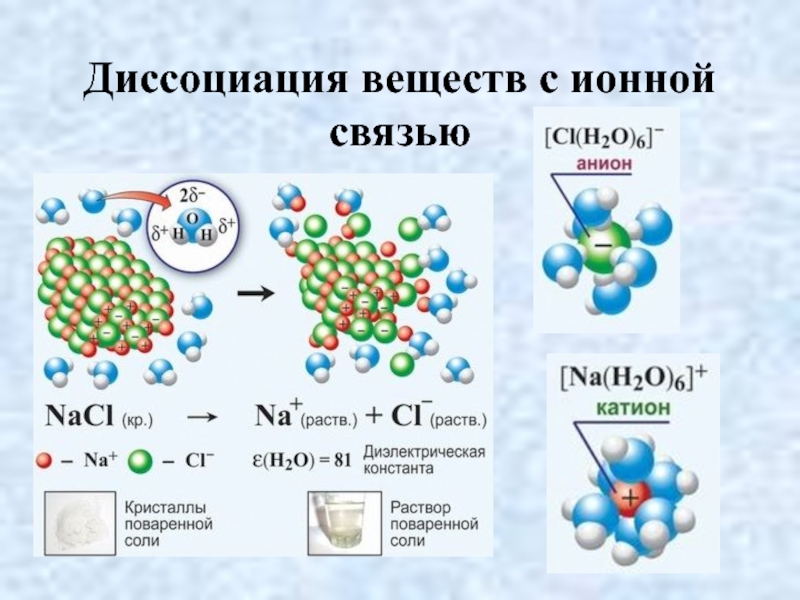
- 18. Диссоциация веществ с ионной связью
- 19. Диссоциация веществ с ионной связью
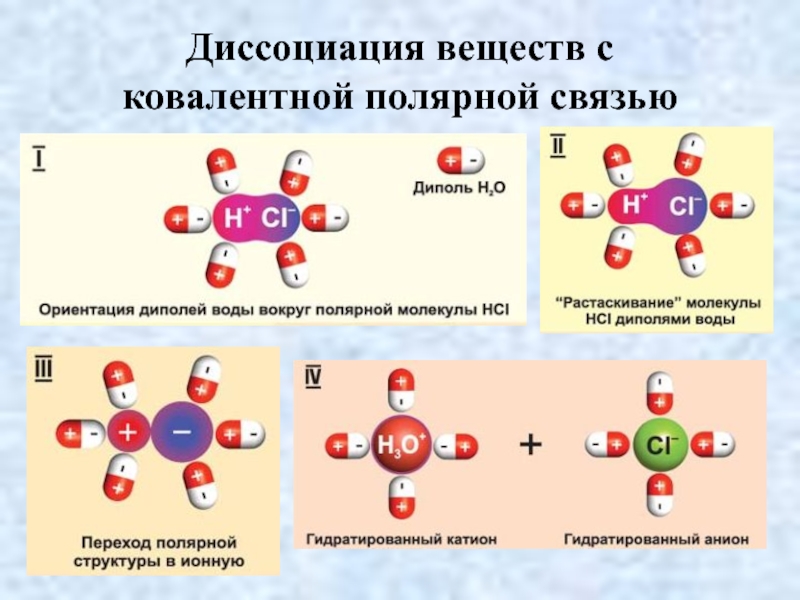
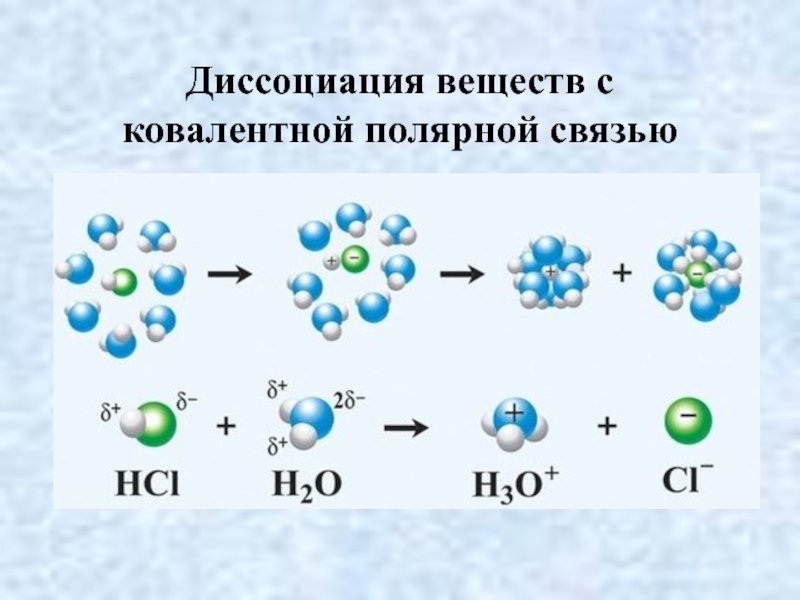
- 20. Диссоциация веществ с ковалентной полярной связью
- 21. Диссоциация веществ с ковалентной полярной связью
- 22. Степень электролитической диссоциации Отношение числа молекул электролита,
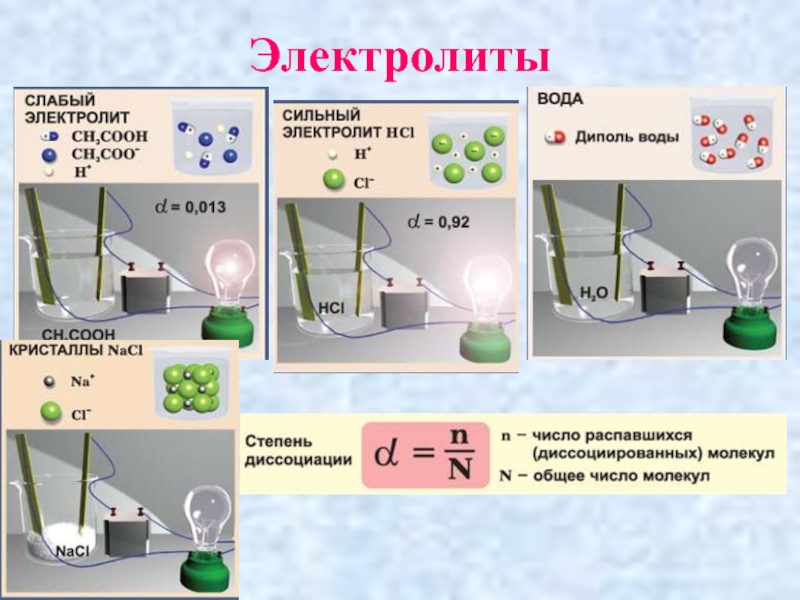
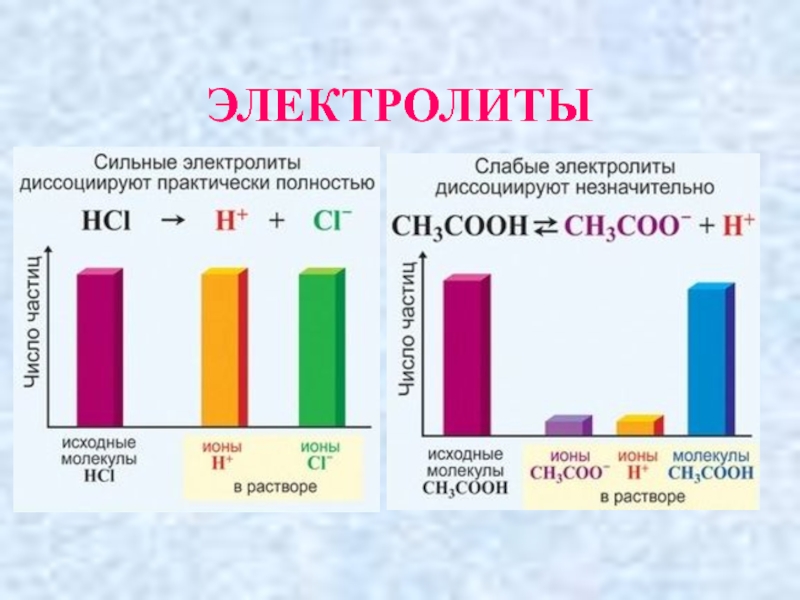
- 23. ЭЛЕКТРОЛИТЫ:
- 24. Электролиты
- 25. ЭЛЕКТРОЛИТЫ
- 26. КОНСТАНТА ДИССОЦИАЦИИ Константа равновесия характеризующая процесс диссоциации
- 27. СТУПЕНЧАТАЯ ДИССОЦИАЦИЯ H3PO4 I ступень: H3PO4
- 28. СТУПЕНЧАТАЯ ДИССОЦИАЦИЯ H3PO4
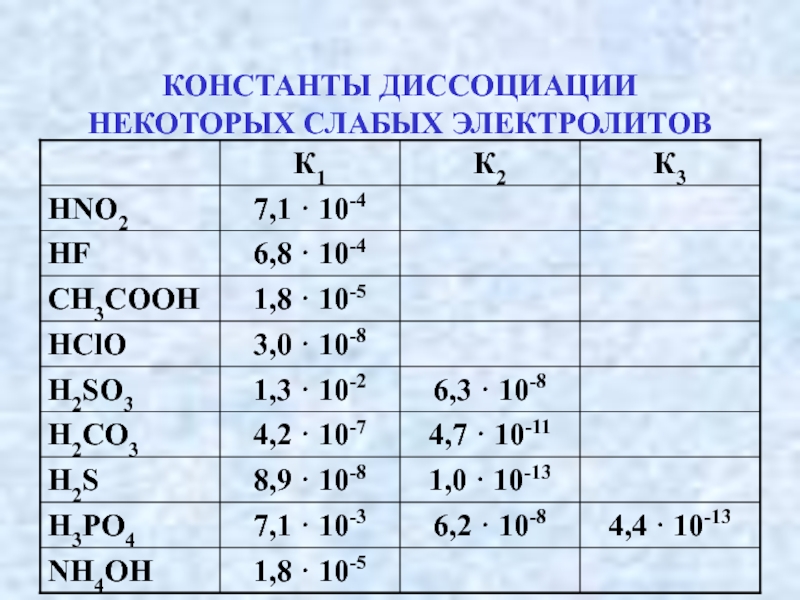
- 29. КОНСТАНТЫ ДИССОЦИАЦИИ НЕКОТОРЫХ СЛАБЫХ ЭЛЕКТРОЛИТОВ
- 30. ДИССОЦИАЦИЯ ВОДЫ 2H2O H3O+ +
- 31. ТИП СРЕДЫ [H+] = [OH¯] –
- 32. pH – водородный показатель ОТРИЦАТЕЛЬНЫЙ ДЕСЯТИЧНЫЙ
- 33. рОН – гидроксильный показатель ОТРИЦАТЕЛЬНЫЙ ДЕСЯТИЧНЫЙ ЛОГАРИФМ КОНЦЕНТРАЦИИ ГИДРОКСИД ИОНОВ
- 34. pH + pOH = 14
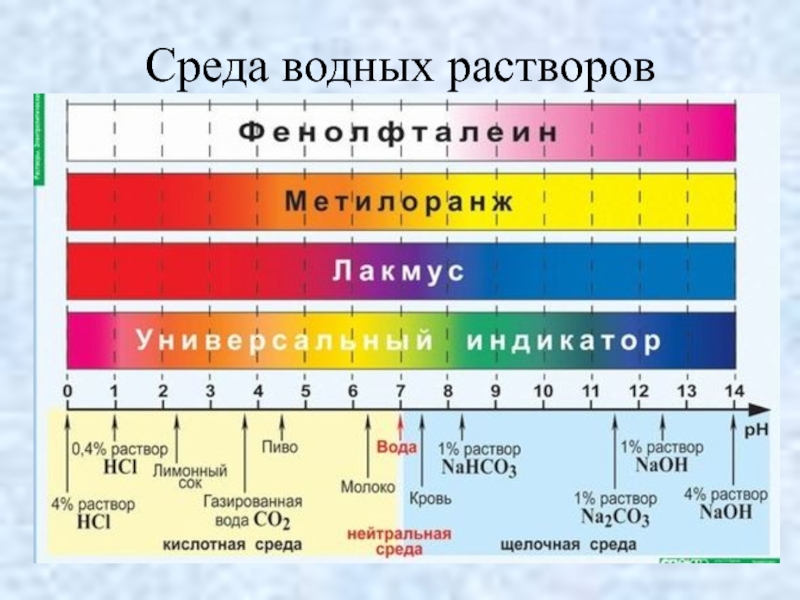
- 35. Среда водных растворов
- 40. Домашнее задание Параграф 15, №1-4
Слайд 2Электролитическая диссоциация
- это процесс распада электролита на ионы в растворе или
расплаве
Слайд 3ОПЫТЫ МАЙКЛА ФАРАДЕЯ
Разложение веществ под действием электрического тока
Ввел понятия:
Электролиз;
Электрод;
Катод;
Анод;
Ион.
Слайд 4ЭЛЕКТРОЛИТЫ – вещества водные растворы или расплавы которых проводят электрический ток, примеры:
соли, кислоты, основания
Слайд 5НЕЭЛЕКТРОЛИТЫ – вещества водные растворы или расплавы которых не проводят электрический
ток,
примеры:
простые вещества, органические вещества
Слайд 6ФИЗИЧЕСКАЯ ТЕОРИЯ СВАНТЕ АРРЕНИУСА
Шведский физико-химик – 1887 год
Электролиты распадаются на ионы
в момент растворения их в воде
Слайд 7ФИЗИЧЕСКАЯ ТЕОРИЯ СВАНТЕ АРРЕНИУСА
1. Не представлял откуда берётся энергия, необходимая для
разрыва молекул или кристаллов электролитов на ионы;
2. Почему при растворении в воде веществ выделяется или поглощается теплота?
3. Растворитель – вода – инертная среда не вступающая во взаимодействие с ионами!
2. Почему при растворении в воде веществ выделяется или поглощается теплота?
3. Растворитель – вода – инертная среда не вступающая во взаимодействие с ионами!
Слайд 81 моль HCl «разбросать» на ионы потребуется 1377 кДж энергии
1 моль NaCl
подобная операция требует
750 кДж энергии
Слайд 9ХИМИЧЕСКАЯ ТЕОРИЯ ДМИТРИЯ МЕНДЕЛЕЕВА
Химическое взаимодействие между растворяемым веществом и растворителем.
Образующиеся
соединения гидраты
Слайд 10ХИМИЧЕСКАЯ ТЕОРИЯ ДМИТРИЯ МЕНДЕЛЕЕВА
H+ + aH2O + 1130 кДж
Cl¯ + bH2O
+ 351 кДж
Гидратация 1481 кДж
Разрыв 1377 кДж
Остаток 104 кДж
HCl + (a+b)H2O H+·aH2O + Cl¯·bH2О Упрощённо:
HCl H+ + Cl¯
Гидратация 1481 кДж
Разрыв 1377 кДж
Остаток 104 кДж
HCl + (a+b)H2O H+·aH2O + Cl¯·bH2О Упрощённо:
HCl H+ + Cl¯
Слайд 11ХИМИЧЕСКАЯ ТЕОРИЯ ДМИТРИЯ МЕНДЕЛЕЕВА
Na+ + aH2O + 422 кДж
Cl¯ + bH2O
+ 351 кДж
Гидратация 773 кДж
Разрыв 750 кДж
Остаток 23 кДж
NaCl + (a+b)H2O Na+·aH2O + Cl¯·bH2O
Упрощённо:
NaCl Na+ + Cl¯
Гидратация 773 кДж
Разрыв 750 кДж
Остаток 23 кДж
NaCl + (a+b)H2O Na+·aH2O + Cl¯·bH2O
Упрощённо:
NaCl Na+ + Cl¯
Слайд 12ФИЗИКО – ХИМИЧЕСКАЯ ТЕОРИЯ
И.А. КАБЛУКОВА и
В.А. КИСТЯКОВСКОГО
1. Ориентация молекул
воды вокруг ионов или молекул растворяемого вещества;
2. Гидратация молекул воды с ионами или молекулами (химическое взаимодействие);
3. Ионизация молекул с КПС, то есть превращение в соединения с ионной связью;
4. Диссоциация молекул или кристаллов на гидратированные ионы.
2. Гидратация молекул воды с ионами или молекулами (химическое взаимодействие);
3. Ионизация молекул с КПС, то есть превращение в соединения с ионной связью;
4. Диссоциация молекул или кристаллов на гидратированные ионы.
Слайд 13Классификация ионов
По заряду:
-) Катионы (+): Na+; H+; NH4+; PH4+; H3O+
-)
Анионы (-): Сl¯; ОН¯; SO42-; PO43-
2. По сложности
-) Простые: Na+; H+; Сl¯
-) Сложные: NH4+; ОН¯; SO42-
3. По гидратированности
-) Гидратированные: Cu2+ · 4H2O (синие)
-) Негидратированные: Сu2+ (бесцветные)
2. По сложности
-) Простые: Na+; H+; Сl¯
-) Сложные: NH4+; ОН¯; SO42-
3. По гидратированности
-) Гидратированные: Cu2+ · 4H2O (синие)
-) Негидратированные: Сu2+ (бесцветные)
Слайд 22Степень электролитической диссоциации
Отношение числа молекул электролита, распавшегося на ионы, к общему
числу растворенных молекул
Слайд 26КОНСТАНТА ДИССОЦИАЦИИ
Константа равновесия характеризующая процесс диссоциации слабого электролита
Кд характеризует способность электролита
диссоциировать на ионы
Слайд 27СТУПЕНЧАТАЯ ДИССОЦИАЦИЯ
H3PO4
I ступень:
H3PO4 → Н+
+ H2PO4–
II ступень:
H2PO4– Н+ + HPO42–
III ступень:
HPO42 – Н+ + PO43–
II ступень:
H2PO4– Н+ + HPO42–
III ступень:
HPO42 – Н+ + PO43–
Слайд 31ТИП СРЕДЫ
[H+] = [OH¯] – нейтральная среда
[H+] > [OH¯] – кислотная
среда
[H+] < [OH¯] – щелочная среда
[H+] < [OH¯] – щелочная среда



















![ДИССОЦИАЦИЯ ВОДЫ2H2O H3O+ + OH¯упрощённо:H2O H+ + OH¯[H+] = [OH ¯] = 10-7моль/л](/img/tmb/3/265028/45223ec44a8c68e807f8161598dc86cf-800x.jpg)
![ТИП СРЕДЫ[H+] = [OH¯] – нейтральная среда[H+] > [OH¯] – кислотная среда[H+] < [OH¯] –](/img/tmb/3/265028/397f0f25deb14cdf7ae39079237640b3-800x.jpg)