- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электрический ток в жидкостях презентация
Содержание
- 1. Электрический ток в жидкостях
- 2. Электролиты Проводниками электрического тока являются
- 3. Электролиз Прохождение электрического тока через
- 4. Закон электролиза Майкл Фарадей на
- 5. Проводимость электролитов Проводимость жидких электролитов
- 6. + − + − +
- 7. + − + − +
- 8. Агрегатное состояние электролитов Существуют не
- 9. Применение электролиза Явление электролиза применяется
Слайд 2Электролиты
Проводниками электрического тока являются не только металлы и полупроводники.
Электрический ток проводят растворы многих веществ в воде. Как показывает опыт, чистая вода не проводит электрический ток, то есть в ней нет свободных носителей электрических зарядов. Не проводят электрический ток и кристаллы поваренной соли, хлорида натрия.
Однако раствор хлорида натрия является хорошим проводником электрического тока.
Растворы солей, кислот и оснований, способные проводить электрический ток, называются электролитами.
Однако раствор хлорида натрия является хорошим проводником электрического тока.
Растворы солей, кислот и оснований, способные проводить электрический ток, называются электролитами.
Слайд 3Электролиз
Прохождение электрического тока через электролит обязательно сопровождается выделением вещества
в твёрдом или газообразном состоянии на поверхности электродов. Выделение вещества на электродах показывает, что в электролитах электрические заряды переносят заряженные атомы вещества – ионы. Этот процесс называется электролизом.
Слайд 4Закон электролиза
Майкл Фарадей на основе экспериментов с различными электролитами
установил, что при электролизе масса m выделившегося на электроде вещества пропорциональна прошедшему через электролит заряду ∆q или силе тока I и времени ∆t прохождения тока:
m=k∆q= kI∆t.
Это уравнение называется законом электролиза. Коэффициент k, зависящий от выделившегося вещества, называется электрохимическим эквивалентом вещества.
m=k∆q= kI∆t.
Это уравнение называется законом электролиза. Коэффициент k, зависящий от выделившегося вещества, называется электрохимическим эквивалентом вещества.
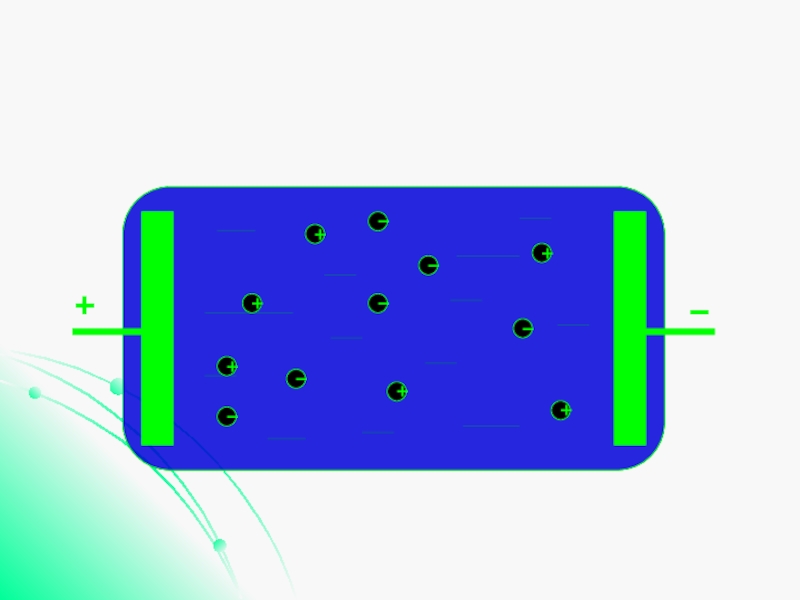
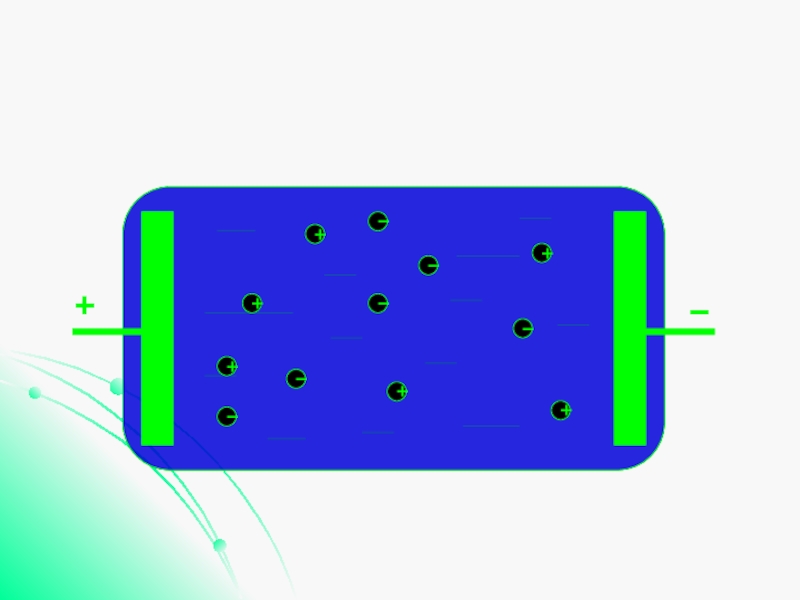
Слайд 5Проводимость электролитов
Проводимость жидких электролитов объясняется тем, что при растворении
в воде нейтральные молекулы солей, кислот и оснований распадаются на отрицательные и положительные ионы.
В электрическом поле ионы приходят в движение и создают электрический ток.
В электрическом поле ионы приходят в движение и создают электрический ток.
Слайд 8Агрегатное состояние электролитов
Существуют не только жидкие, но и твёрдые
электролиты. Примером твёрдого электролита может служить стекло. В составе стекла имеются положительные и отрицательные ионы. В твёрдом состоянии стекло не проводит электрический ток, так как ионы не могут двигаться в твёрдом теле.
При нагревании стекла ионы получают возможность перемещаться под действием электрического поля и стекло становится проводником.
При нагревании стекла ионы получают возможность перемещаться под действием электрического поля и стекло становится проводником.
Слайд 9Применение электролиза
Явление электролиза применяется на практике для получения многих
металлов из раствора солей.
С помощью электролиза для защиты от окисления или для украшения производится покрытие различных предметов и деталей машин тонкими слоями таких металлов, как хром, никель, серебро, золото.
С помощью электролиза для защиты от окисления или для украшения производится покрытие различных предметов и деталей машин тонкими слоями таких металлов, как хром, никель, серебро, золото.