- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электрический ток в жидкости презентация
Содержание
- 1. Электрический ток в жидкости
- 2. Электрический ток -упорядоченное движение заряженных частиц. Ещё
- 3. *Проводят электрический ток растворы солей,
- 4. Электролитическая диссоциация Процесс распада электролита
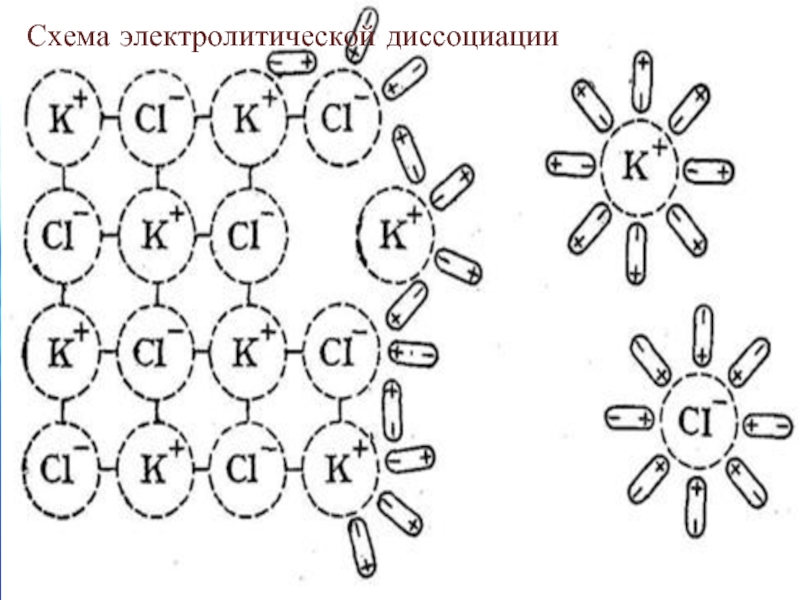
- 5. Схема электролитической диссоциации
- 6. Следовательно, диссоциация молекул электролитов происходит
- 7. По отношению к степени электролитической
- 8. Из этого сделаем вывод, что
- 9. Вне электрического поля ионы движутся
- 10. Вольт – амперная характеристика для электролитов. За
- 12. Упорядоченное движение ионов в проводящих жидкостях происходит
- 13. Закон Фарадея Физик Майкл Фарадей
- 14. Первый закон Фарадея Формула
- 15. Применение электролиза
- 16. Электролитический метод используется для получения чистых
- 17. Также посредством электролиза можно не только покрыть
- 18. Кроме указанных выше, электролиз нашел применение и
- 19. *электрохимическая обработка поверхности металлического изделия (полировка);
- 20. *очистка воды – удаление из нее растворимых
- 21. Спасибо за внимание
Слайд 1
Электрический ток в жидкости
Презентацию выполнили:
Воробьев Валентин,
Исакова Анастасия, Кузнецова Екатерина,
Слайд 2Электрический ток -упорядоченное движение заряженных частиц.
Ещё в 1877 году шведский ученый
CuSO4==>Cu2++SO42-
Слайд 3
*Проводят электрический ток растворы солей, щелочей, кислот.
*Вещества, растворы которых проводят электрический
*Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
*Вещества, растворы которых не проводят электрический ток, называются неэлектролитами.
Слайд 4
Электролитическая диссоциация
Процесс распада электролита на ионы называется электролитической диссоциацией.
С. Аррениус, который
Слайд 6
Следовательно, диссоциация молекул электролитов происходит в следующей последовательности:
а) ориентация молекул воды
б) гидратация молекулы электролита;
в) её ионизация;
г) распад её на гидратированные ионы.
Слайд 7
По отношению к степени электролитической диссоциации электролиты делятся на сильные и
Сильные электролиты – такие, которые при растворении практически полностью диссоциируют.У них значение степени диссоциации стремится к единице.
Слабые электролиты – такие, которые при растворении почти не диссоциируют. Их степень диссоциации стремится к нулю.
Слайд 8
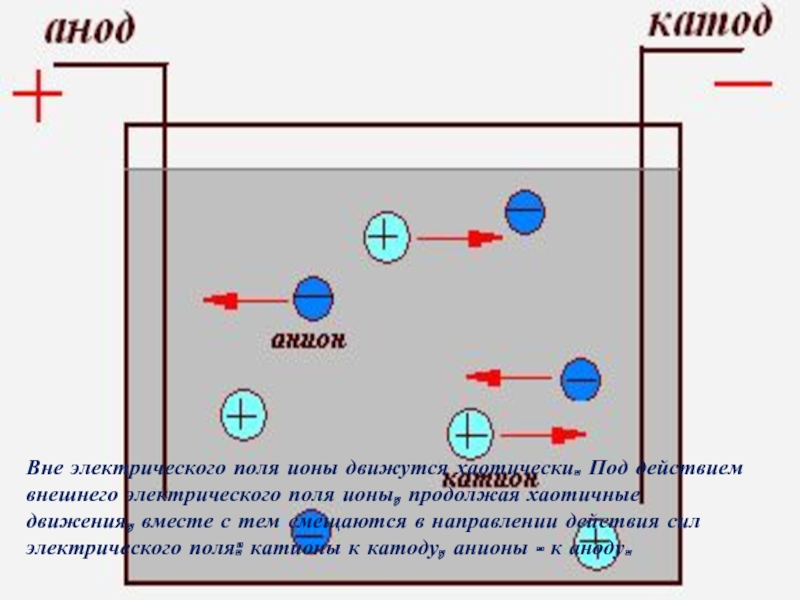
Из этого сделаем вывод, что переносчиками электрического заряда (носителями электрического тока)
Слайд 9
Вне электрического поля ионы движутся хаотически. Под действием внешнего электрического поля
Слайд 10Вольт – амперная характеристика для электролитов.
За счет явления поляризации график смещен.
График
Сопротивление электролитов падает с ростом температуры, так как с ростом температуры растёт количество ионов.
Слайд 11
Электролиз — физико-химическое
явление, состоящее в
на электродах составных частей растворённых
веществ, являющихся результатом
окислительно-восстановительных
на электродах, которое возникает при
прохождении электрического тока через
раствор либо расплав электролита.
Электролиз
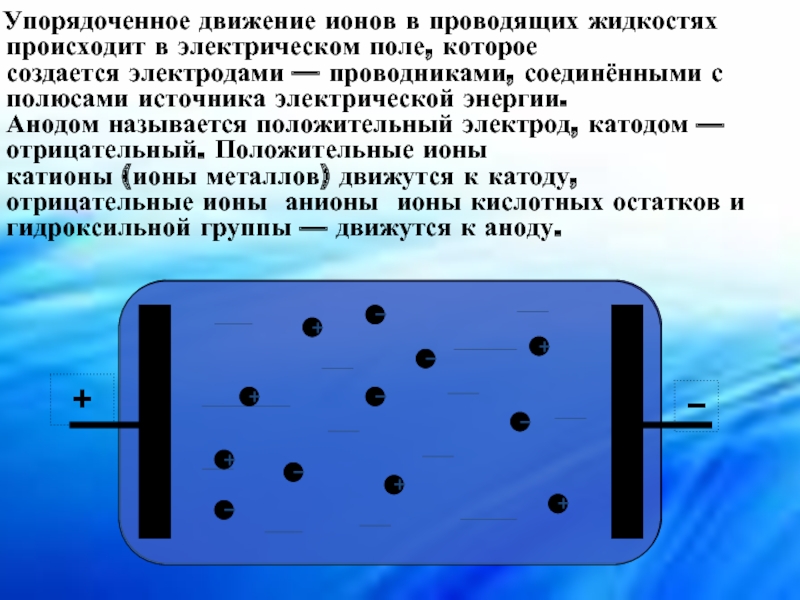
Слайд 12 Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое
+
−
+
−
+
−
+
−
+
−
+
+
−
−
Слайд 13
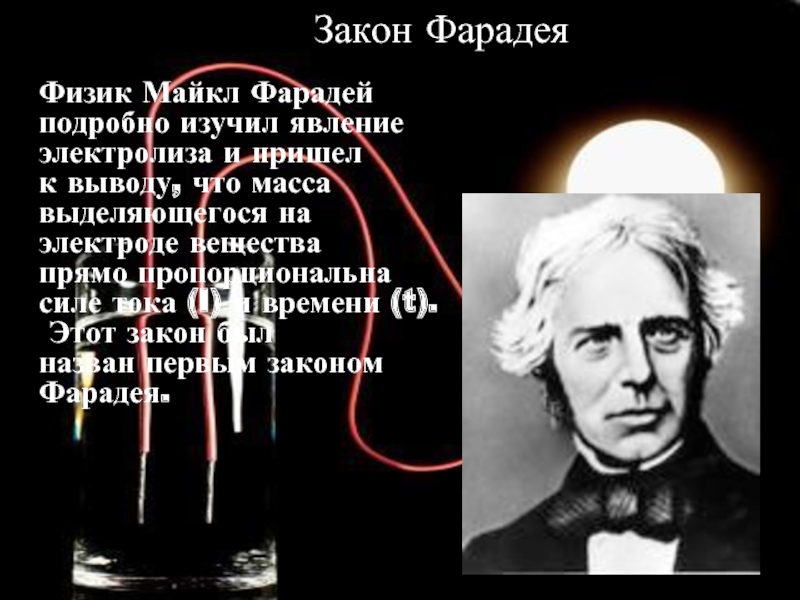
Закон Фарадея
Физик Майкл Фарадей
подробно изучил явление
электролиза и пришел
к
выделяющегося на
электроде вещества
прямо пропорциональна
силе тока (I) и времени (t).
Этот закон был
назван первым законом Фарадея.
Слайд 14
Первый закон Фарадея
Формула этого закона – m=k I t
Где
вещества. k равно массе вещества, которая
выделяется на электроде за 1с при силе тока
1А. Это постоянное табличное значение
отличное для каждого вещества.
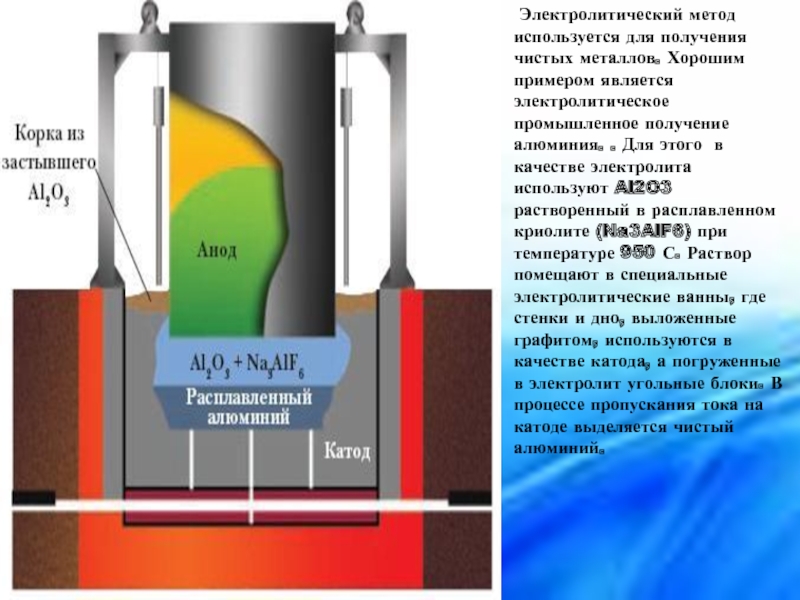
Слайд 16 Электролитический метод используется для получения чистых металлов. Хорошим примером является
Слайд 17Также посредством электролиза можно не только покрыть предметы слоем того или
Слайд 18Кроме указанных выше, электролиз нашел применение и в других областях:
* получение
Слайд 19 *электрохимическая обработка поверхности металлического изделия (полировка);
*электрохимическое окрашивание металлов (например,
Слайд 20*очистка воды – удаление из нее растворимых примесей. В результате получается
*электрохимическая заточка режущих инструментов (например, хирургических ножей, бритв и т.д.).