ФГУ НЦ ЭСМП Росздравнадзора
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ЭКСПЕРТИЗА МАКЕТОВ ГРАФИЧЕСКОГО ОФОРМЛЕНИЯ УПАКОВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ презентация
Содержание
- 1. ЭКСПЕРТИЗА МАКЕТОВ ГРАФИЧЕСКОГО ОФОРМЛЕНИЯ УПАКОВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ
- 2. ОБЩИЕ РЕКОМЕНДАЦИИ К ОФОРМЛЕНИЮ МАКЕТОВ Страницы
- 4. Обязательная информация о лекарственном препарате, которая должна
- 5. Статья 16, п.2 Федерального закона «О
- 6. Требования к графическому оформлению ЛС представлены в:
- 7. На первичной (внутренней потребительской) упаковке хорошо читаемым
- 8. На вторичной (внешней потребительской) упаковке хорошо читаемым
- 9. Текст макетов не должен противоречить согласованным проектам
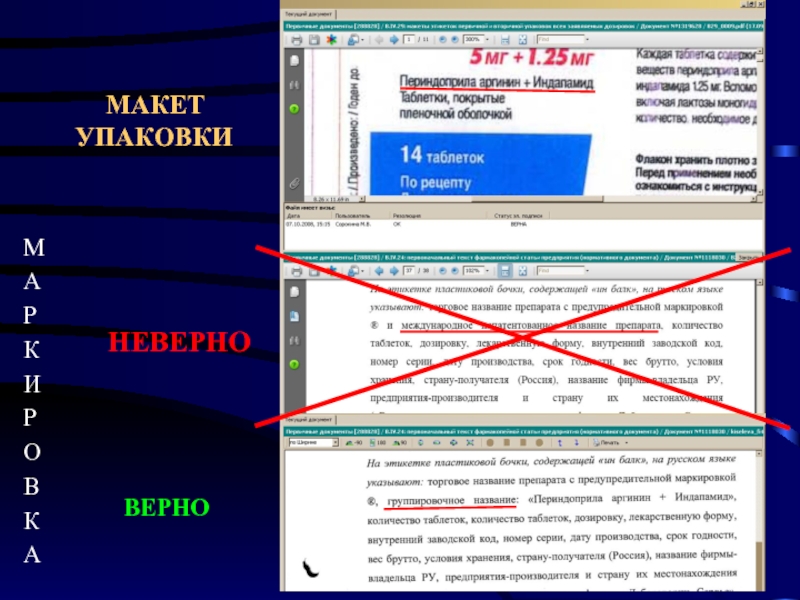
- 10. МЕЖДУНАРОДНОЕ НЕПАТЕНТОВАННОЕ НАЗВАНИЕ должно быть обязательно указано
- 11. НЕВЕРНО ВЕРНО
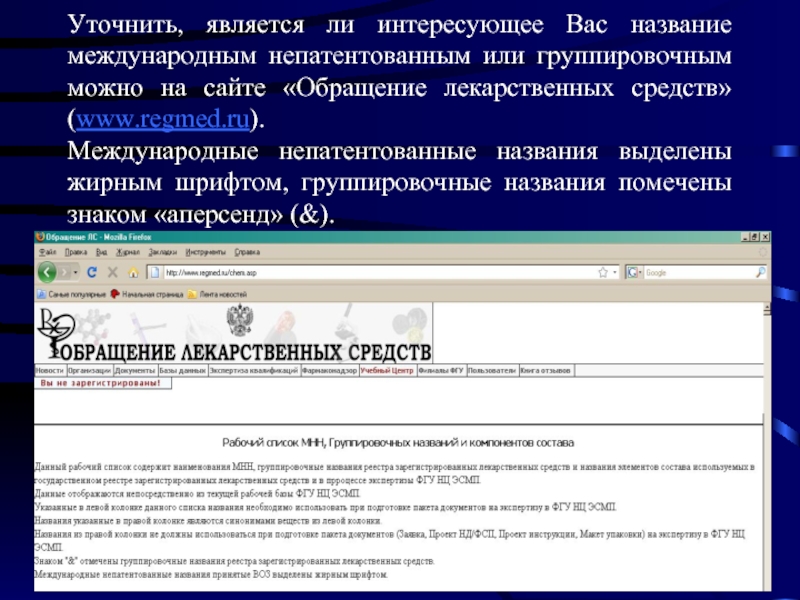
- 12. Уточнить, является ли интересующее Вас название международным
- 13. НАИМЕНОВАНИЯ И АДРЕСА КОМПАНИЙ, УЧАСТВУЮЩИХ В
- 14. Адреса компаний допускается указывать как полностью, так
- 15. ДОЗИРОВКА должна быть указана в соответствии
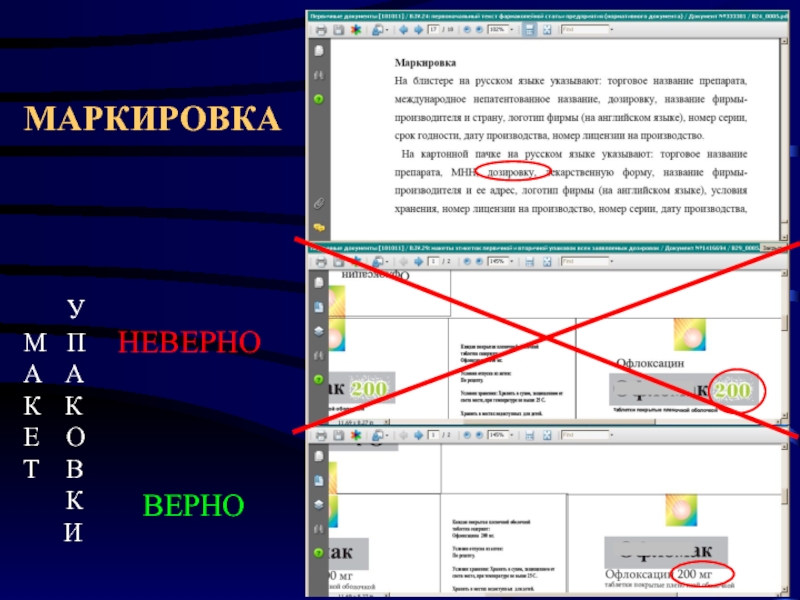
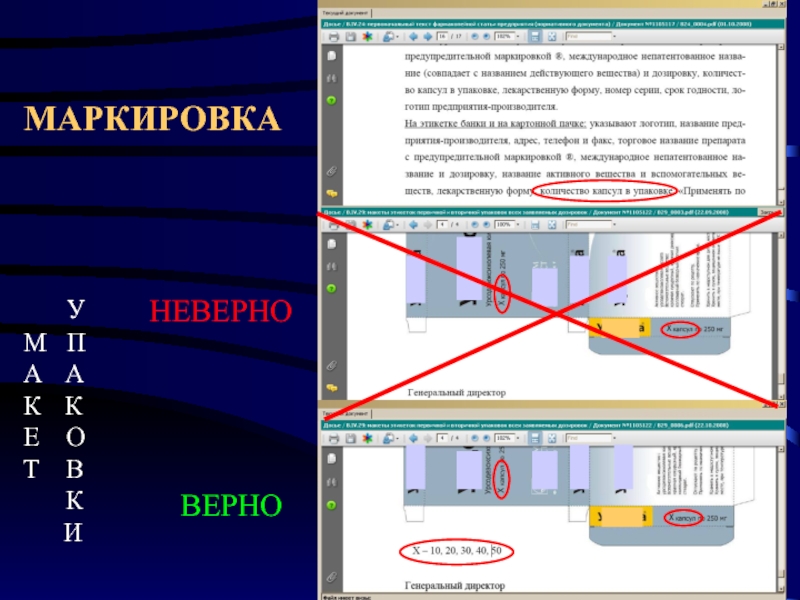
- 16. МАРКИРОВКА
- 17. КОЛИЧЕСТВО ЛС В УПАКОВКЕ
- 19. МАРКИРОВКА
- 20. ИНФОРМАЦИЯ О СОСТАВЕ может быть представлена
- 21. НД ИМП Макет упаковки СОСТАВ
- 22. СОСТАВ НД ИМП Макет упаковки
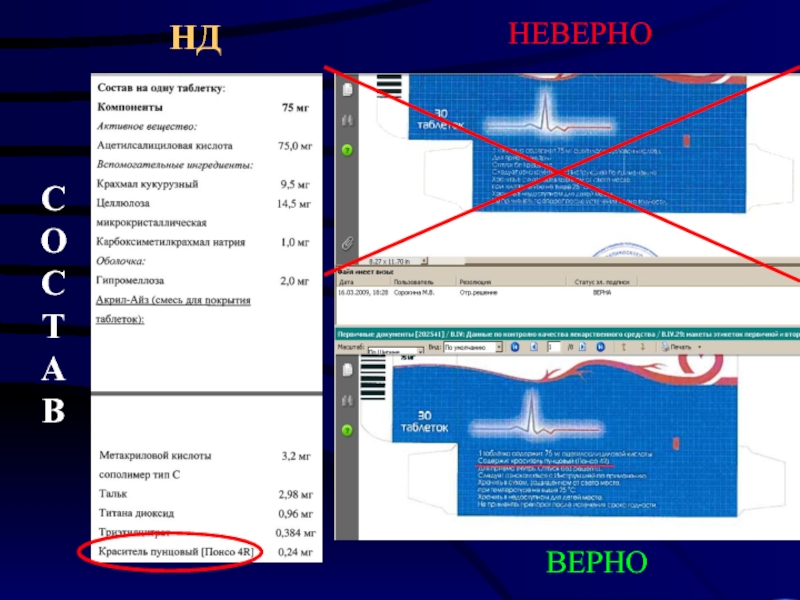
- 23. СОСТАВ НД НЕВЕРНО ВЕРНО
- 24. Возможные варианты оформления перечня некоторых вспомогательных веществ,
- 25. СОСТАВ
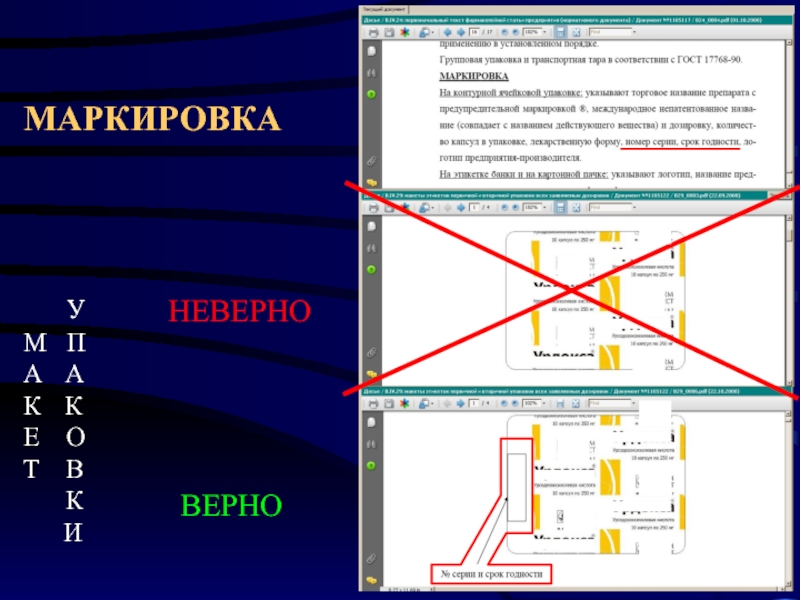
- 26. НОМЕР СЕРИИ, ДАТА ИЗГОТОВЛЕНИЯ, СРОК
- 27. МАРКИРОВКА
- 28. Способ применения: Путь введения: внутрь, наружно,
- 29. НОМЕР ГОСУДАРСТВЕННОЙ РЕГИСТРАЦИИ на упаковке указывать не
- 30. НД Макет упаковки ЛЕКАРСТВЕННАЯ ФОРМА П
- 31. СПАСИБО ЗА ВНИМАНИЕ
Слайд 1Сорокина М. В.
Начальник сектора ведения баз данных
и унификации информации
ЭКСПЕРТИЗА МАКЕТОВ
Слайд 2ОБЩИЕ РЕКОМЕНДАЦИИ К ОФОРМЛЕНИЮ МАКЕТОВ
Страницы макетов должны быть пронумерованы в
В заголовке каждой страницы должна быть указана информация, относящаяся к макету, расположенному на данной странице и включающая:
торговое название;
наименование лекарственной формы;
дозировку (концентрация, активность) (если применимо);
наименование элемента упаковки (тары);
количество лекарственного средства в упаковке (при необходимости);
наименование и страну предприятия-производителя и при необходимости других участников производства и/или владельца РУ
Каждая страница макета должна быть заверена печатью компании владельца РУ (заявителя регистрации) и подписью ее ответственного представителя с указанием должности, фамилии и инициалов, либо печатью компании, действующей по доверенности от лица компании владельца РУ (заявителя регистрации) и подписью ее ответственного представителя с указанием должности, фамилии и инициалов.
Слайд 4Обязательная информация о лекарственном препарате, которая должна быть доведена до потребителя
Статьей 16, Федерального закона от 22.09.1998 г. № 86-ФЗ «О лекарственных средствах».
Слайд 5Статья 16, п.2 Федерального закона
«О лекарственных средствах»
Лекарственные средства поступают в
внутренней и внешней упаковках хорошо читаемым шрифтом
на русском языке указаны:
Название ЛС и международное непатентованное название;
Название предприятия – производителя ЛС;
Номер серии и дата изготовления;
Способ применения;
Доза и количество доз в упаковке;
Срок годности;
Условия отпуска;
Условия хранения;
Меры предосторожности при применении ЛС.
Слайд 6Требования к графическому оформлению ЛС представлены в:
Методических указаниях МУ 9467-015-05749470-98
"Графическое оформление
Введено в действие 01.05.1999 г. Руководителем Департамента государственного контроля качества, эффективности, безопасности лекарственных средств и медицинской техники Минздрава России.
Рекомендации к графическому оформлению ЛС представлены в:
Сборнике методических рекомендаций по
стандартизации ЛС (Москва, 2006)
Слайд 7 На первичной (внутренней потребительской) упаковке хорошо читаемым шрифтом на русском языке
торговое название препарата;
дозировка (активность, концентрация);
наименование владельца РУ (заявителя регистрации) и/или указание его товарного знака (логотипа);
номер серии и дата изготовления;
срок годности.
* Содержание текстов в зависимости от вида упаковки и лекарственных форм должно соответствовать требованиям приложения А в МУ 9467-015-05749470-98, а также в Сборнике методических рекомендаций по стандартизации ЛС (с.325-342, 360-380).
Слайд 8На вторичной (внешней потребительской) упаковке хорошо читаемым шрифтом на русском языке
торговое название препарата;
международное непатентованное название (МНН);
Наименование владельца РУ (заявителя регистрации) и предприятия-производителя или организации, осуществляющей выпускающий контроль качества;
адрес владельца РУ (заявителя регистрации) и предприятия-изготовителя или организации, осуществляющей выпускающий контроль качества;
товарный знак владельца РУ (заявителя регистрации);
наименование лекарственной формы;
дозировка (активность, концентрация);
количество ЛС в упаковке;
информация о составе;
номер серии;
дата изготовления;
дата истечения срока годности;
условия хранения;
способ применения (путь введения, способ введения);
условия отпуска из аптек;
штрих-код;
предупредительные надписи и меры предосторожности при применении ЛС.
* Содержание текстов в зависимости от вида упаковки и лекарственных форм должно соответствовать требованиям приложения А в МУ 9467-015-05749470-98, а также в Сборнике методических рекомендаций по стандартизации ЛС (с.325-342, 360-380).
Слайд 9Текст макетов не должен противоречить согласованным проектам нормативного документа (НД/ФСП), инструкции
Слайд 10МЕЖДУНАРОДНОЕ НЕПАТЕНТОВАННОЕ НАЗВАНИЕ
должно быть обязательно указано на упаковке
В случае отсутствия МНН
МНН или группировочное название допускается не указывать в случае полного совпадения с торговым названием.
Слайд 12Уточнить, является ли интересующее Вас название международным непатентованным или группировочным можно
Слайд 13
НАИМЕНОВАНИЯ И АДРЕСА КОМПАНИЙ, УЧАСТВУЮЩИХ В ПРОИЗВОДСТВЕННОМ ПРОЦЕССЕ
На упаковке должны быть
наименование и адрес владельца РУ (заявителя регистрации) при необходимости
наименование и адрес предприятия-производителя или организации, осуществляющей выпускающий контроль качества (указывается после наименования и адреса владельца РУ с предшествующим словом «произведено»)
При необходимости указывается наименование и адрес организации, осуществляющей фасовку и/или упаковку с предшествующим словом «расфасовано» и/или «упаковано».
Слайд 14Адреса компаний допускается указывать как полностью, так и сокращенно (страна, город). Дополнительно
Слайд 15ДОЗИРОВКА
должна быть указана в соответствии с нормативным документом и инструкцией по
Слайд 20
ИНФОРМАЦИЯ О СОСТАВЕ
может быть представлена в следующем объеме:
названия действующих веществ и
названия действующих веществ, их количества и перечень названий некоторых вспомогательных веществ*;
названия действующих веществ, их количества и перечень названий всех вспомогательных веществ;
названия действующих и вспомогательных веществ и их количества.
* Перечень вспомогательных веществ, которые следует указывать на упаковках ЛС приведен в Сборнике методических рекомендаций по стандартизации ЛС (Приложение Б, с.343-345, 381-383).
Слайд 24Возможные варианты оформления перечня некоторых вспомогательных веществ, которые следует указывать на
Состав: действующие вещества - <…>, вспомогательные вещества: краситель пунцовый [Понсо 4R] (Е 124) и другие, указанные в инструкции по медицинскому применению.
Состав: действующие вещества - <…>. Содержит краситель пунцовый [Понсо 4R] (Е 124).
Слайд 26НОМЕР СЕРИИ,
ДАТА ИЗГОТОВЛЕНИЯ,
СРОК ГОДНОСТИ
«Росздравнадзор предлагает организациям-производителям лекарственных средств внести
Письмо Федеральной службы по надзору в сфере здравоохранения и социального развития от 22 марта 2006 г. № 01И-225/06 «О маркировке лекарственных средств»