- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
брейн-ринг по химии презентация
Содержание
- 1. брейн-ринг по химии
- 2. Брейн – ринг проводится как фрагмент
- 3. I раунд Не бойтесь! Вы всё знаете!
- 4. Молекулы и атомы Дать определения атому, молекуле. 100
- 5. Атом – наименьшая (неделимая химическим путем)
- 6. Молекулы и атомы 200 Что такое «химический элемент»?
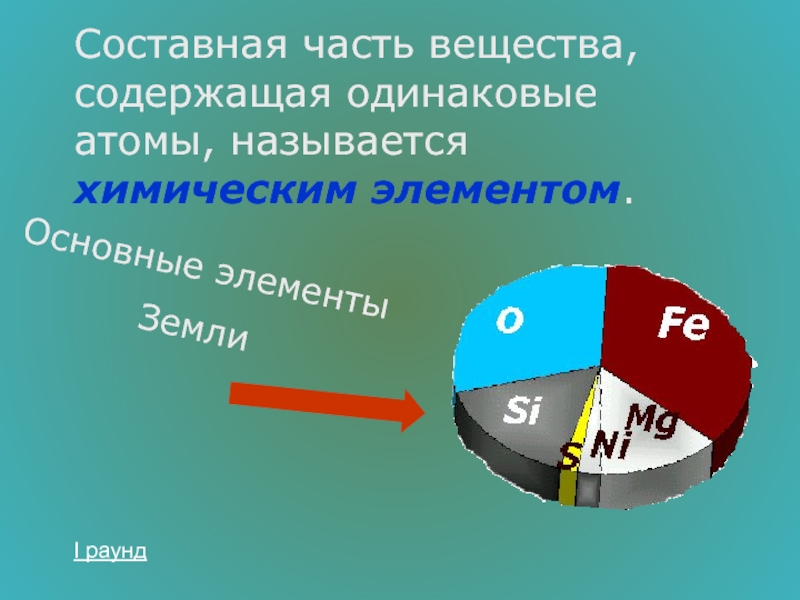
- 7. Составная часть вещества, содержащая одинаковые атомы, называется
- 8. Молекулы и атомы 300 Что такое «изотопы»?
- 9. Изотопы – элементы с одним порядковым номером, но с разной атомной массой I раунд
- 10. Молекулы и атомы 400 Что такое «ионы»?
- 11. Ионы – заряженные частицы, образующиеся в результате
- 12. Молекулы и атомы 500 Что такое «радикалы»?
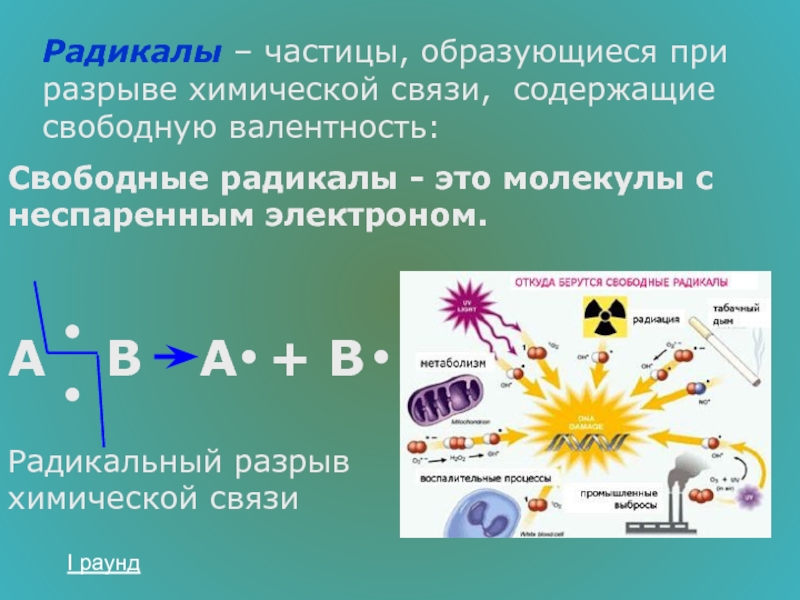
- 13. Радикалы – частицы, образующиеся при разрыве химической
- 14. Периодическая система элементов 100 Дать определение периодической системы
- 15. Периодическая система – это графическое представление периодического
- 16. Периодическая система элементов 200 Дать определение периода
- 17. Период – горизонтальный ряд элементов, начинающийся щелочным
- 18. Периодическая система элементов 300 Дать определение группы элементов
- 19. Группа элементов – ряд элементов по вертикали,
- 20. Периодическая система элементов 400 Что показывает «число Менделеева»?
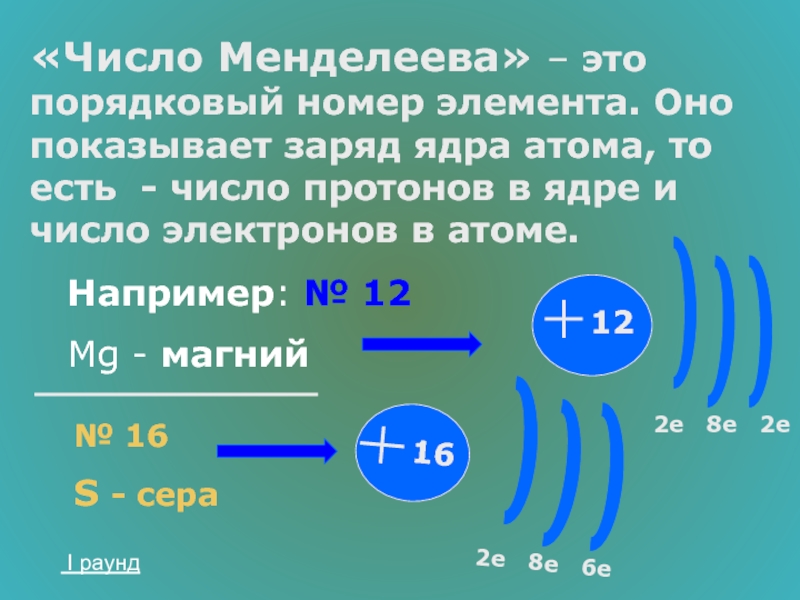
- 21. «Число Менделеева» – это порядковый номер элемента.
- 22. Периодическая система элементов 500 Как объяснить периодические изменения свойств элементов?
- 23. Периодические изменения свойств элементов объясняются периодическим изменением
- 24. II раунд Ну, это вам будет потруднее!
- 25. Строение вещества 100 Приведите примеры веществ молекулярного и немолекулярного строения
- 26. Вещества Молекулярного строения Немолекулярного строения
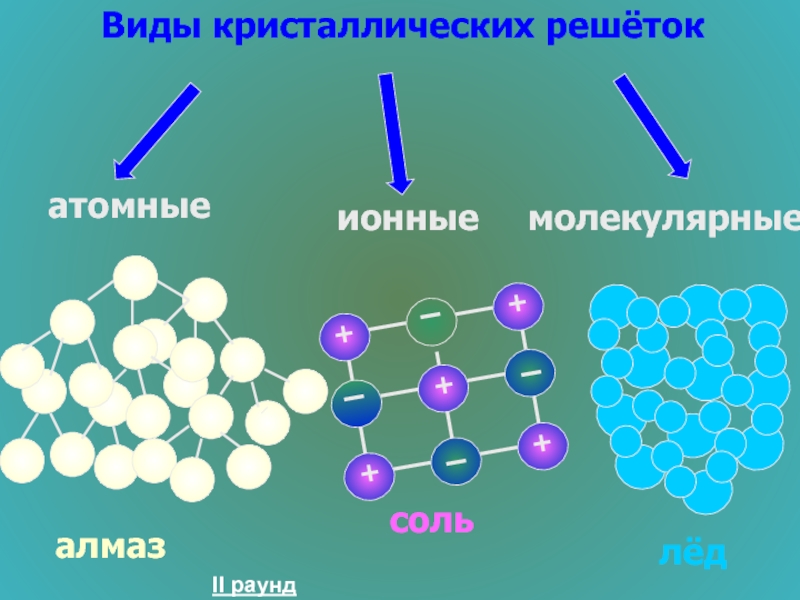
- 27. Строение вещества 200 Какие виды кристаллических решёток вам известны?
- 28. Виды кристаллических решёток атомные
- 29. Строение вещества 300 Привести примеры зависимости свойств веществ от вида кристаллических решёток
- 30. Вещества с атомными кристаллическими решётками: Тугоплавкие
- 31. Строение вещества 400 Что такое «аллотропия»?
- 32. Аллотропия – способность химического элемента образовывать несколько простых веществ. Например, углерод С образует: II раунд
- 33. Строение вещества 500 Как можно объяснить явление аллотропии?
- 34. Явление аллотропии объясняется тем, что свойства веществ
- 35. Металлы 100 Какое определение металлам дал М.В.Ломоносов?
- 36. М. В. Ломоносов определял металлы как «светлые блестящие тела, которые ковать можно» II раунд
- 37. Металлы 200 Какой металл нашёл наибольшее применение в электротехнике?
- 38. Сравнительная электропроводимость важнейших металлов: Наибольшее значение в
- 39. Металлы 300 Что общего в поведении всех металлов в химических реакциях?
- 40. Все металлы в химических реакциях являются восстановителями,
- 41. Металлы 400 Назовите щелочные металлы и расскажите об их применении
- 42. Щелочные металлы: Литий Li, натрий Na, калий
- 43. Металлы 500 Какие металлы называются переходными и почему?
- 44. Переходными называют металлы, которые в периодической системе
- 45. финал Газовый закон А.Авогадро 100 Следствия из закона Авогадро 100 Закон Джона Дальтона 100
- 46. В равных объёмах разных газов при одинаковых
- 47. I следствие: равное число молекул при одинаковых
- 48. Отношение доли каждого элемента к его атомной
- 49. Поздравляем всех участников с успешным завершением
Слайд 2
Брейн – ринг проводится как фрагмент зачёта за курс 9 –
Примечание: на обдумывание каждого вопроса не более 30-ти секунд.
Слайд 5
Атом – наименьшая (неделимая химическим путем) часть элемента, сохраняющая все свойства,
Молекула – наименьшая частица вещества, определяющая его свойства, способная к самостоятельному существованию, состоит из одинаковых или разных атомов.
I раунд
Слайд 7Составная часть вещества, содержащая одинаковые атомы, называется химическим элементом.
Основные элементы
Земли
I раунд
Слайд 11Ионы – заряженные частицы, образующиеся в результате отрыва (присоединения) электронов от
I раунд
Слайд 13Радикалы – частицы, образующиеся при разрыве химической связи, содержащие свободную валентность:
Свободные радикалы - это молекулы с неспаренным электроном.
Радикальный разрыв химической связи
I раунд
Слайд 15Периодическая система – это графическое представление периодического закона в виде прямоугольной
Она состоит из периодов по горизонтали и групп по вертикали.
I раунд
Слайд 17Период – горизонтальный ряд элементов, начинающийся щелочным металлом и заканчивающийся инертным
Номер периода соответствует числу электронных уровней у элементов этого периода.
IV, V большие периоды
I раунд
Слайд 19Группа элементов – ряд элементов по вертикали, сходных по химическим
Номер группы показывает высшую валентность элементов этой группы.
Группы делятся на подгруппы – А и В
I раунд
Слайд 21«Число Менделеева» – это порядковый номер элемента. Оно показывает заряд ядра
Например: № 12
Mg - магний
№ 16
S - сера
I раунд
Слайд 23Периодические изменения свойств элементов объясняются периодическим изменением числа электронов на последнем
Ура!!!
I раунд закончен!!!
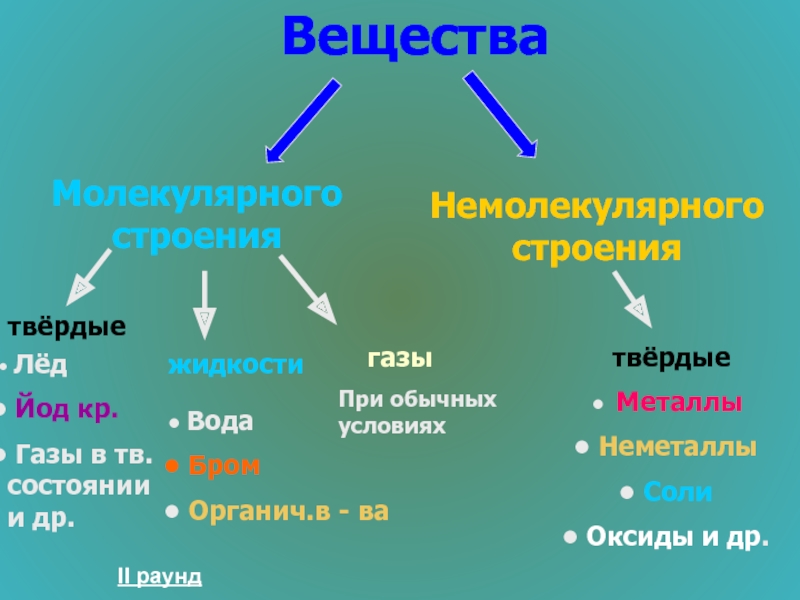
Слайд 26Вещества
Молекулярного строения
Немолекулярного строения
твёрдые
жидкости
твёрдые
Лёд
Йод кр.
Газы в тв. состоянии и
Вода
Бром
Органич.в - ва
Металлы
Неметаллы
Соли
Оксиды и др.
II раунд
Слайд 29
Строение вещества
300
Привести примеры зависимости свойств веществ от вида кристаллических решёток
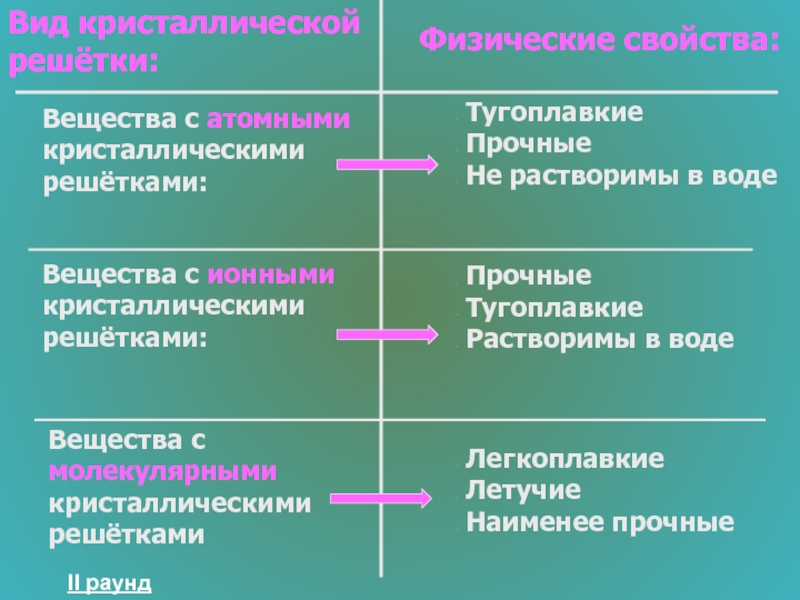
Слайд 30Вещества с атомными кристаллическими решётками:
Тугоплавкие
Прочные
Не растворимы в воде
Вещества с ионными кристаллическими решётками:
Прочные
Тугоплавкие
Растворимы в воде
Вещества с молекулярными кристаллическими решётками
Легкоплавкие
Летучие
Наименее прочные
Вид кристаллической решётки:
Физические свойства:
II раунд
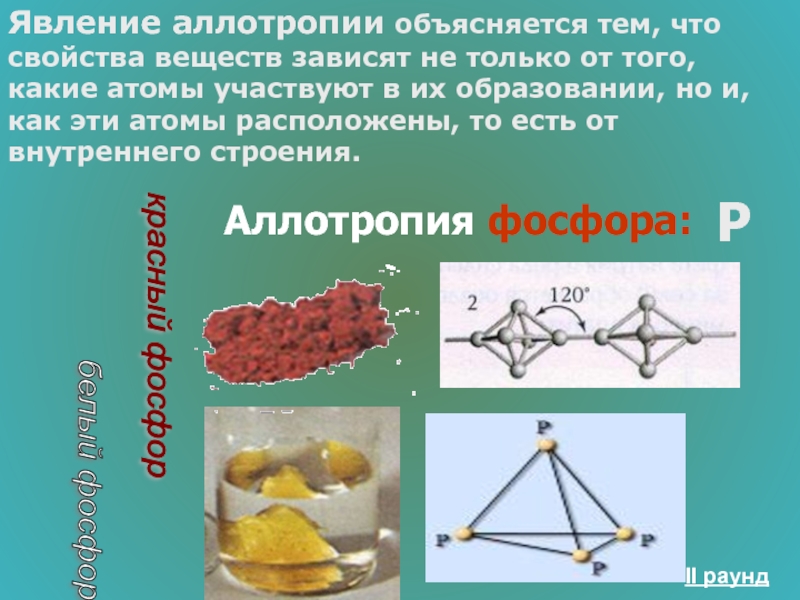
Слайд 32Аллотропия – способность химического элемента образовывать несколько простых веществ.
Например, углерод С
II раунд
Слайд 34Явление аллотропии объясняется тем, что свойства веществ зависят не только от
Аллотропия фосфора:
красный фосфор
белый фосфор
P
II раунд
Слайд 36М. В. Ломоносов определял металлы как «светлые блестящие тела, которые ковать
II раунд
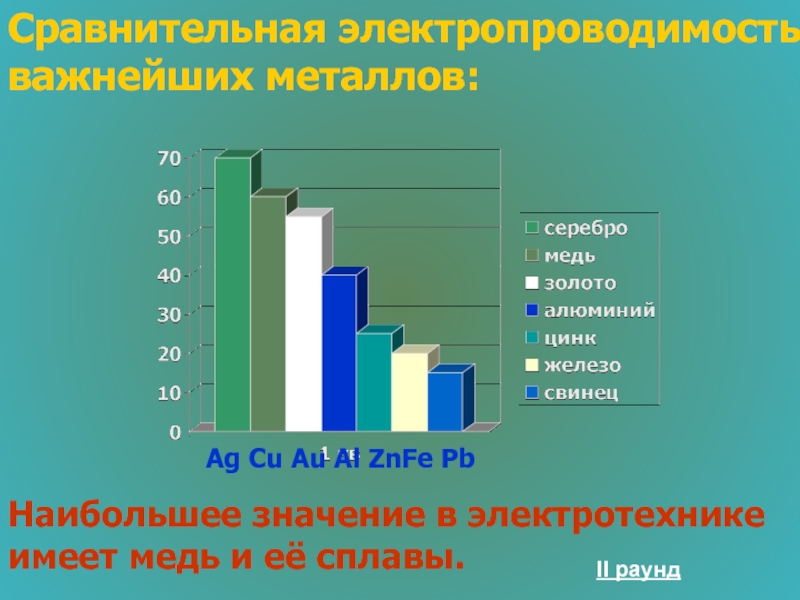
Слайд 38Сравнительная электропроводимость важнейших металлов:
Наибольшее значение в электротехнике имеет медь и её
Ag Cu Au Al ZnFe Pb
II раунд
Слайд 40Все металлы в химических реакциях являются восстановителями, то есть отдают валентные
Мет
процесс окисления
II раунд
Слайд 42Щелочные металлы:
Литий Li, натрий Na, калий К, рубидий Rb, цезий Cs
Применение:
Na
Rb применяется в фотоэлементах
Li применяется в аккумуляторах мобильных телефонов
II раунд
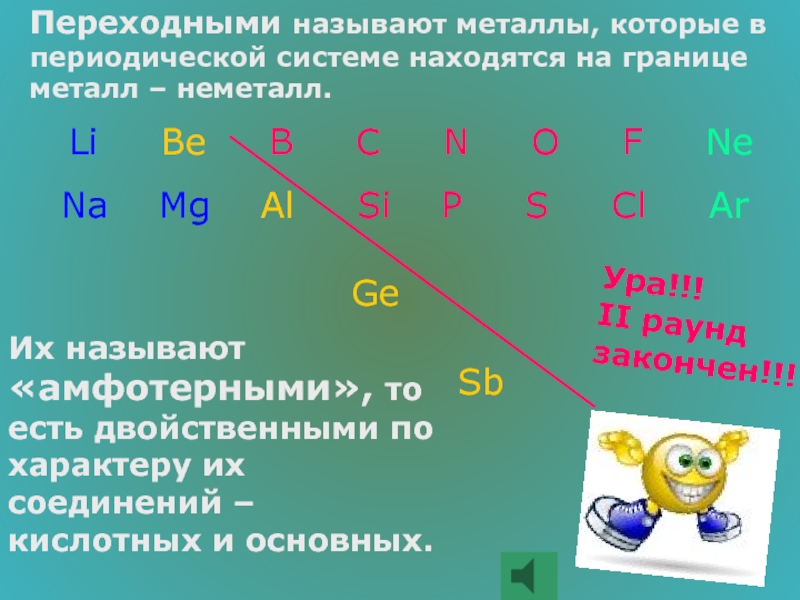
Слайд 44Переходными называют металлы, которые в периодической системе находятся на границе металл
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
Ge
Sb
Их называют «амфотерными», то есть двойственными по характеру их соединений – кислотных и основных.
Ура!!!
II раунд закончен!!!
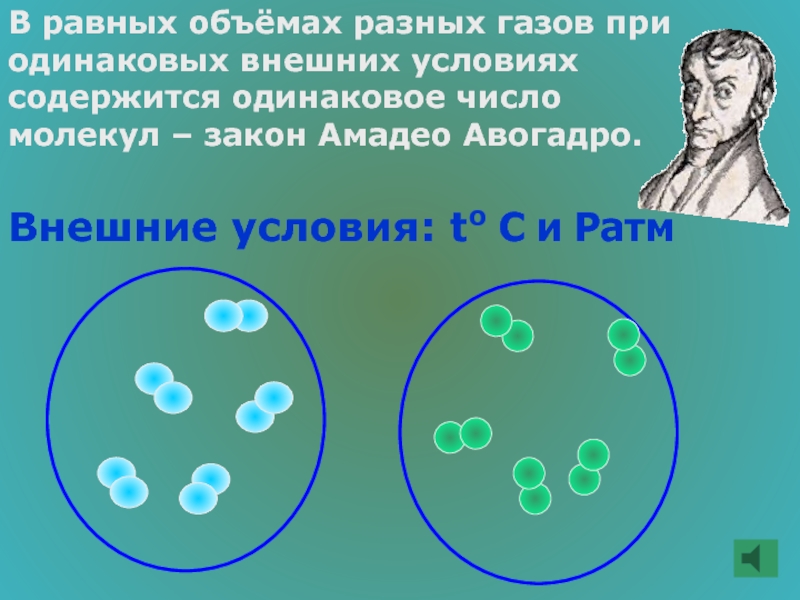
Слайд 46В равных объёмах разных газов при одинаковых внешних условиях содержится одинаковое
Внешние условия: to С и Ратм
Слайд 47I следствие: равное число молекул при одинаковых внешних условиях занимает одинаковые
II следствие: 1 моль любого газа при нормальных внешних условиях занимает объём V=22,4л/моль
Н.У. : to =0o C, P=1атм
III следствие: относительная плотность одного газа по другому равна отношению их молярных масс:
DI/DII= MI/MII
IV следствие: объёмы реагирующих газов прямо пропорциональны их коэффициентам.
Слайд 48Отношение доли каждого элемента к его атомной относительной массе можно выразить
Закон кратных отношений
W1/A1 : W2/A2 : W3/A3 =X : Y: Z, где X, Y, Z –простые целые числа
Д. Дальтон
Слайд 49
Поздравляем всех участников с успешным завершением брейн – ринга!
После
Всем спасибо!!!