- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Амины презентация
Содержание
- 1. Амины
- 2. Дать понятие об аминах, их классификации,
- 3. Амины – органические производные аммиака NH3,
- 4. 1. По количеству радикалов, связанных с
- 6. В большинстве случаев названия аминов образуют из
- 7. При наличии одинаковых радикалов используют приставки ди
- 8. 1. Структурная изомерия - углеродного скелета, начиная с С4H9NH2: Изомерия аминов
- 9. 1. Структурная изомерия - положения аминогруппы, начиная с С3H7NH2: Изомерия аминов
- 10. 2. Пространственная изомерия - возможна оптическая изомерия, начиная с С4H9NH2: Изомерия аминов
- 11. Связь N–H является полярной, поэтому первичные
- 12. Это объясняет относительно высокую температуру кипения
- 13. При обычной температуре только низшие алифатические
- 14. 1. Для аминов характерны ярко выраженные
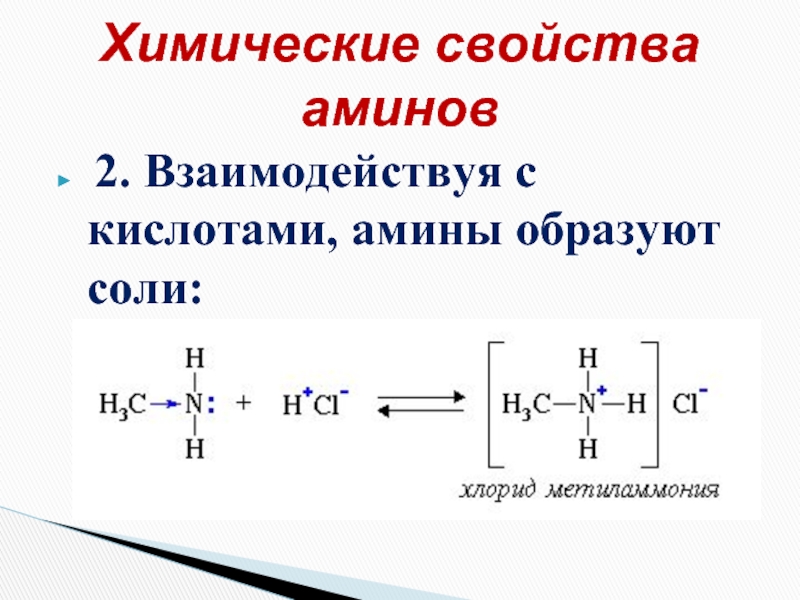
- 15. 2. Взаимодействуя с кислотами, амины образуют соли: Химические свойства аминов
- 16. 3. В отличие от аммиака, низшие
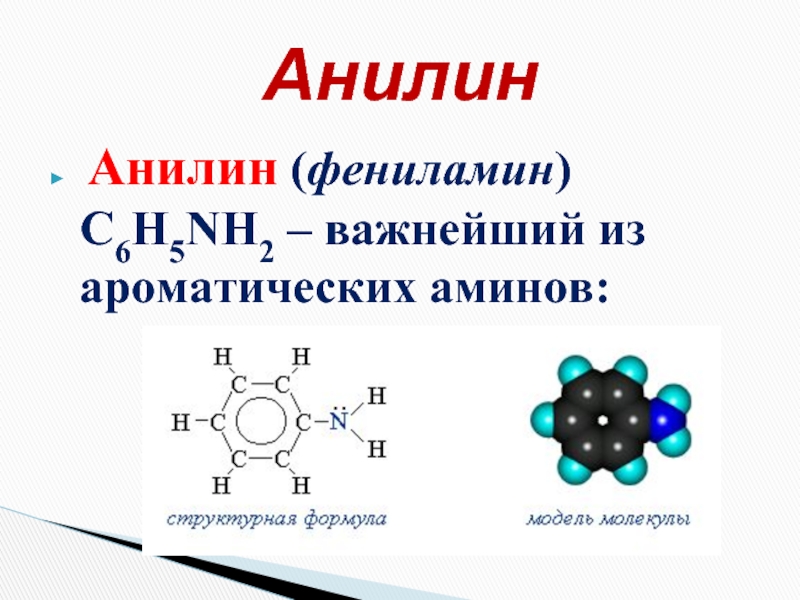
- 17. Анилин (фениламин) С6H5NH2 – важнейший из ароматических аминов: Анилин
- 18. Он находит широкое применение в качестве
- 19. Для анилина характерны реакции как по
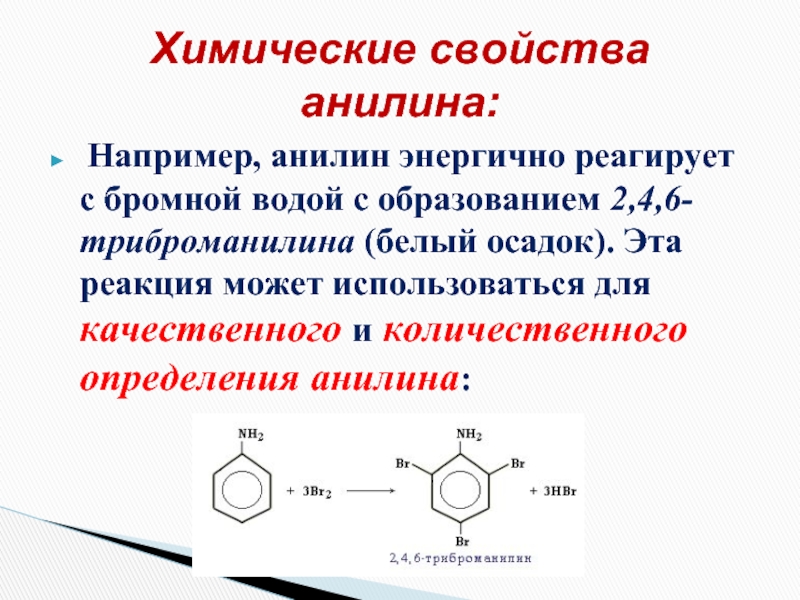
- 20. Например, анилин энергично реагирует с бромной
- 21. 1. Наиболее общим методом получения первичных аминов является восстановление нитросоединений: Получение аминов
- 22. Важнейший ароматический амин - анилин -
- 23. §16, записи в тетради. Решите задачу: Определите
Слайд 2 Дать понятие об аминах, их классификации, изомерии, номенклатуре и свойствах
Рассмотреть способы получения анилина и других аминов.
Цель урока:
Слайд 3 Амины – органические производные аммиака NH3, в молекуле которого один,
RNH2, R2NH, R3N
Простейший представитель – метиламин:
Что же такое амины?
Слайд 4 1. По количеству радикалов, связанных с атомом азота, различают первичные,
2. По характеру углеводородного радикала амины подразделяются на алифатические (жирные), ароматические и смешанные (или жирноароматические).
Амины классифицируют по двум структурным признакам:
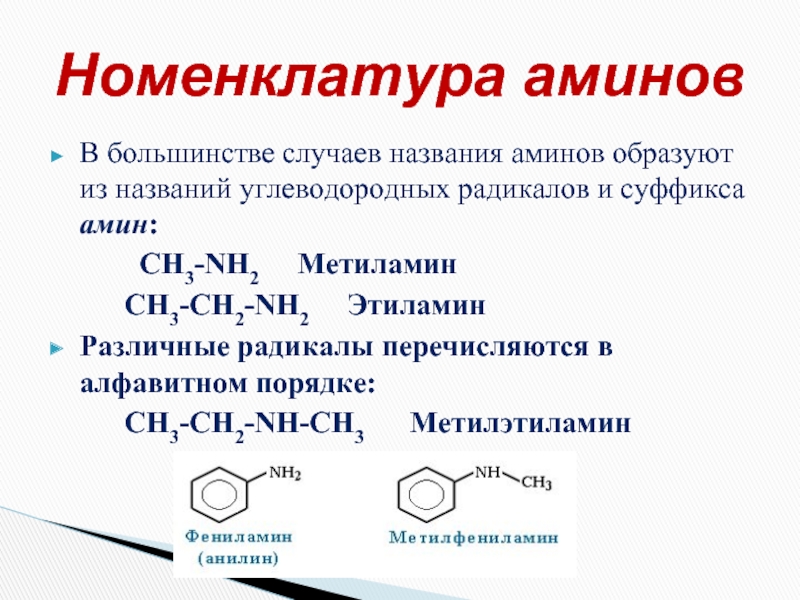
Слайд 6В большинстве случаев названия аминов образуют из названий углеводородных радикалов и
CH3-NH2 Метиламин
CH3-CH2-NH2 Этиламин
Различные радикалы перечисляются в алфавитном порядке:
CH3-CH2-NH-CH3 Метилэтиламин
Номенклатура аминов
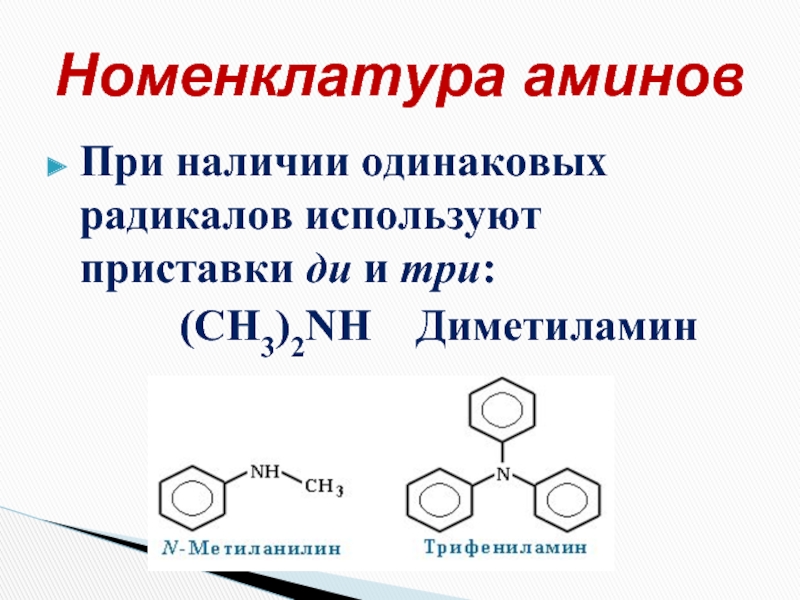
Слайд 7При наличии одинаковых радикалов используют приставки ди и три:
Номенклатура аминов
Слайд 10 2. Пространственная изомерия - возможна оптическая изомерия, начиная с С4H9NH2:
Изомерия
Слайд 11 Связь N–H является полярной, поэтому первичные и вторичные амины образуют
Физические свойства аминов
Слайд 12 Это объясняет относительно высокую температуру кипения аминов по сравнению с
Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных аминов (триэтиламин кипит при 89 °С, а н-гексиламин – при 133 °С).
Физические свойства аминов
Слайд 13 При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и
Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
Физические свойства аминов
Слайд 14 1. Для аминов характерны ярко выраженные основные свойства (за что
Химические свойства аминов
Слайд 16 3. В отличие от аммиака, низшие газообразные амины способны воспламеняться
Химические свойства аминов
Слайд 18 Он находит широкое применение в качестве полупродукта в производстве красителей,
Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит!
Анилин
Слайд 19 Для анилина характерны реакции как по аминогруппе, так и по
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
Анилин
Слайд 20 Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина
Химические свойства анилина:
Слайд 21 1. Наиболее общим методом получения первичных аминов является восстановление нитросоединений:
Получение аминов
Слайд 22 Важнейший ароматический амин - анилин - образуется при восстановлении нитробензола
Эта реакция носит имя русского химика Н.Н. Зинина, осуществившего ее впервые в 1842 г.
Получение аминов
Слайд 23§16, записи в тетради.
Решите задачу: Определите массу хлорида фениламмония, если к
Домашнее задание