- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алюминий презентация
Содержание
- 1. Алюминий
- 2. Открытие 1825 г., Х. Эрстед Алюминий (от
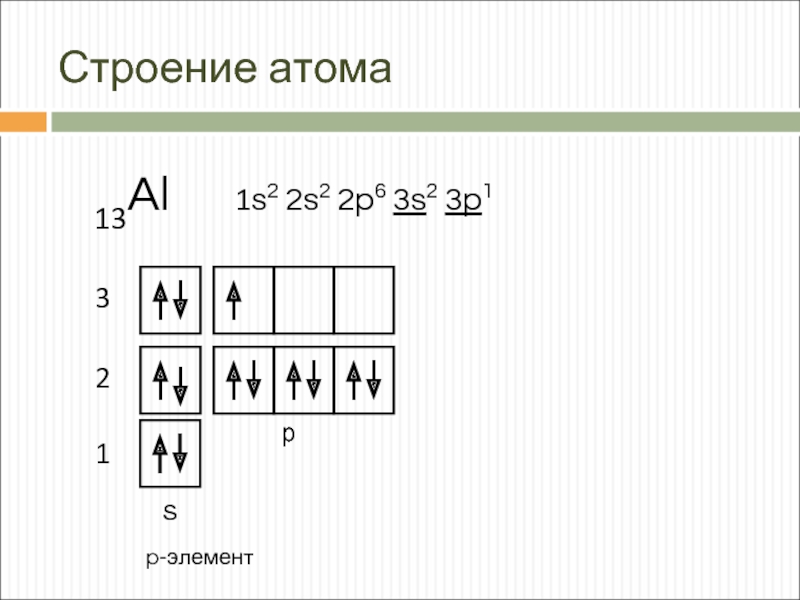
- 3. Строение атома 13Al
- 4. Распространенность в природе 3-е место среди всех
- 5. Распространенность в природе Боксит Al2O3
- 6. Распространенность в природе сапфир Al2O3 Разновидность корунда –
- 7. Распространенность в природе рубин Al2O3 Разновидность корунда –
- 8. Распространенность в природе Глинозем Al2O3
- 9. Распространенность в природе изумруд Be3Al2(SiO3)6 Разновидность берилла –
- 10. Распространенность в природе аквамарин Be3Al2(SiO3)6 Разновидность берилла –
- 11. Получение Современный метод получения был разработан независимо
- 12. Физические свойства Серебристо-белый металл Тпл=660оС высокая электропроводность лёгкий (плотность — 2,7 г/см³) высокая пластичность
- 13. Химические свойства 1) Взаимодействие с простыми веществами
- 14. Химические свойства 2) Взаимодействие с водой 2Al
- 15. Химические свойства 5) Взаимодействие со щелочью 2Al
- 16. Применение
- 17. Применение
- 18. Применение
- 19. Применение
Слайд 2Открытие
1825 г., Х. Эрстед
Алюминий (от лат. Alumen – квасцы)
1855 г –
Al почти в 10 раз дороже золота
Слайд 4Распространенность в природе
3-е место среди всех элементов
1-е место среди металлов
В природе
встречается в виде алюмосиликатов, боксита, корунда, берилла.
Слайд 11Получение
Современный метод получения был разработан независимо американцем Чарльзом Холлом и французом
Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом.
2Al2O3 4Al + 3O2
2Al2O3 4Al + 3O2
Слайд 12Физические свойства
Серебристо-белый металл
Тпл=660оС
высокая электропроводность
лёгкий (плотность — 2,7 г/см³)
высокая пластичность
Слайд 13Химические свойства
1) Взаимодействие с простыми веществами
а) с галогенами
Al + I2 →
б)
с кислородом
Al + O2 →
в) с серой
Al + S →
г) с азотом
Al + N2 →
д) с углеродом
Al + C →
Al + O2 →
в) с серой
Al + S →
г) с азотом
Al + N2 →
д) с углеродом
Al + C →
Напишите уравнения реакций
Слайд 14Химические свойства
2) Взаимодействие с водой
2Al + 6H2O → 2Al(OH)3 + 3H2
3)
Восстанавливает металлы из их оксидов (пирометаллургия, алюмотермия)
Al + Fe3O4 →
4) Взаимодействие с кислотами
Al + H2SO4 →
HNO3 (конц) и H2SO4 (конц) пассивируют алюминий, Al реагирует с ними только при нагревании
Al + Fe3O4 →
4) Взаимодействие с кислотами
Al + H2SO4 →
HNO3 (конц) и H2SO4 (конц) пассивируют алюминий, Al реагирует с ними только при нагревании
Напишите уравнения реакций
Слайд 15Химические свойства
5) Взаимодействие со щелочью
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4]
+ H2
тетрагидроксо-
алюминат натрия
6) Взаимодействие с солями
тетрагидроксо-
алюминат натрия
6) Взаимодействие с солями
Напишите уравнения реакций













![Химические свойства5) Взаимодействие со щелочью 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + H2 тетрагидроксо-](/img/tmb/2/161558/37759589ff9b21c5aacb16823222cc4f-800x.jpg)