- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алюминий презентация
Содержание
- 1. Алюминий
- 2. Алюминий Алюминий — элемент главной подгруппы третьей
- 3. Нахождение в природе Бокситы — Al2O3 •
- 4. Химические свойства При нормальных условиях алюминий покрыт
- 6. Химические свойства C другими неметаллами реагирует при
- 7. Химические свойства Со сложными веществами: с водой
- 8. Химические свойства Соляная и разбавленная серная кислота:
- 9. Оксид алюминия Al2O3 — в природе распространён
- 10. Гидроксид алюминия Al(OH)3 – белое студенистое вещество,
- 11. Обобщение оксиды получают косвенным путём оксиды
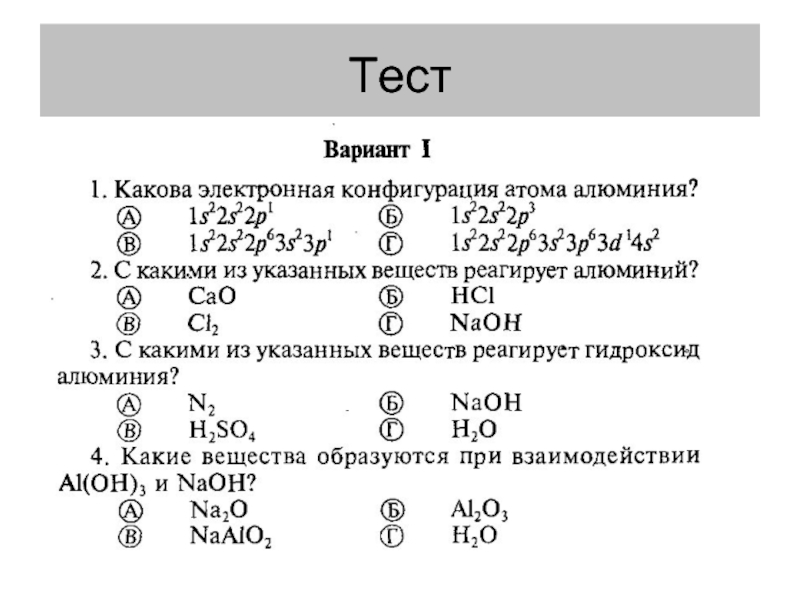
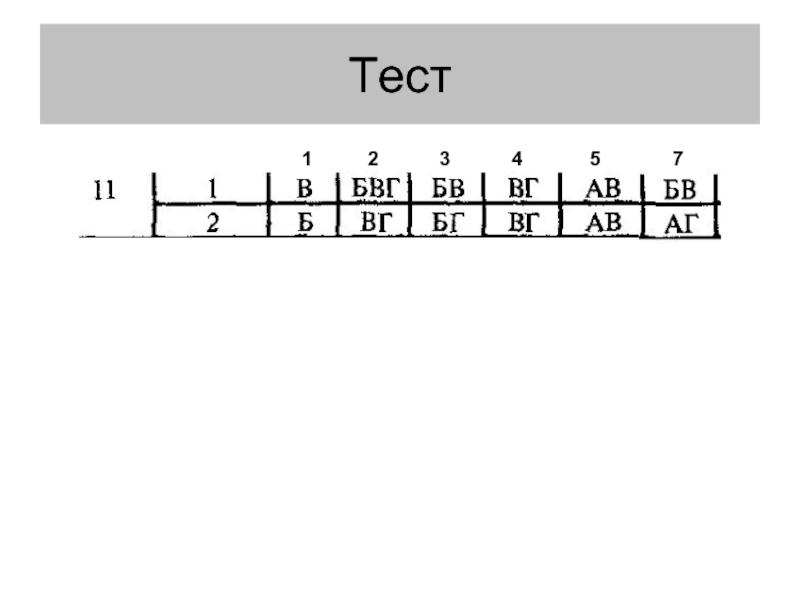
- 12. Тест
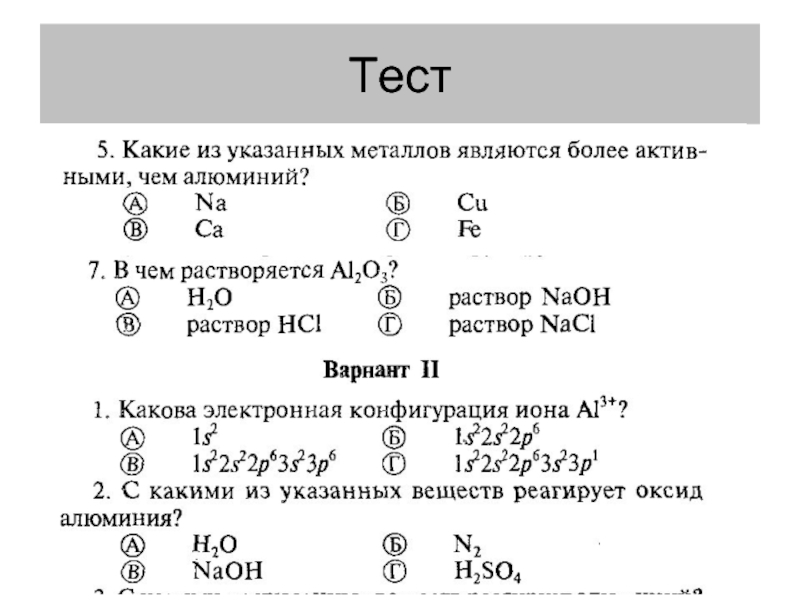
- 13. Тест
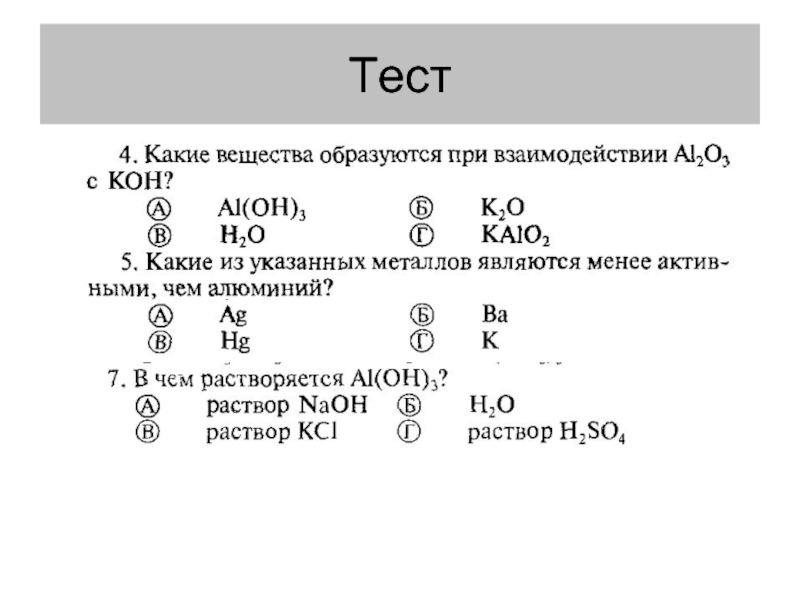
- 14. Тест
- 15. Тест
- 16. Вопросы Почему алюминий не паяют на
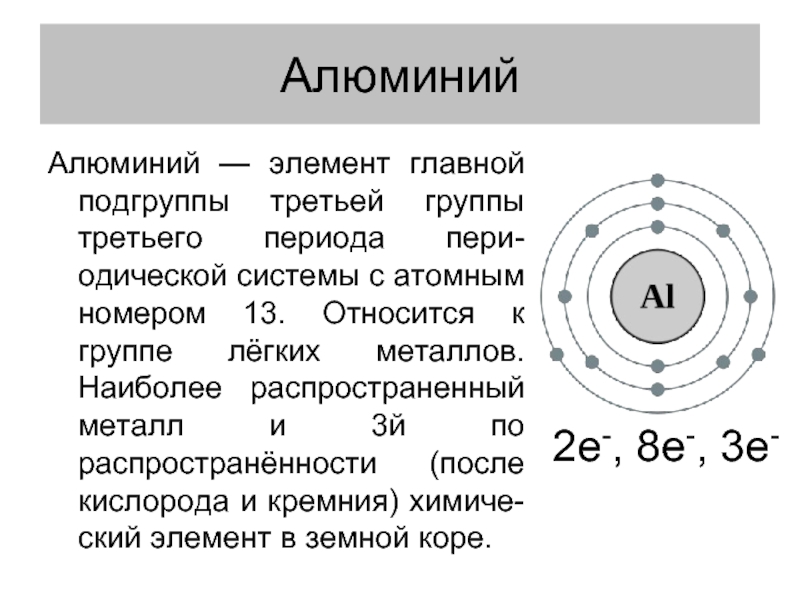
Слайд 2Алюминий
Алюминий — элемент главной подгруппы третьей группы третьего периода пери-одической системы
с атомным номером 13. Относится к группе лёгких металлов. Наиболее распространенный металл и 3й по распространённости (после кислорода и кремния) химиче-ский элемент в земной коре.
2e-, 8e-, 3e-
Слайд 3Нахождение в природе
Бокситы — Al2O3 • H2O
Алуниты — KAl(SO4)2 •
2Al(OH)3
Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
Корунд — Al2O3
Полевой шпат (ортоклаз) —K2O×Al2O3×6SiO2
Каолинит — Al2O3×2SiO2 × 2H2O
Алунит — (Na,K)2SO4×Al2(SO4)3×4Al(OH)3
Берилл — 3ВеО • Al2О3 • 6SiO2
Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
Корунд — Al2O3
Полевой шпат (ортоклаз) —K2O×Al2O3×6SiO2
Каолинит — Al2O3×2SiO2 × 2H2O
Алунит — (Na,K)2SO4×Al2(SO4)3×4Al(OH)3
Берилл — 3ВеО • Al2О3 • 6SiO2
Слайд 4Химические свойства
При нормальных условиях алюминий покрыт оксидной плёнкой и потому не
реагирует с классическими окислителями.
Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной индустрией.
Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной индустрией.
Слайд 5
Горение в кислороде воздуха
Химические свойства
Легко реагирует с простыми веществами:
с кислородом:
4Al
+ 3O2 = 2Al2O3
с галогенами:
2Al + 3Br2 = 2AlBr3
с галогенами:
2Al + 3Br2 = 2AlBr3
Слайд 6Химические свойства
C другими неметаллами реагирует при нагревании:
с серой, образуя сульфид
алюминия:
2Al + 3S = Al2S3
с азотом, образуя нитрид алюминия:
2Al + N2 = 2AlN
с углеродом, образуя карбид алюминия:
4Al + 3С = Al4С3
2Al + 3S = Al2S3
с азотом, образуя нитрид алюминия:
2Al + N2 = 2AlN
с углеродом, образуя карбид алюминия:
4Al + 3С = Al4С3
Слайд 7Химические свойства
Со сложными веществами:
с водой (после удаления защитной пленки, например, растворами
щёлочи):
2Al + 6H2O = 2Al(OH)3 + 3H2
со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов):
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
2Al + 6H2O = 2Al(OH)3 + 3H2
со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов):
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Слайд 8Химические свойства
Соляная и разбавленная серная кислота:
2Al + 6HCl = 2AlCl3
+ 3H2
При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия:
2Al + 6H2SO4(конц) = Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3 (конц) = Al(NO3)3 + 3NO2 + 3H2O
восстанавливает металлы из их оксидов (алюминотермия):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия:
2Al + 6H2SO4(конц) = Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3 (конц) = Al(NO3)3 + 3NO2 + 3H2O
восстанавливает металлы из их оксидов (алюминотермия):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
Слайд 9Оксид алюминия
Al2O3 — в природе распространён как глинозём. Бесцветные нерастворимые в
воде кристаллы. Амфотерный оксид.
Практически не растворим в кислотах. Растворяется в горячих растворах и расплавах щелочей.
Получают из бокситов и других алюминесодержащих руд:
2Al(OH)3 = Al2O3 + 3H2O (при t выше 575° C)
Реагирует с щелочами:
Al2O3 + 2NaOH = NaAl2O + 2H2O
и кислотами.
Практически не растворим в кислотах. Растворяется в горячих растворах и расплавах щелочей.
Получают из бокситов и других алюминесодержащих руд:
2Al(OH)3 = Al2O3 + 3H2O (при t выше 575° C)
Реагирует с щелочами:
Al2O3 + 2NaOH = NaAl2O + 2H2O
и кислотами.
Слайд 10Гидроксид алюминия
Al(OH)3 – белое студенистое вещество, плохо растворимое в воде, обладает
амфотерными свойствами.
Получают при взаимодействии солей алюминия с водными растворами щёлочи.
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Реагирует с:
кислотами: Al(OH)3 + HCl → AlCl3 + 3H2O
щёлочами: Al(OH)3 + NaOH = Na[Al(OH)4] = NaAl2O + 2H2O
Получают при взаимодействии солей алюминия с водными растворами щёлочи.
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Реагирует с:
кислотами: Al(OH)3 + HCl → AlCl3 + 3H2O
щёлочами: Al(OH)3 + NaOH = Na[Al(OH)4] = NaAl2O + 2H2O
Слайд 11Обобщение
оксиды получают косвенным путём
оксиды получают путём реакции с O2
реакция идёт с
водой при обычных условиях
реакция идёт с водой только при удалении оксидной плёнки
при реакции с водой образуется гидроксид и выделяется водород
оксид – основание
оксид – амфотерные основание
гидроксиды реагируют с водой
восстанавливает металлы из их оксидов
реакция идёт с водой только при удалении оксидной плёнки
при реакции с водой образуется гидроксид и выделяется водород
оксид – основание
оксид – амфотерные основание
гидроксиды реагируют с водой
восстанавливает металлы из их оксидов
Слайд 16Вопросы
Почему алюминий не паяют на воздухе?
Какие степени окисления характерны
для алюминия?
На атом какого благородного газа похож ион Al3+?
Напишите реакции алюминия с: йодом, водой, серой, гидроксидом натрия, соляной кислотой, углеродом, оксидом хрома(III).
Осуществите превращения:
Al2O3 → Al → Al2(SO4)3 → Al(OH)3 → Al2O3
На атом какого благородного газа похож ион Al3+?
Напишите реакции алюминия с: йодом, водой, серой, гидроксидом натрия, соляной кислотой, углеродом, оксидом хрома(III).
Осуществите превращения:
Al2O3 → Al → Al2(SO4)3 → Al(OH)3 → Al2O3