- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Московский Государственный Университет имени М. В. Ломоносова Химический факультет Кафедра химии природных соединений Лаборатория им. О.А. Донцовой Матвеев Андрей Максимович Курсовая работа: Поиск новых антибиотиков, замедляющих трансляцию, в культураль презентация
Содержание
- 1. Московский Государственный Университет имени М. В. Ломоносова Химический факультет Кафедра химии природных соединений Лаборатория им. О.А. Донцовой Матвеев Андрей Максимович Курсовая работа: Поиск новых антибиотиков, замедляющих трансляцию, в культураль
- 2. ЦЕЛЬЮ НАШЕЙ РАБОТЫ ЯВЛЯЛСЯ ПОИСК НОВЫХ ПОТЕНЦИАЛЬНЫХ
- 3. Александр Флеминг обнаружил антибактериальную активность пенициллиновых грибов
- 4. Методы поиска новых антибиотиков
- 5. Недостатки стандартного способа проверки антибактериальной активности
- 6. Механизмы действия антибиотиков на рибосому
- 7. Готовая плазмида обладает следующими характеристиками: •
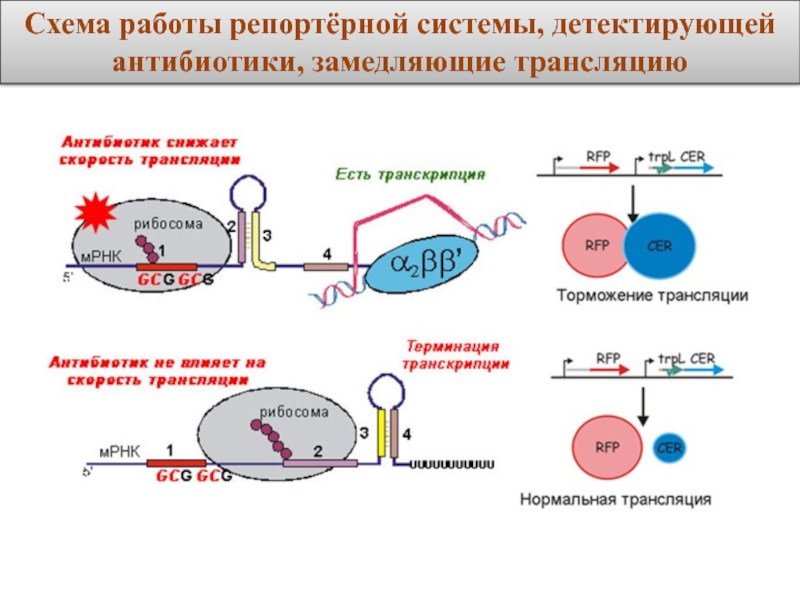
- 8. Схема работы репортёрной системы, детектирующей антибиотики, замедляющие трансляцию
- 9. Трансформация компетентных клеток E. coli.
- 10. Приготовление ночной культуры.
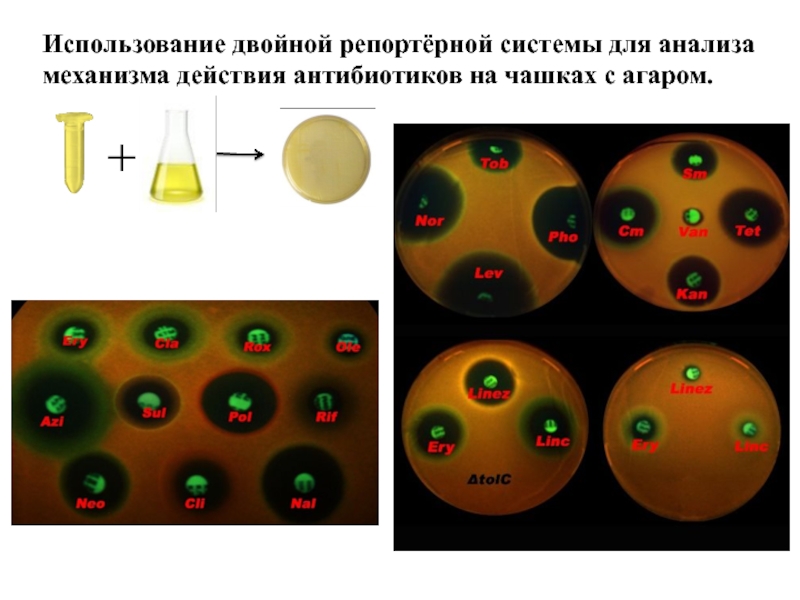
- 11. Использование двойной репортёрной системы для анализа механизма действия антибиотиков на чашках с агаром.
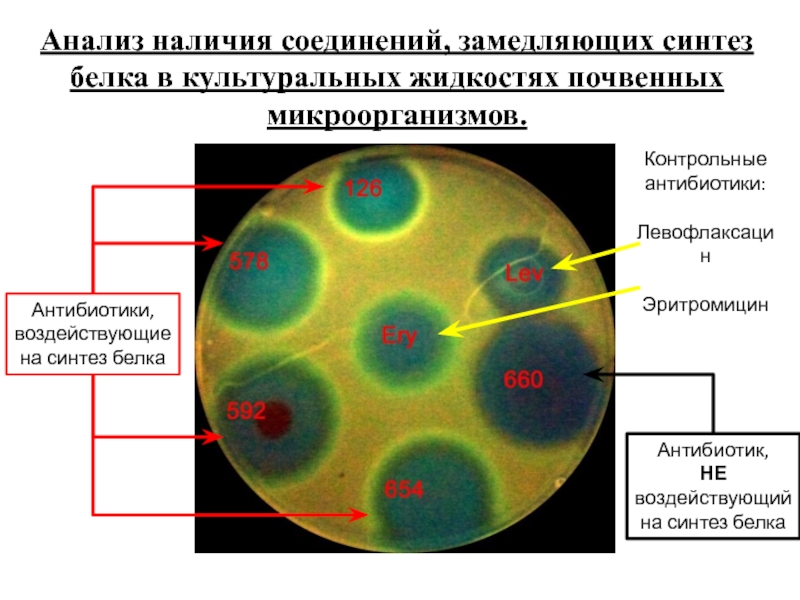
- 12. Анализ наличия соединений, замедляющих синтез белка в
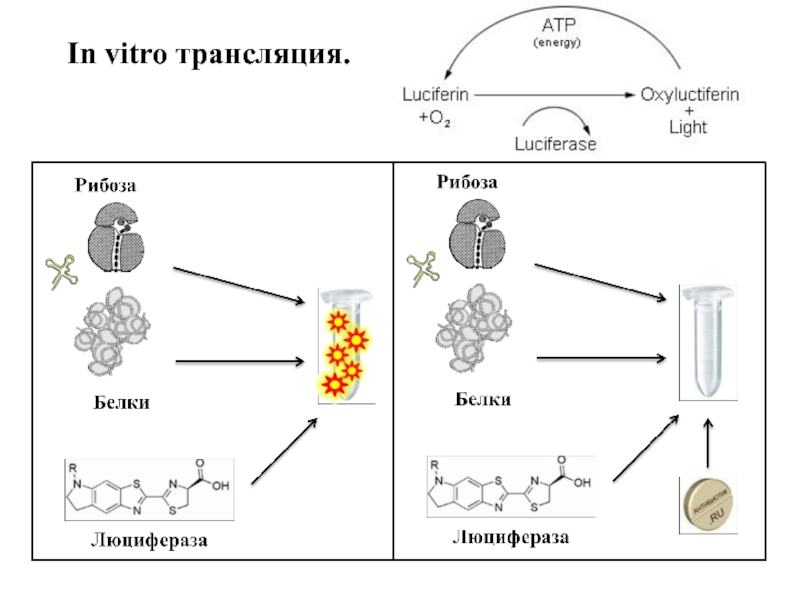
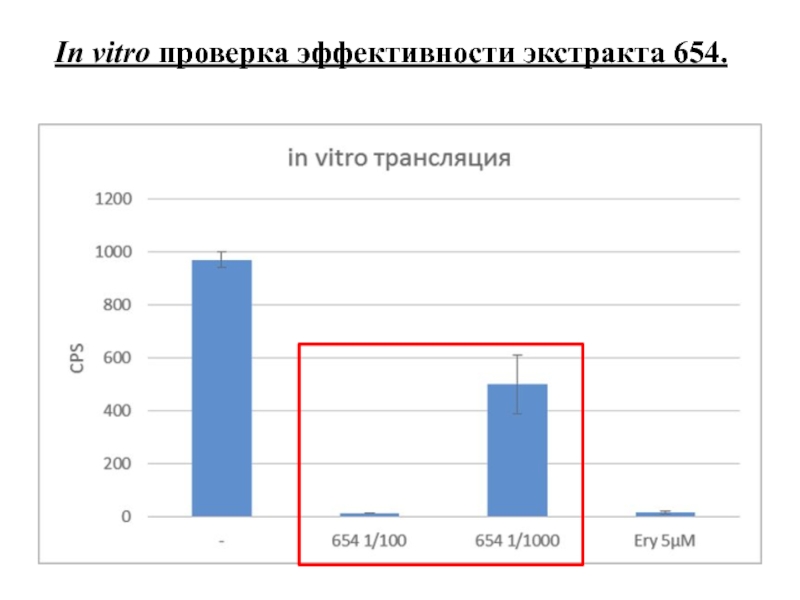
- 13. In vitro трансляция.
- 14. In vitro проверка эффективности экстракта 654.
- 15. С использованием метода определения механизма
- 16. 1) Трансформация компетентных клеток E. coli. Пробирку
- 17. 1) Boucher H.W., Talbot G.H., Bradley
- 18. Спасибо за внимание!
Слайд 1Московский Государственный Университет
имени М. В. Ломоносова
Химический факультет
Кафедра химии природных соединений
Лаборатория им.
Матвеев Андрей Максимович
Курсовая работа:
Поиск новых антибиотиков, замедляющих трансляцию, в культуральных жидкостях почвенных микроорганизмов.
Научный руководитель:
к.х.н. Остерман И. А.
Москва ― 2015
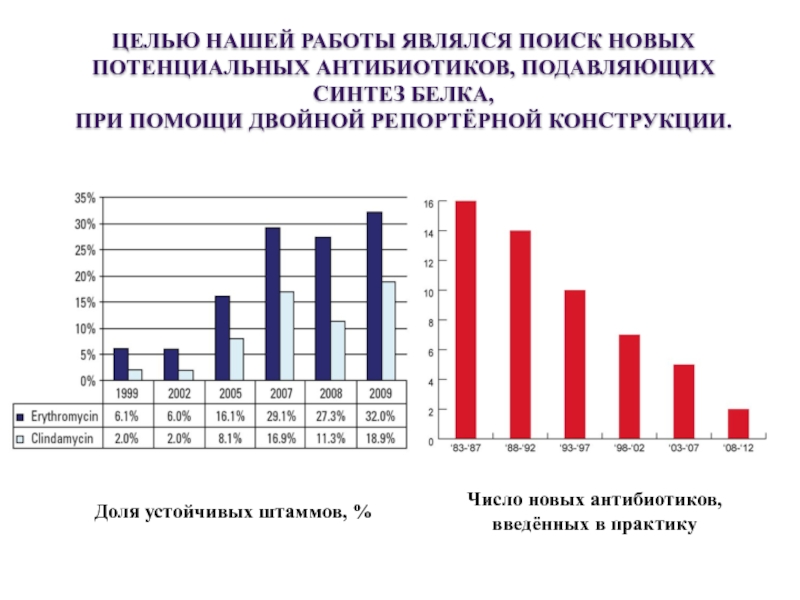
Слайд 2ЦЕЛЬЮ НАШЕЙ РАБОТЫ ЯВЛЯЛСЯ ПОИСК НОВЫХ ПОТЕНЦИАЛЬНЫХ АНТИБИОТИКОВ, ПОДАВЛЯЮЩИХ СИНТЕЗ БЕЛКА,
ПРИ ПОМОЩИ ДВОЙНОЙ РЕПОРТЁРНОЙ КОНСТРУКЦИИ.
Доля устойчивых штаммов, %
Число новых антибиотиков,
введённых в практику
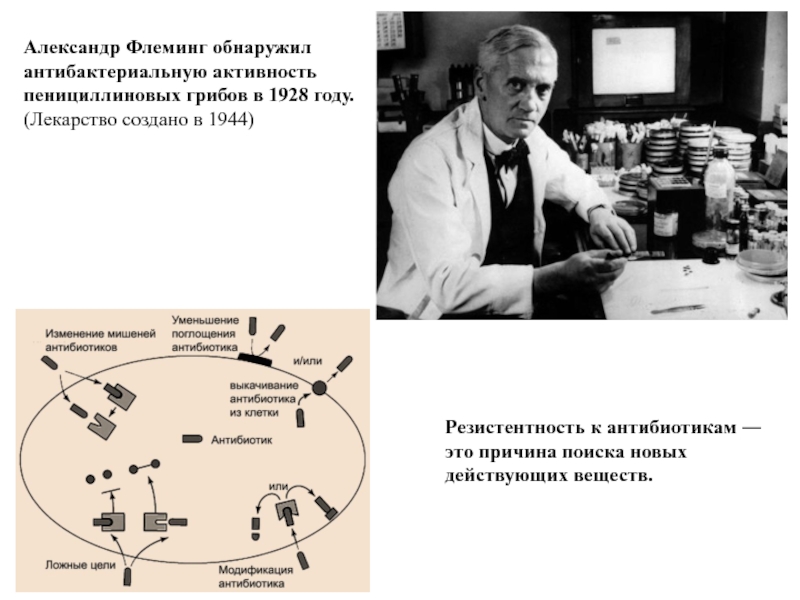
Слайд 3Александр Флеминг обнаружил антибактериальную активность пенициллиновых грибов в 1928 году.
(Лекарство создано
Резистентность к антибиотикам ― это причина поиска новых действующих веществ.
Слайд 5 Недостатки стандартного способа проверки антибактериальной активности (измерения уровня ингибирования клеточного
невозможно определить механизм действия антибиотика
необходимы большие концентрации антибиотика, чтобы увидеть заметное снижение роста
Недостатки прочих методов для определения механизма:
большинство из них требует in vitro экспериментов и слишком сложны для широкомасштабного поиска.
Недостатки стандартных методов поиска новых антибиотиков
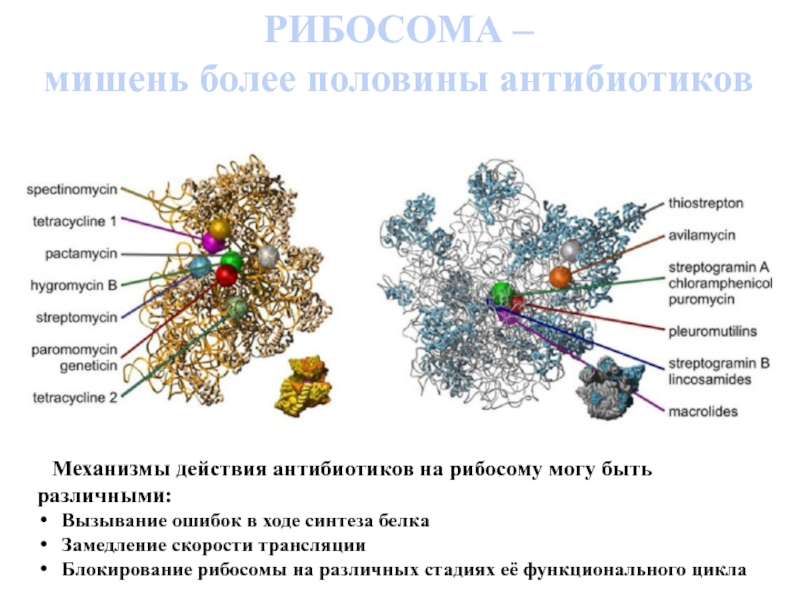
Слайд 6 Механизмы действия антибиотиков на рибосому могу быть различными:
Вызывание ошибок
Замедление скорости трансляции
Блокирование рибосомы на различных стадиях её функционального цикла
РИБОСОМА –
мишень более половины антибиотиков
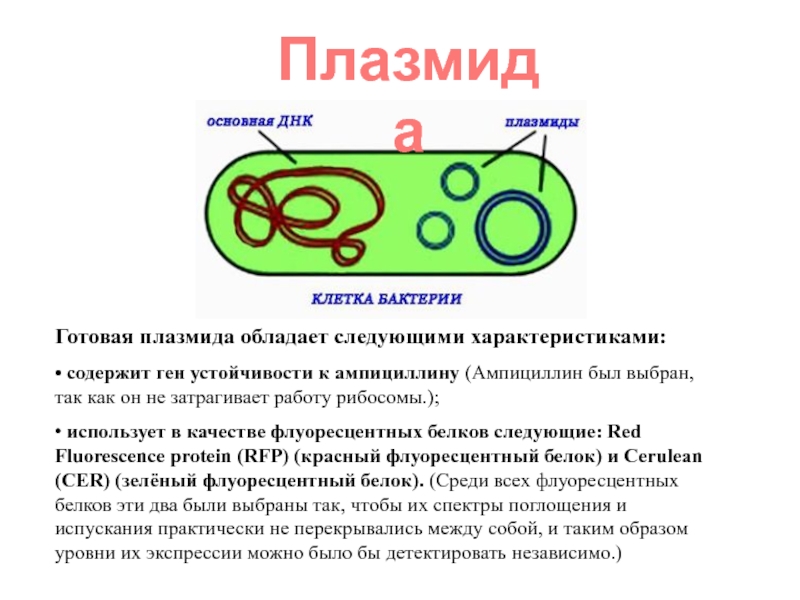
Слайд 7Готовая плазмида обладает следующими характеристиками:
• содержит ген устойчивости к ампициллину (Ампициллин
• использует в качестве флуоресцентных белков следующие: Red Fluorescence protein (RFP) (красный флуоресцентный белок) и Cerulean (CER) (зелёный флуоресцентный белок). (Среди всех флуоресцентных белков эти два были выбраны так, чтобы их спектры поглощения и испускания практически не перекрывались между собой, и таким образом уровни их экспрессии можно было бы детектировать независимо.)
Плазмида
Слайд 11Использование двойной репортёрной системы для анализа механизма действия антибиотиков на чашках
Слайд 12Анализ наличия соединений, замедляющих синтез белка в культуральных жидкостях почвенных микроорганизмов.
Контрольные
Левофлаксацин
Эритромицин
Антибиотики, воздействующие на синтез белка
Антибиотик,
НЕ
воздействующий на синтез белка
Слайд 15 С использованием метода определения механизма действия антибиотиков была детектирована
Для образца 654 получено подтверждение ингибирования трансляции в системе in vitro.
Вывод
Слайд 161) Трансформация компетентных клеток E. coli.
Пробирку с компетентными клетками размораживали во
2) Приготовление ночной культуры.
Добавляли одну колонию с чашки с трансформированными клетками в 2 мл среды LB с ампициллином. Ставили в термостат на 16 часов на 37 С при постоянном вращении 200 об/мин.
3) Использование двойной репортёрной системы для анализа механизма действия антибиотиков на чашках с агаром.
Ночную культуру штамма ΔtolC, трансформированных плазмидами pRFPCER-TrpL2A, разбавляли в два раза свежей средой LB и выливали на чашки с агаром, средой LB и ампициллином (50 мкг/мл). Затем на поверхность высохших чашек делали углубления диаметром 5 мм, потом наносили образцы (50 мкл экстрактов, (ery) эритромицин ― 50 мкл раствора 0,1 мг/мл, (lev) левофлаксацин 50 мкл 0.1 мкг/мл). После культивирования в течение ночи при 37 С при постоянном вращении 200 об/мин полученные чашки документировались при помощи цифровой камеры при освещении их ультрафиолетом (254 нм).
4) In vitro трансляция.
Для in vitro трансляции использовали мРНК люцеферазы сверчка, S30 экстракт E. coli. Активность синтезированной люцеферазы определяли через 10 минут.
Слайд 171) Boucher H.W., Talbot G.H., Bradley J.S. et al. Bad
2) Остерман И. А. Новая система для широкомасштабного анализа сайтов инициации и реинициации трансляции Escherichia coli. Дис….канд. хим. наук. Москва: МГУ им. М. В. Ломоносова, 2012.110 с.
3) Overbye K.M., Barrett J.F. Today Antibiotics: where did we go wrong? // Drug Discov. 2005. V. 10. P. 45–52.
4) Bax R.P., Anderson R., Crew J. et al. Antibiotic resistance–what can we do? // Nat. Med. 1998. V. 4. P. 545–546.
5) Coates A.,Yanmin H., Bax R. et al. The future challenges facing the development of new antimicrobial drugs // Nat. Rev. Drug Discov. 2002. V. 1. P. 895–910.
6) Osterman I.A., Prokhorova I.V., Sysoev V.O., Boykova YV, Efremenkova O.V., Svetlov M.S., Kolb V.A., Bogdanov A.A., Sergiev P.V., and Dontsova O.A. Attenuation-based dual-fluorescent-protein reporter for screening translation inhibitors. // Antimicrob Agents Chemother. 2012 56, №4, p. 1774-83.
7) Svetlov, M.S., A. Kommer, V.A. Kolb, and A.S. Spirin, Effective cotranslational folding of firefly luciferase without chaperones of the Hsp70 family. Protein Sci, 2006. 15(2): p. 242-7.
Изображения взяты из Яндекс Картинки и Википедии.
Источники: