- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Знание только тогда знание, когда оно приобретено усилиями своей мысли, а не памятью. Л.Н.Толстой презентация
Содержание
- 1. Знание только тогда знание, когда оно приобретено усилиями своей мысли, а не памятью. Л.Н.Толстой
- 3. Терминология Степень окисления Окислительно-восстановительные реакции (ОВР) Окисление Восстановление Окислитель Восстановитель
- 4. Степень окисления – это условный
- 5. Определите степень окисления элементов S
- 6. Окислительно-восстановительной не является реакция
- 7. Окислительно-восстановительной является реакция, уравнение которой
- 8. Реакция, уравнение которой 4NH3 +5O
- 9. Установите соответствие между изменением степени окисления атома
- 10. Установите соответствие между схемой превращения и изменением
- 11. Согласно схеме N+5 + ne- →
- 12. Сами, трудясь, вы сделаете все для близких
- 13. Смесь бертолетовой соли с красным фосфором K Cl O3 + P
- 14. K Cl O3 + P
- 15. МЕТОД ЭЛЕКТРОННОГО БАЛАНСА Записать схему реакции
- 16. Расставьте коэффициенты в следующих схемах реакций методом
Слайд 1 Знание только тогда знание, когда оно приобретено усилиями своей мысли, а
Л.Н.Толстой
Слайд 3Терминология
Степень окисления
Окислительно-восстановительные реакции (ОВР)
Окисление
Восстановление
Окислитель
Восстановитель
Слайд 4 Степень окисления – это условный заряд атомов химического элемента
Окислительно-восстановительные реакции – реакции, в ходе которых изменяются степени окисления элементов вследствие перехода электронов от восстановителя к окислителю.
Окисление(о-ние) – процесс отдачи электронов атомом, молекулой или ионом, степень окисления элемента повышается.
Восстановление(в-ние) – процесс приема электронов атомом, молекулой или ионом, степень окисления элемента понижается.
Окислитель (о-ль)– вещество, содержащее атомы или ионы, принимающие электроны.
Восстановитель(в-ль) – вещество, содержащее атомы или ионы, отдающие электроны.
Слайд 6Окислительно-восстановительной
не является реакция
1) 2Na + Cl2 = 2NaCl
2)
4) S+O2=SO2
Слайд 7
Окислительно-восстановительной является реакция, уравнение которой
1) CaCO3 + SiO2= CaSiO3 + CO2
2)
3) CuCl2 + Fe = FeCl2 + Cu
4) CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4
Слайд 8Реакция, уравнение которой
4NH3 +5O 2 → 4NO + 6H2O
соответствует схема
1) N+3 → N+2 3) N+3 → N-3
2) N-3 → N-2 4) N-3 → N+2
Слайд 9Установите соответствие между изменением степени окисления атома серы и схемой превращения
СХЕМА ПРЕВРАЩЕНИЙ
A) H2S + O2 → SO2 + H2O
Б) H2SO4 + Na → Na2SO4 + H2S + H2O
В) SO2 + Br2 + H2O → H2SO4 + HBr
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ
1) Э+4 → Э+6
2) Э+6 → Э-2
3) Э+6 → Э+4
4) Э-2 → Э+6
5) Э-2 → Э+4
Слайд 10Установите соответствие между схемой превращения и изменением степени окисления окислителя в
СХЕМА ПРЕВРАЩЕНИЙ
A) Cl2 + K2MnO4 → KMnO4 + KCl
Б) NH4Cl + KNO3 → KCl + N2O + H2O
В) HI + FeCl3 → FeCl2 + HCl + I2
ИЗМЕНЕНИЕ СТЕПЕНИ
ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
1) Э+6 → Э+7
2) Э+5 → Э+1
3) Э+3 → Э+2
4) Э0 → Э-1
5) Э-1 → Э0
Слайд 12Сами, трудясь, вы сделаете все для близких людей и для себя,
Слайд 14 K Cl O3 + P = K Cl + P
K +1Cl +5O-23 + P0 = K +1Cl -1 + P +52O-25
Cl +5 +6e → Cl -1 5 - окислитель, восстановление
P0 -5e → P +5 6 - восстановитель, окисление
5 K Cl O3 + 6P0 = 5K Cl + 3P 2O5
Слайд 15МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Записать схему реакции
Определить СО элементов
Определить число отданных
и принятых
Составить электронный баланс
Определить коэффициенты
Перенести коэффициенты в уравнение реакции
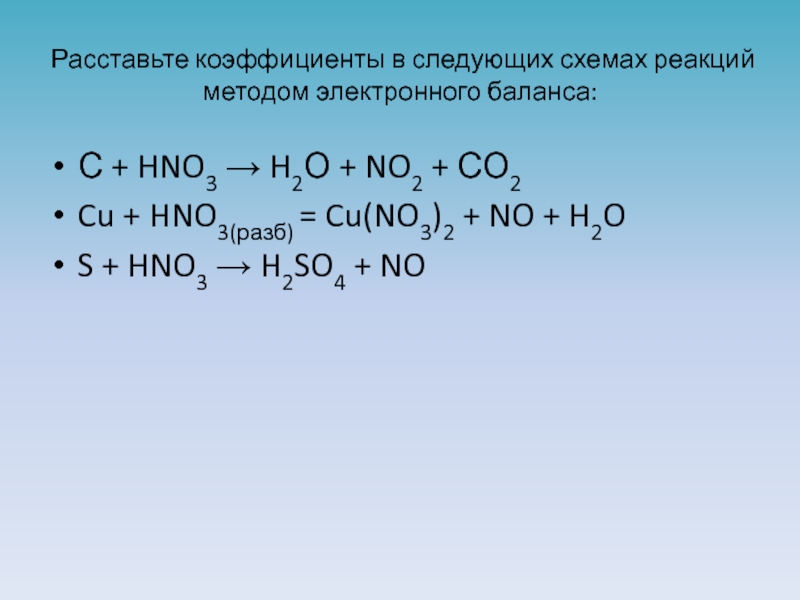
Слайд 16Расставьте коэффициенты в следующих схемах реакций методом электронного баланса:
С + HNO3
Cu + HNO3(разб) = Cu(NO3)2 + NO + H2O
S + HNO3 → H2SO4 + NO