- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Сложные вещества. Бинарные соединения. 8 класс презентация
Содержание
- 1. Сложные вещества. Бинарные соединения. 8 класс
- 2. Цель : уметь составлять формулы неорганических соединений
- 3. Вещества, состоящие из двух элементов, называются бинарными
- 4. Алгоритм (1) составления формул бинарных соединений
- 6. Алгоритм (2) определения степени окисления элементов в
- 7. Пример: Дано: SO3.
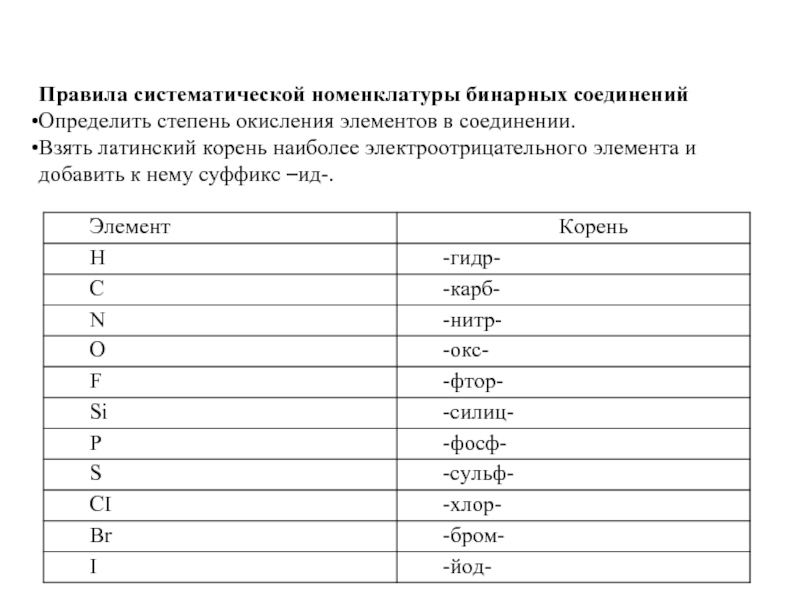
- 8. Правила систематической номенклатуры бинарных соединений Определить степень
Слайд 2Цель : уметь составлять формулы неорганических соединений изученных классов; определять валентность
и степень окисления элемента в соединениях; называть соединения изученных классов
Слайд 3Вещества, состоящие из двух элементов, называются бинарными соединениями.
Валентность – число химических
связей, которое атом может образовать с другими атомами. Валентность равна числу неспаренных электронов в атоме. Валентность обозначается римскими цифрами.
Степень окисления – число электронов, смещенных к атому (-n) или от атома (+n).
Степень окисления – число электронов, смещенных к атому (-n) или от атома (+n).
Слайд 4Алгоритм (1) составления формул бинарных соединений
Определить более электроотрицательный элемент по
ряду электроотрицательности. Неметалл всегда электроотрицательнее металла.
Более электроотрицательный элемент пишется в формуле правее, менее элекроотрицательный – левее.
Над более элекроотрицательным элементом ставится его степень окисления, равная № группы – 8.
Над менее электроотрицательным элементом ставится его степень окисления, указанная в названии вещества, или равна + номер группы.
Модули степеней окисления сносятся крест-накрест.
Полученные индексы сокращаются, если это нужно.
Более электроотрицательный элемент пишется в формуле правее, менее элекроотрицательный – левее.
Над более элекроотрицательным элементом ставится его степень окисления, равная № группы – 8.
Над менее электроотрицательным элементом ставится его степень окисления, указанная в названии вещества, или равна + номер группы.
Модули степеней окисления сносятся крест-накрест.
Полученные индексы сокращаются, если это нужно.
Слайд 5
Пример:
Даны Si и О.
О –
более электроотрицателен.
SiO
Степень окисления кислорода равна 6-8=-2 ( SiO-2)
4. Степень окисления кремния равна +4 (Si +4O-2)
5. Si 2+4O4-2 ( сокращаем индексы)
6. Si O2
SiO
Степень окисления кислорода равна 6-8=-2 ( SiO-2)
4. Степень окисления кремния равна +4 (Si +4O-2)
5. Si 2+4O4-2 ( сокращаем индексы)
6. Si O2
Слайд 6Алгоритм (2) определения степени окисления элементов в бинарных соединениях
Выбрать более электроотрицательный
элемент и найти его степень окисления, как номер группы – 8. Написать над ним степень окисления.
Умножить степень окисления на индекс у этого элемента. Полученное число со знаком «минус» подписать под этим элементом.
Такое же число со знаком «+» подписать под другим элементом.
Разделить это число на индекс другого элемента. Полученную степень окисления написать над элементом.
Умножить степень окисления на индекс у этого элемента. Полученное число со знаком «минус» подписать под этим элементом.
Такое же число со знаком «+» подписать под другим элементом.
Разделить это число на индекс другого элемента. Полученную степень окисления написать над элементом.
Слайд 7Пример:
Дано: SO3.
Более электроотрицателен кислород (О).
Его степень окисления
равна 6-8 = -2. SO-2 3
SO3-2 -6
S +6O3-2 -6
S+6+6O3-2 -6
SO3-2 -6
S +6O3-2 -6
S+6+6O3-2 -6
Слайд 8Правила систематической номенклатуры бинарных соединений
Определить степень окисления элементов в соединении.
Взять латинский
корень наиболее электроотрицательного элемента и добавить к нему суффикс –ид-.