Геннадьевна
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Натрий. Его биологическая роль презентация
Содержание
- 1. Натрий. Его биологическая роль
- 2. Натрий — элемент главной подгруппы первой группы,
- 3. История и происхождение названия
- 4. История и происхождение названия Аббревиатура «Na» и
- 5. Натрий и организм человека Основной ион в
- 6. Пищевые источники и суточная потребность Натрий
- 7. Натрий - калиевый насос - это особый
- 8. Избыток Приём большого количества натрия опасен и
- 9. Важнейшие биологические функции натрия: Главная
- 10. Эмиссионный спектр
- 11. Меры предосторожности В лабораториях небольшие количества натрия
- 12. Меры предосторожности Натрий берут пинцетом или щипцами,
- 13. Меры предосторожности Воспламенение и даже взрыв металлического
- 14. Спасибо за внимание
Слайд 1Натрий.
Его биологическая роль
Выполнила:
студентка 1 курса 4 группы педиатрического факультета
Архипова Алина
Слайд 2Натрий
— элемент главной подгруппы первой группы, третьего периода периодической системы химических
элементов Д. И. Менделеева, с порядковым номером 11. Обозначается символом Na (лат. Natrium), мягкий щелочной металл серебристо-белого цвета.
Слайд 3 История и происхождение названия
Натрий (а точнее, его соединения)
известен и использовался с давних времён. Еврейское слово neter (греч. νίτρον, лат. nitrum) встречается уже в Библии как название вещества, которое, по Соломону, вскипает с уксусом. Сода (натрон), встречается в природе в водах натронных озёр в Египте.
Природную соду древние египтяне использовали для бальзамирования, отбеливания холста, при варке пищи, изготовлении красок и глазурей. Плиний Старший пишет, что в дельте Нила соду (в ней была достаточная доля примесей) выделяли из речной воды. Она поступала в продажу в виде крупных кусков, из-за примеси угля окрашенных в серый или даже чёрный цвет.
Название «натрий» происходит от латинского слова natrium, которое было заимствовано из среднеегипетского языка (nṯr), где оно означало среди прочего: «сода», «едкий натр».
Природную соду древние египтяне использовали для бальзамирования, отбеливания холста, при варке пищи, изготовлении красок и глазурей. Плиний Старший пишет, что в дельте Нила соду (в ней была достаточная доля примесей) выделяли из речной воды. Она поступала в продажу в виде крупных кусков, из-за примеси угля окрашенных в серый или даже чёрный цвет.
Название «натрий» происходит от латинского слова natrium, которое было заимствовано из среднеегипетского языка (nṯr), где оно означало среди прочего: «сода», «едкий натр».
Слайд 4История и происхождение названия
Аббревиатура «Na» и слово natrium были впервые использованы
академиком, основателем шведского общества врачей Йенсом Якобсом Берцелиусом (Jöns Jakob Berzelius, 1779—1848) для обозначения природных минеральных солей, в состав которых входила сода. Ранее элемент именовался содием (лат. sodium). Название sodium, возможно, восходит к арабскому слову suda, означающему «головная боль», так как сода применялась в то время в качестве лекарства от головной боли.
Натрий впервые был получен английским химиком Хемфри Дэви, который сообщил об этом 19 ноября 1807 года в Бэкеровской лекци (в рукописи лекции Дэви указал, что он открыл калий 6 октября 1807 года, а натрий — через несколько дней после калия), электролизом расплава гидроксида натрия.
Натрий впервые был получен английским химиком Хемфри Дэви, который сообщил об этом 19 ноября 1807 года в Бэкеровской лекци (в рукописи лекции Дэви указал, что он открыл калий 6 октября 1807 года, а натрий — через несколько дней после калия), электролизом расплава гидроксида натрия.
Слайд 5Натрий и организм человека
Основной ион в организме человека - он представлен
во внеклеточных жидкостях в них содержится 96 % от общего количества натрия в организме (в сыворотке крови 143 ммоль/кг, эритроцитах – около 10 ммоль/кг) . Нормальная концентрация Na в плазме крови - 135-145 ммоль/л; она поддерживается с высокой точностью, поскольку определяет осмолярность плазмы и водный обмен.
Уровень Na в крови регулируется гормонами: АДГ и НУФ способствуют его снижению, альдостерон - увеличению. Обычное потребление человеком NaCl составляет 8-15 г/сут, хотя реальная потребность организма в натрии несколько меньше.
Избыток Na выводится через почки и потовые железы; потеря натрия через кишечник может наблюдаться при диареях.
Уровень Na в крови регулируется гормонами: АДГ и НУФ способствуют его снижению, альдостерон - увеличению. Обычное потребление человеком NaCl составляет 8-15 г/сут, хотя реальная потребность организма в натрии несколько меньше.
Избыток Na выводится через почки и потовые железы; потеря натрия через кишечник может наблюдаться при диареях.
Слайд 6Пищевые источники и суточная потребность
Натрий содержится практически во всех продуктах
питания в количестве 15-80 мг на 100 г, однако наибольшее количество натрия человек получает с поваренной солью (хлоридом натрия).
Для взрослого человека составляет 4-6 г. Потребность существенно возрастает при обильном потоотделении, в условиях жаркого климата, повышенном потреблении воды или физических нагрузках.
Снижают количество натрия при гипертонии, ревматизме, нагноительных процессах в лёгких, ожирении, переломах костей, приёме гормональных препаратов, заболеваниях почек, печени, поджелудочной железы, некоторых болезнях желудка.
Для взрослого человека составляет 4-6 г. Потребность существенно возрастает при обильном потоотделении, в условиях жаркого климата, повышенном потреблении воды или физических нагрузках.
Снижают количество натрия при гипертонии, ревматизме, нагноительных процессах в лёгких, ожирении, переломах костей, приёме гормональных препаратов, заболеваниях почек, печени, поджелудочной железы, некоторых болезнях желудка.
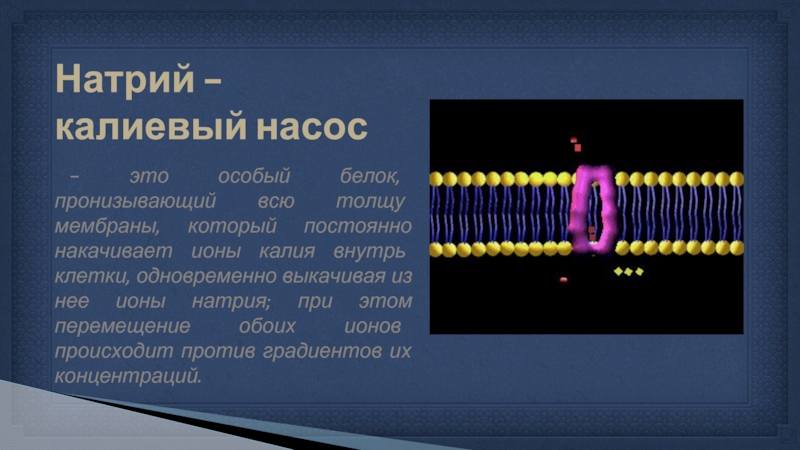
Слайд 7Натрий - калиевый насос
- это особый белок, пронизывающий всю толщу мембраны,
который постоянно накачивает ионы калия внутрь клетки, одновременно выкачивая из нее ионы натрия; при этом перемещение обоих ионов происходит против градиентов их концентраций.
Слайд 8Избыток
Приём большого количества натрия опасен и может вызвать серьёзные осложнения, потому
что почки не успевают его перерабатывать: появляется отёк лица и ног, перегружается сердце, повышается кровяное давление и происходит большая потеря калия.
В таких случаях резко ограничивают в рационе питания количество поваренной соли (придерживаются «бессолевой диеты»), когда суточная доза хлорида натрия ограничена содержанием в продуктах 0,5-3 г в сутки.
В таких случаях резко ограничивают в рационе питания количество поваренной соли (придерживаются «бессолевой диеты»), когда суточная доза хлорида натрия ограничена содержанием в продуктах 0,5-3 г в сутки.
Слайд 9
Важнейшие биологические функции натрия:
Главная роль в поддержании осмолярности плазмы крови и
внеклеточной жидкости в целом;
Участие (совместно с калием) в возникновении электрохимического потенциала на плазматических мембранах клеток, обеспечение их возбудимости и мембранного транспорта;
Стабилизация молекул белков и ферментов, обеспечение протекания ряда ферментативных реакций;
Совместно с калием предотвращает обезвоживание, регулируя водный баланс.
Участие (совместно с калием) в возникновении электрохимического потенциала на плазматических мембранах клеток, обеспечение их возбудимости и мембранного транспорта;
Стабилизация молекул белков и ферментов, обеспечение протекания ряда ферментативных реакций;
Совместно с калием предотвращает обезвоживание, регулируя водный баланс.
Слайд 11Меры предосторожности
В лабораториях небольшие количества натрия (примерно до 1 кг) хранят
в закрытых стеклянных банках под слоем керосина, так, чтобы керосин покрывал весь металл. Банка с натрием должна храниться в металлическом несгораемом шкафу (сейфе).
Слайд 12Меры предосторожности
Натрий берут пинцетом или щипцами, отрезают скальпелем (натрий пластичен и
легко режется ножом) на сухой поверхности (не на столе, а в стеклянной чашке) необходимое количество и остаток тут же возвращают в банку под слой керосина, а отрезанный кусок либо помещают в сухой керосин, либо тут же вводят в реакцию. Обычно в лабораторных условиях для реакций используют количества натрия, не превышающие нескольких десятков граммов. После работы с металлическим натрием всю посуду и остатки натрия заливают неразбавленным спиртом и полученный раствор нейтрализуют слабым раствором кислоты. Следует обратить особое внимание на то, чтобы все остатки и обрезки натрия были полностью нейтрализованы до их выбрасывания, так как натрий в мусорном ведре может вызвать пожар, а в канализационном сливе может вызвать разрушение трубы. Хранить натрий дома и производить с ним какие-либо опыты не рекомендуется.
Слайд 13Меры предосторожности
Воспламенение и даже взрыв металлического натрия при соприкосновении с водой
и многими органическими соединениями может причинить серьёзные травмы и ожоги. Попытка взять кусочек металлического натрия голыми руками может привести к его воспламенению (иногда взрыву) из-за влажности кожи и образованию тяжелейших ожогов натрием и образующейся щелочью. Горение натрия создает аэрозоль оксида, пероксида и гидроксида натрия, обладающего разъедающим действием. Некоторые реакции натрия протекают очень бурно (например, с серой, бромом).