- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Водородная, в том числе сероводородная, энергетика презентация
Содержание
- 1. Водородная, в том числе сероводородная, энергетика
- 2. История открытия водорода Распространенность водорода
- 3. Водород - топливо будущего. История Родился
- 4. Антуан Лоран Лавуазье Antoine Laurent de Lavoisier
- 5. Происхождение названия Лавуазье дал водороду название hydrogène
- 7. Массовая доля водорода в земной коре составляет
- 8. Изотопы водорода Физические, химические энергетические свойства водорода
- 9. Свойства атома водорода Плотность вероятности для электрона при различных значениях главного квантового числа n
- 10. Свойства молекулы водорода а – фазы
- 11. Свойства водорода
- 12. Характеристики водорода в различных агрегатных состояниях
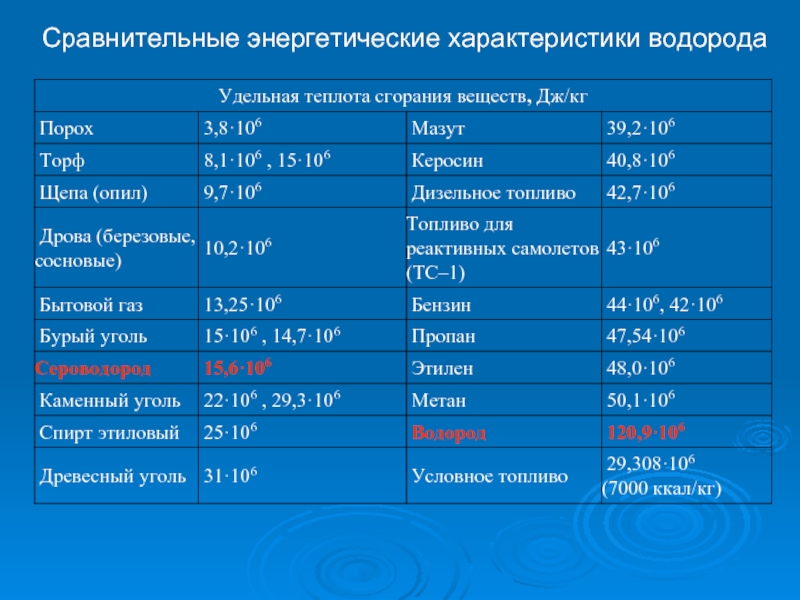
- 13. Сравнительные энергетические характеристики водорода
- 14. При сжигании или в присутствии платинового катализатора
- 15. При нагревании водород обратимо взаимодействует с серой:
- 16. С азотом — при нагревании, повышенном давлении
- 17. Реакция с фтором протекает со взрывом в
- 18. При сильном нагревании взаимодействует с сажей с
- 19. Гидрогенизация (гидрирование) — реакция присоединения водорода по
Слайд 1Ткаченко
Виктор Иванович
Доктор физ.-мат. наук, директор НПК ВИЭРТ ННЦ ХФТИ
Водородная, в
Слайд 2 История открытия водорода
Распространенность водорода
космос
атмосфера Земли
водород в
Физические, химические, энергетические свойства водорода
свойства атома водорода
свойства молекулы водорода
свойства водорода в различных агрегатных состояниях
Сравнительные энергетические характеристики водорода
Химические реакции водорода
взаимодействие с неметаллами
взаимодействие с галогенами
взаимодействие с щелочными металлами
восстановление оксидов металлов
гидрирование органических соединений
Слайд 3Водород - топливо будущего.
История
Родился 10 октября 1731 в Ницце. Окончил
В 1766 году Кавендиш опубликовал первую важную работу по химии —«Искусственный воздух», где сообщалось об открытии «горючего воздуха» (водорода). Выделил в чистом виде углекислый газ и водород, приняв последний за флогистон, установил основной состав воздуха как смесь азота и кислорода. Получил окислы азота. Сжиганием водорода получил (1784 год) воду, определив соотношение объёмов взаимодействующих в этой реакции газов.
Слайд 4Антуан Лоран Лавуазье
Antoine Laurent de Lavoisier
С 1774 г. Лавуазье занимался
В 1785 г. Лавуазье вместе с Менье получили, путём синтеза из водорода и кислорода, 45 г воды. Как и в других случаях Лавуазье и здесь не довольствовался одним синтезом. Вместе с Менье он производит в 1783—84 гг. разложение воды при помощи железа. Через раскалённый ружейный ствол они пропускали пары воды, и выделяющийся газ собирали: это был водород; железный ствол покрывался внутри слоем железной окалины, представляющей соединение железа с кислородом. Определив состав воды, Лавуазье затем правильно истолковал восстановление металлических окислов водородом и выделение водорода при действии кислот на металлы. Учение о кислороде, как о главном агенте горения, было встречено очень враждебно.
Слайд 5Происхождение названия
Лавуазье дал водороду название hydrogène (от греческого hydor — вода
Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году.
Распространенность водорода
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92% всех атомов (8% составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1%). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °С) и межзвёздного пространства, пронизанного космическим излучением, этот элемент существует в виде отдельных атомов.
В космосе
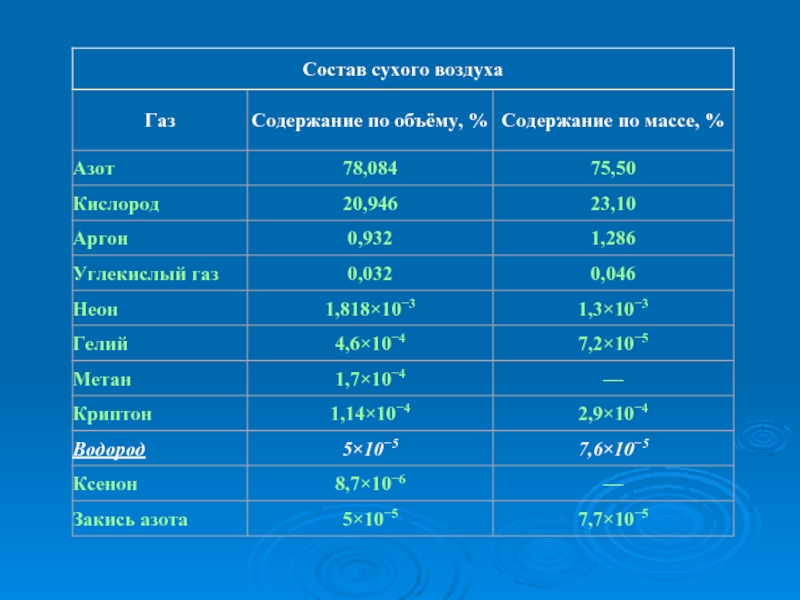
Атмосфера Земли состоит в основном из газов и различных примесей (пыль, капли воды, кристаллы льда, морские соли, продукты горения).
Концентрация газов, составляющих атмосферу, практически постоянна, за исключением воды (H2O) и углекислого газа (CO2).
Водород в атмосфере
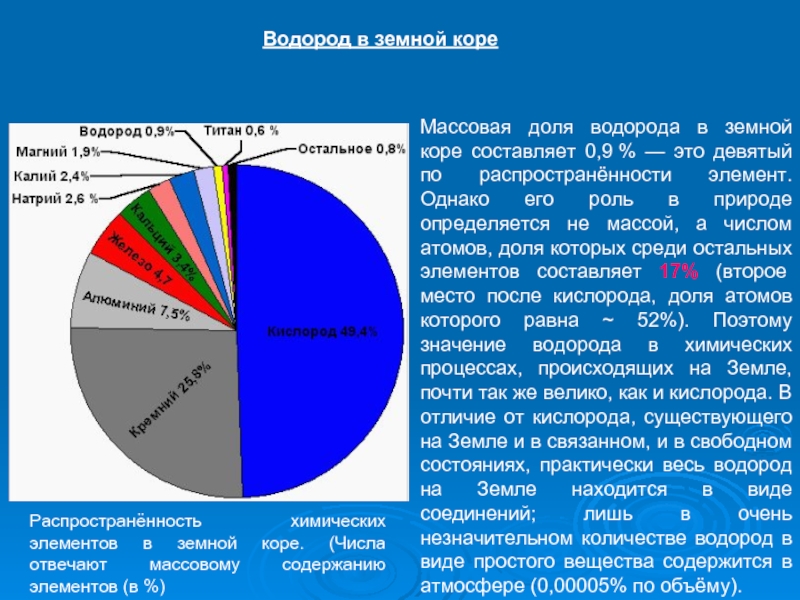
Слайд 7Массовая доля водорода в земной коре составляет 0,9 % — это девятый
Водород в земной коре
Распространённость химических элементов в земной коре. (Числа отвечают массовому содержанию элементов (в %)
Слайд 9Свойства атома водорода
Плотность вероятности для электрона при различных значениях главного квантового
Слайд 10Свойства молекулы водорода
а – фазы волновых функций совпадают; наблюдается конструктивная
РЕЗУЛЬТАТЫ ПЕРЕКРЫТИЯ
1S-ОРБИТАЛЕЙ АТОМОВ ВОДОРОДА
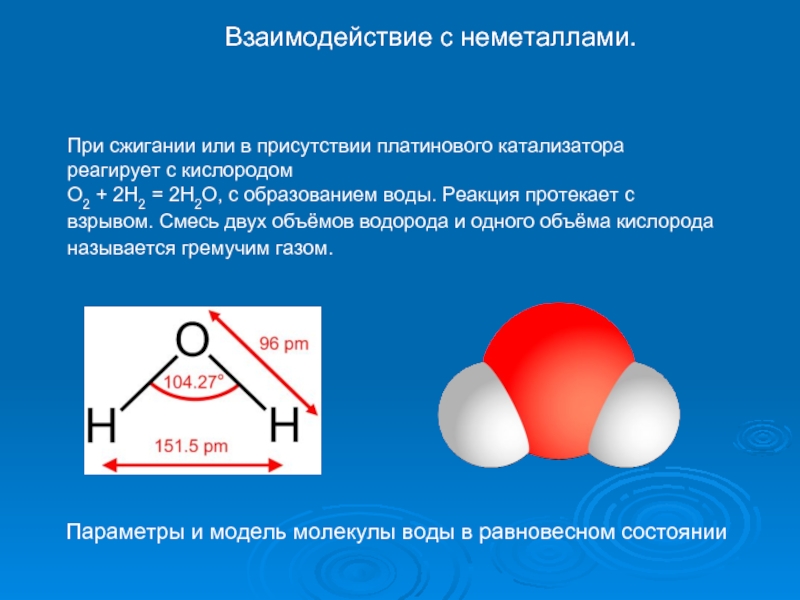
Слайд 14При сжигании или в присутствии платинового катализатора реагирует с кислородом
O2
Взаимодействие с неметаллами.
Параметры и модель молекулы воды в равновесном состоянии
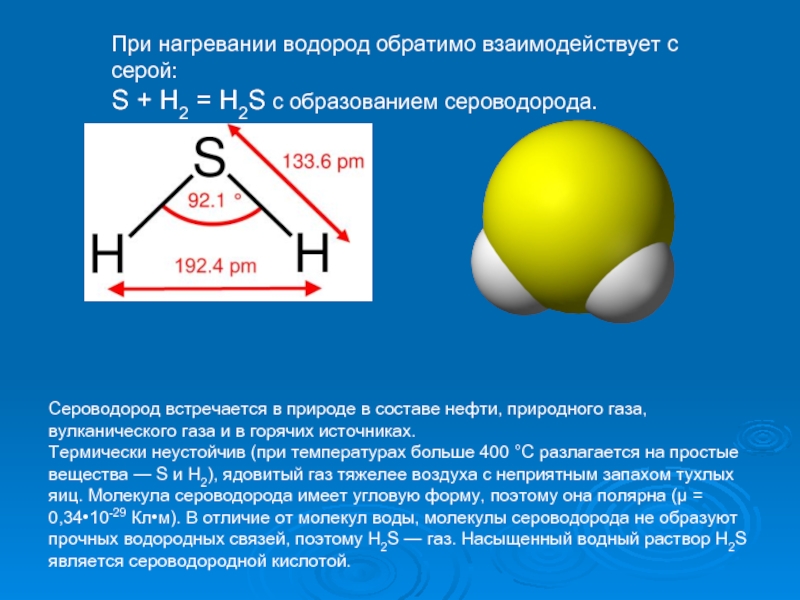
Слайд 15При нагревании водород обратимо взаимодействует с серой:
S + H2 =
Сероводород встречается в природе в составе нефти, природного газа, вулканического газа и в горячих источниках.
Термически неустойчив (при температурах больше 400 °C разлагается на простые вещества — S и H2), ядовитый газ тяжелее воздуха с неприятным запахом тухлых яиц. Молекула сероводорода имеет угловую форму, поэтому она полярна (μ = 0,34•10-29 Кл•м). В отличие от молекул воды, молекулы сероводорода не образуют прочных водородных связей, поэтому H2S — газ. Насыщенный водный раствор H2S является сероводородной кислотой.
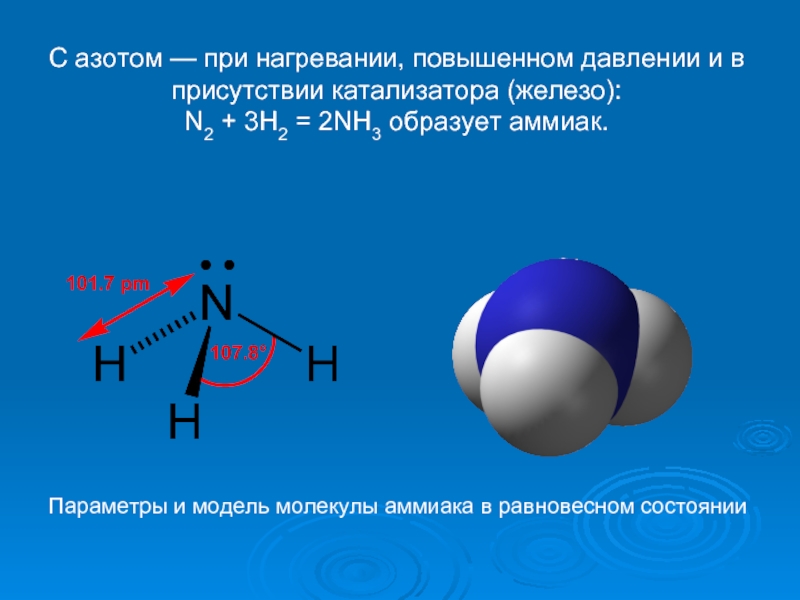
Слайд 16С азотом — при нагревании, повышенном давлении и в присутствии катализатора
N2 + 3H2 = 2NH3 образует аммиак.
Параметры и модель молекулы аммиака в равновесном состоянии
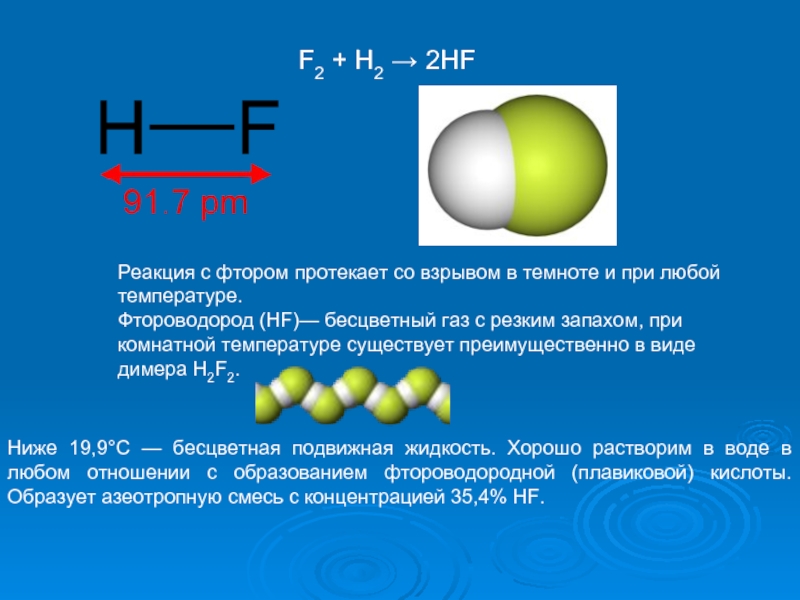
Слайд 17Реакция с фтором протекает со взрывом в темноте и при любой
Фтороводород (HF)— бесцветный газ с резким запахом, при комнатной температуре существует преимущественно в виде димера H2F2.
Ниже 19,9°C — бесцветная подвижная жидкость. Хорошо растворим в воде в любом отношении с образованием фтороводородной (плавиковой) кислоты. Образует азеотропную смесь с концентрацией 35,4% HF.
F2 + H2 → 2HF
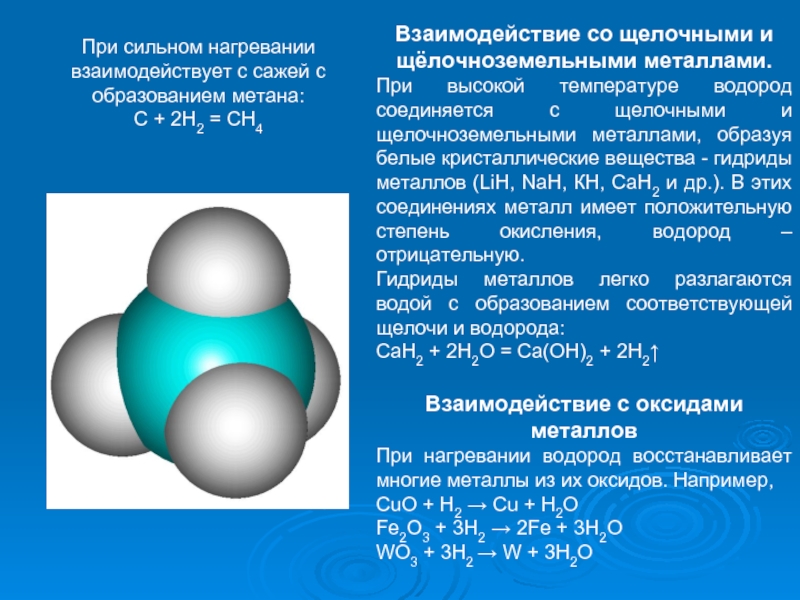
Слайд 18При сильном нагревании взаимодействует с сажей с образованием метана:
C +
Взаимодействие со щелочными и щёлочноземельными металлами.
При высокой температуре водород соединяется с щелочными и щелочноземельными металлами, образуя белые кристаллические вещества - гидриды металлов (LiН, NaН, КН, СаН2 и др.). В этих соединениях металл имеет положительную степень окисления, водород – отрицательную.
Гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
СаH2 + 2Н2О = Са(ОН)2 + 2Н2↑
Взаимодействие с оксидами металлов
При нагревании водород восстанавливает многие металлы из их оксидов. Например,
CuO + H2 → Cu + H2O
Fe2O3 + 3H2 → 2Fe + 3H2O
WO3 + 3H2 → W + 3H2O
Слайд 19Гидрогенизация (гидрирование) — реакция присоединения водорода по кратной связи, обычно в
Этилен гидрируется до метана: С2Н4 + Н2 = 2СН3 в присутствии никелевого катализатора и повышенной температуре
Окись этилена гидрируется до этанола (этиловый спирт):
СН3СНО + Н2 = СН3СН2ОН.
Отщепление водорода от соединений называется дегидрогенизацией. Гидрогенизация и дегидрогенизация связаны динамическим равновесием. Наиболее важные промышленные процессы гидрогенизация — синтез циклогексана из бензола, синтез метилового спирта из СО и Н2, синтез насыщенных жиров из ненасыщенных (получение маргарина), синтез искусственного жидкого топлива.
В качестве катализаторов применяют Ni, Pt, Co, Fe, Pd, Cu, V и др. Реакция, как правило, проходит при повышенной температуре и/или повышенном давлении. Для проведения реакции в таких условиях необходим взрывобезопасный химический реактор.
Гидрирование органических соединений.