- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Бензол и его свойства презентация
Содержание
- 1. Бензол и его свойства
- 2. История открытия Впервые бензол описал немецкий химик
- 3. Второе рождение Своё второе рождение бензол
- 4. Новое получение В 1833 году немецкий
- 5. Задача1 (для 1варианта). При сжигании 2,5
- 6. Бензол не обесцвечивает бромную воду и раствор KMnO4
- 7. Но структуру удалось установить лишь в 1865
- 8. С С С С С С Формула Кекуле БЕНЗОЛ
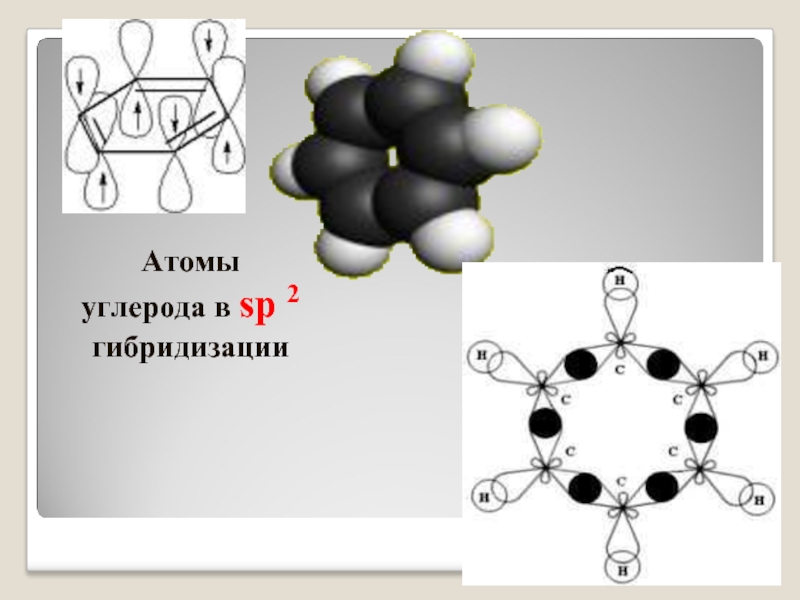
- 9. Атомы углерода в sp 2 гибридизации
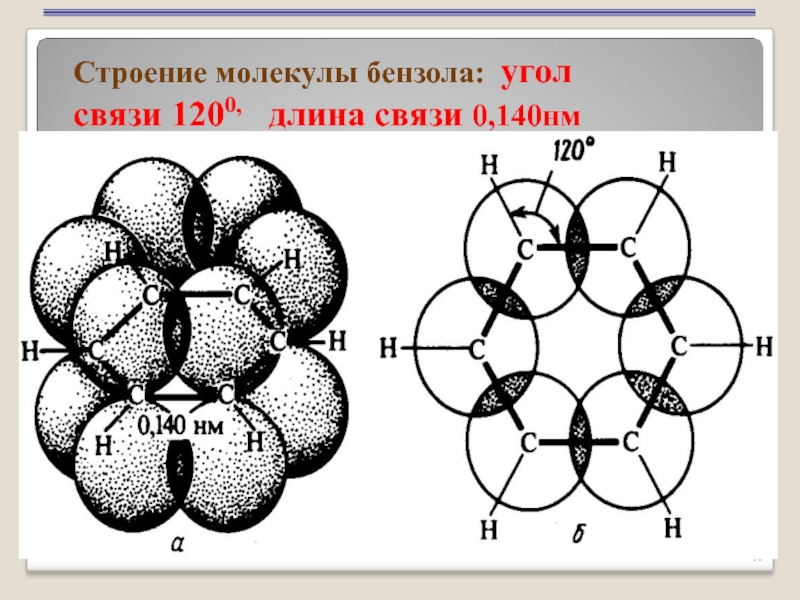
- 10. Строение молекулы бензола: угол связи 1200, длина связи 0,140нм
- 11. Электронное строение бензола Современное представление об электронной
- 13. ФИЗИЧЕСКИЕ СВОЙСТВА ТОКСИЧЕН! ПДК –
- 14. Физические свойства Бензол представляет собой бесцветную,
- 15. Биологическое действие В больших дозах бензол
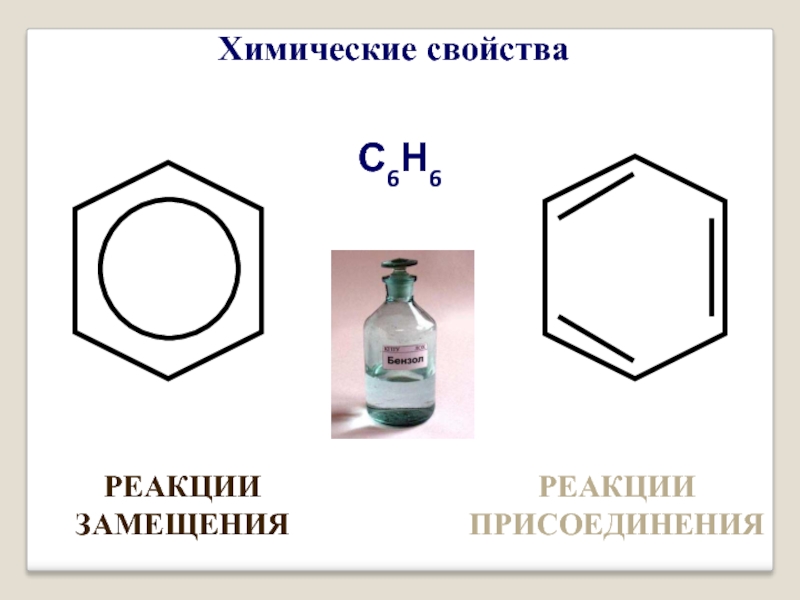
- 16. С6Н6 РЕАКЦИИ ЗАМЕЩЕНИЯ РЕАКЦИИ ПРИСОЕДИНЕНИЯ Химические свойства
- 17. I. Реакция замещения а) галогенирование + BrBr FeBr3 + HBr бромбензол Br2
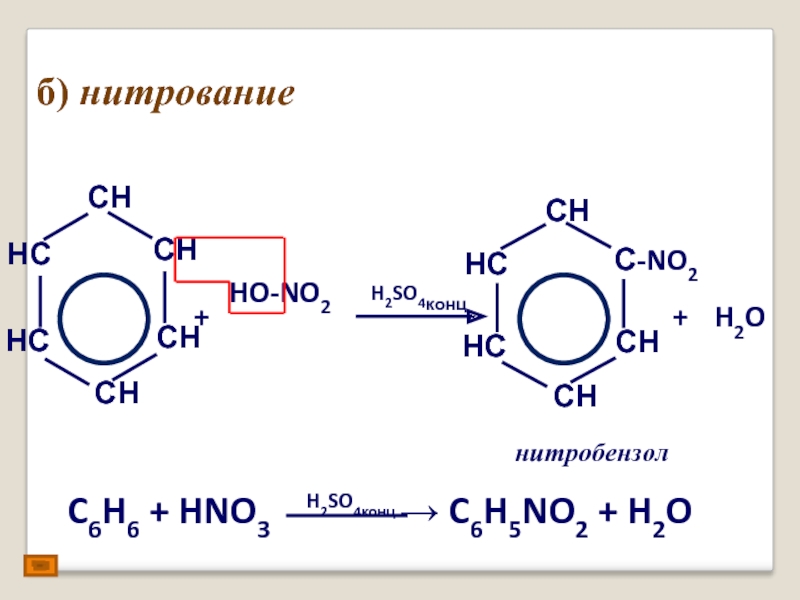
- 18. б) нитрование + HO-NO2 H2SO4конц + H2O нитробензол
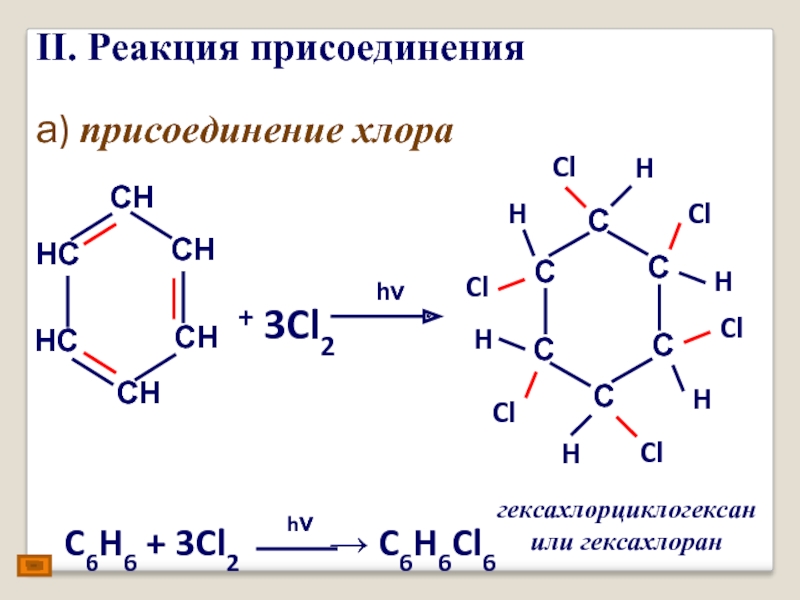
- 19. II. Реакция присоединения а) присоединение хлора + 3Cl2 hν гексахлорциклогексан или гексахлоран H
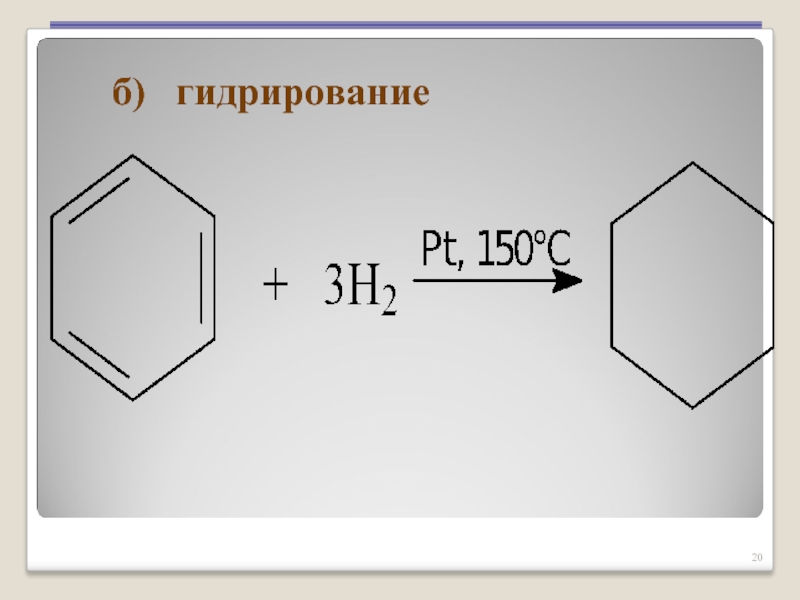
- 20. б) гидрирование
- 21. III. Реакция горения – сильно коптит 2
- 22. Способы получения 1.Ароматизация алканов
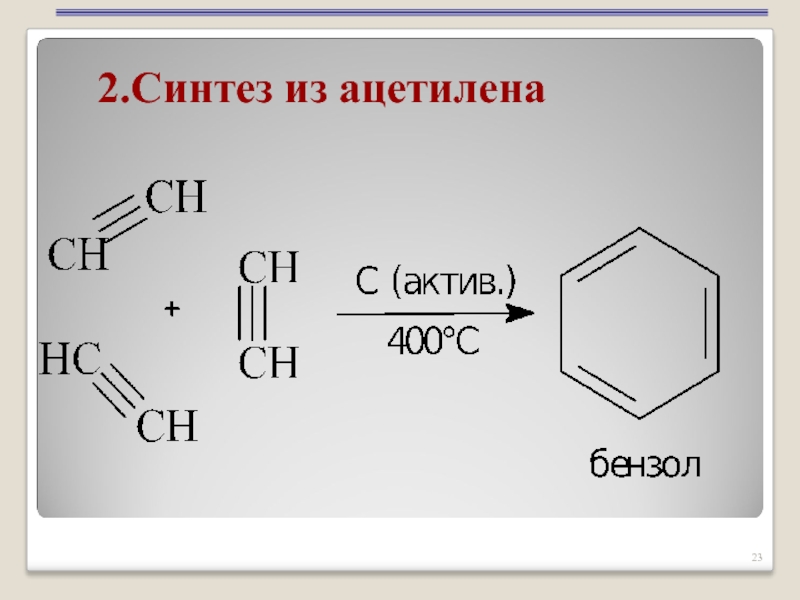
- 23. 2.Синтез из ацетилена
- 24. Промышленное получение Бензол получают из каменноугольной
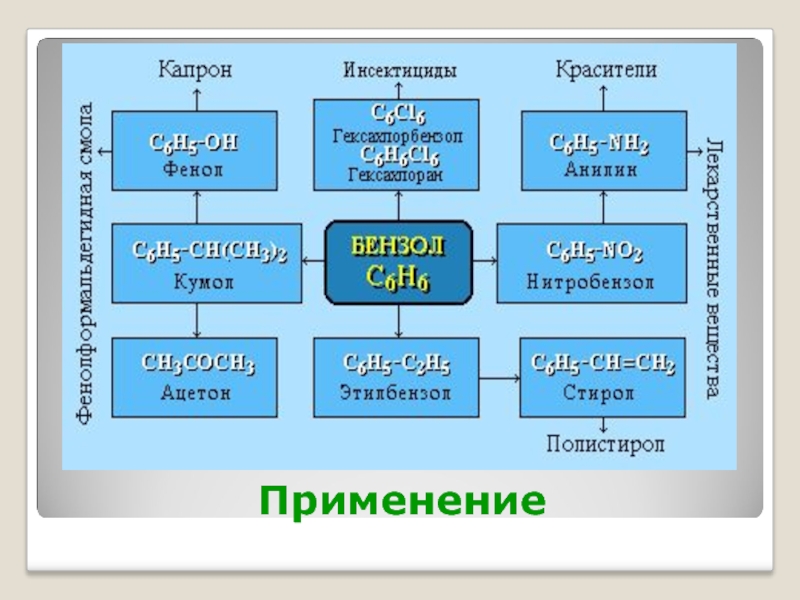
- 25. Применение
- 26. Закрепление 1. Бензол имеет молекулярную формулу:
- 27. Ответы к тестовому заданию 1) 3,
- 28. Домашнее задание: Подготовить сообщение или
Слайд 2История открытия
Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это
соединение в 1649 году в результате перегонки каменно-угольной смолы. Но ни названия вещество не получило, ни состав его не был известен.
Слайд 3Второе рождение
Своё второе рождение бензол получил благодаря работам Фарадея. Бензол
был открыт в 1825 году английским физиком Майклом Фарадеем, который выделил его из жидкого конденсата светильного газа.
Слайд 4Новое получение
В 1833 году немецкий физик-химик Эйльгард Мичерлих получил бензол
при сухой перегонке кальциевой соли бензойной кислоты (именно от этого и произошло название бензол)
Слайд 5Задача1 (для 1варианта).
При сжигании 2,5 г вещества выделилось 8,46 г
углекислого газа и 1,73 г воды. Масса 1 л вещества составляет 3,5 г. Определите молекулярную и возможную структурную формулы вещества
Задача 2 (для 2 варианта). Плотность паров вещества по воздуху: D = 2,69. Массовая доля углерода: w = 92,3%,массовая доля водорода: w = 7,7%. Определите молекулярную формулу вещества.
Задача 2 (для 2 варианта). Плотность паров вещества по воздуху: D = 2,69. Массовая доля углерода: w = 92,3%,массовая доля водорода: w = 7,7%. Определите молекулярную формулу вещества.
Слайд 7Но структуру удалось установить лишь в 1865 г немецкому химику Фридриху
Августу Кекуле. Ему однажды пришлось участвовать в качестве свидетеля в судебном процессе по делу об убийстве графини Герлиц. На этом процессе демонстрировалось в качестве улики кольцо графини в виде двух переплетенных змеек, которое похитил преступник. Эти змейки врезались в память ученому. Как-то раз, после долгой работы над учебником, Кекуле уснул, и ему приснились атомы углерода и водорода , сцепленные в нити, которые сближались и свертывались в трубку, напоминая двух змей. Одна из змей вцепилась в собственный хвост, продолжая крутиться. Сон оказался в руку. Кекуле сцепил все атомы углерода в шестиугольник
с чередующимися двойными и одинарными связями. Так появилась на свет структурная формула
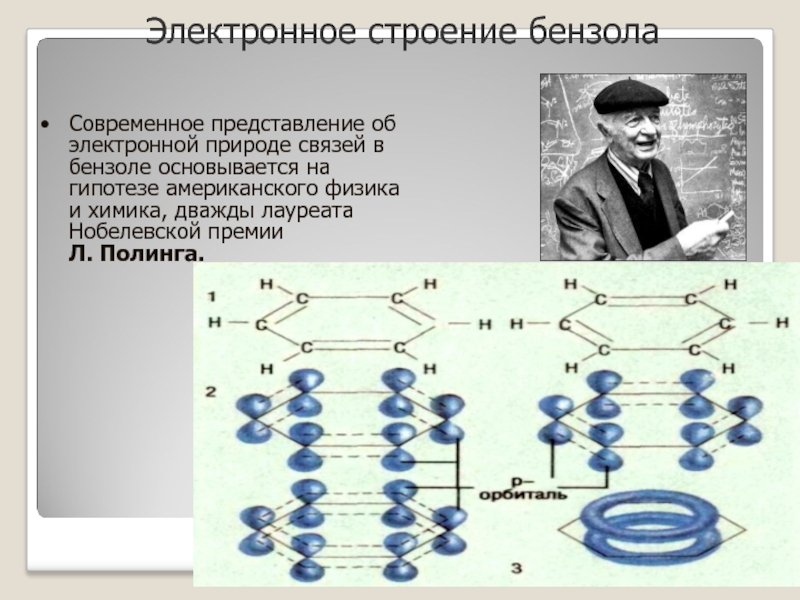
Слайд 11Электронное строение бензола
Современное представление об электронной природе связей в бензоле основывается
на гипотезе американского физика и химика, дважды лауреата Нобелевской премии
Л. Полинга.
Слайд 13ФИЗИЧЕСКИЕ СВОЙСТВА
ТОКСИЧЕН!
ПДК – 5мг/м3
Смертельная концентрация
в крови – 0,9
мг/л
tкип.= 800С
tпл. = 5,50С
ρ – 0,88 г/см3
Слайд 14Физические свойства
Бензол представляет собой бесцветную, легкоподвижную жидкость с температурой кипения
+80ºС и температурой плавления + 5ºС.
Он обладает своеобразным запахом, горит сильно коптящим пламенем, легче воды и не растворяется в ней.
Пары бензола с воздухом образуют взрывчатую смесь.
Он обладает своеобразным запахом, горит сильно коптящим пламенем, легче воды и не растворяется в ней.
Пары бензола с воздухом образуют взрывчатую смесь.
Слайд 15Биологическое действие
В больших дозах бензол вызывает тошноту и головокружение, а в
некоторых тяжёлых случаях отравление бензолом может вести к смертельному исходу. Если организм человека подвергается длительному воздействию бензола в малых количествах, последствия также могут быть очень серьёзными. В этом случае отравление бензолом может стать причиной лейкемии (рака крови) и анемии (недостатка гемоглобина в крови). Источником бензола в квартирах и офисах служат табачный дым, картриджи ксероксов, принтеры, ковровые покрытия, краски и лаки, а также поверхностно-активные вещества (ПАВ).
Слайд 21III. Реакция горения – сильно коптит
2 С6Н6 + 15 О2
= 12 СО2 + 6 Н2О
Раствор перманганата калия и бромную воду не обесцвечивает
Слайд 24Промышленное получение
Бензол получают из каменноугольной
смолы, образующейся при коксовании
угля.
В настоящее время бензол получают из нефти.
Бензол получают синтетическими методами.
В настоящее время бензол получают из нефти.
Бензол получают синтетическими методами.
Слайд 26Закрепление
1. Бензол имеет молекулярную формулу:
1) С6Н10
2) С6Н12 3) С6Н6 4) С6Н14.
2. Какую гибридизацию имеют атомы углерода в молекуле бензола?
1) sp3 2) sp3, sp 3) sp2 4) sp2, sp3.
3. Сколько сигма- и пи- связей в молекуле бензола
1) 12 и 6 2) 10 и 0 3) 6 и 3 4) 12 и 3
4. Какое название имеет ближайший гомолог бензола
1) 1,2-диметилбензол 2) метилбензол
3) этилбензол 4) 1,2,3-триметилбензол
5. Какую общую формулу могут иметь углеводороды ряда бензола
1) CnH2n 2) CnH2n+2 3) CnH2n-2 4) CnH2n-6
2. Какую гибридизацию имеют атомы углерода в молекуле бензола?
1) sp3 2) sp3, sp 3) sp2 4) sp2, sp3.
3. Сколько сигма- и пи- связей в молекуле бензола
1) 12 и 6 2) 10 и 0 3) 6 и 3 4) 12 и 3
4. Какое название имеет ближайший гомолог бензола
1) 1,2-диметилбензол 2) метилбензол
3) этилбензол 4) 1,2,3-триметилбензол
5. Какую общую формулу могут иметь углеводороды ряда бензола
1) CnH2n 2) CnH2n+2 3) CnH2n-2 4) CnH2n-6
Слайд 28Домашнее задание:
Подготовить сообщение или презентацию «Применение бензола и его гомологов»,
§16 упр.1-5