- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Углерод и его соединения презентация
Содержание
- 1. Углерод и его соединения
- 2. Общая характеристика элементов IV группы Углерод:
- 3. Общая характеристика элементов IV группы
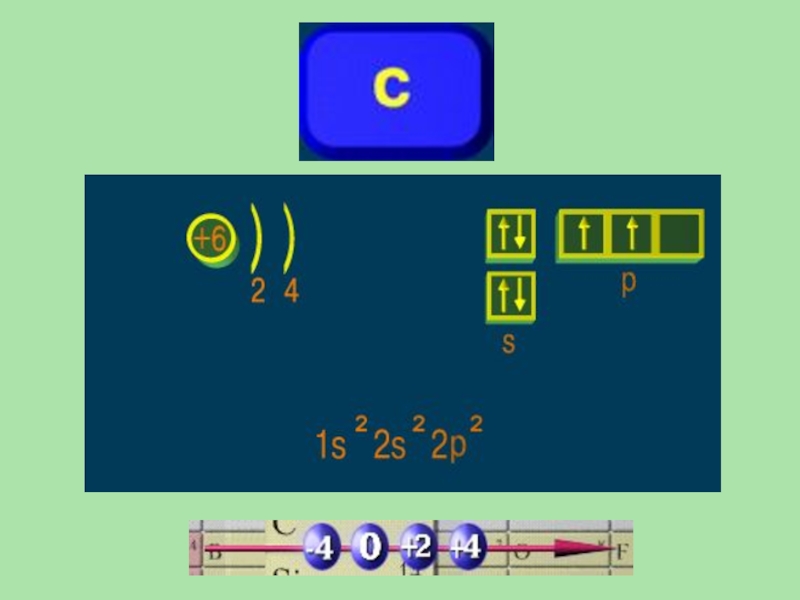
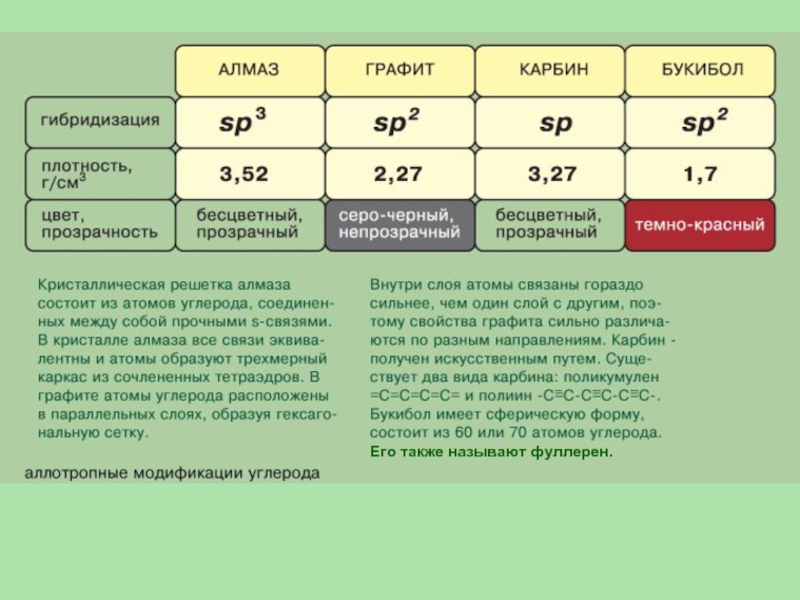
- 11. Углерод
- 14. Его также называют фуллерен.
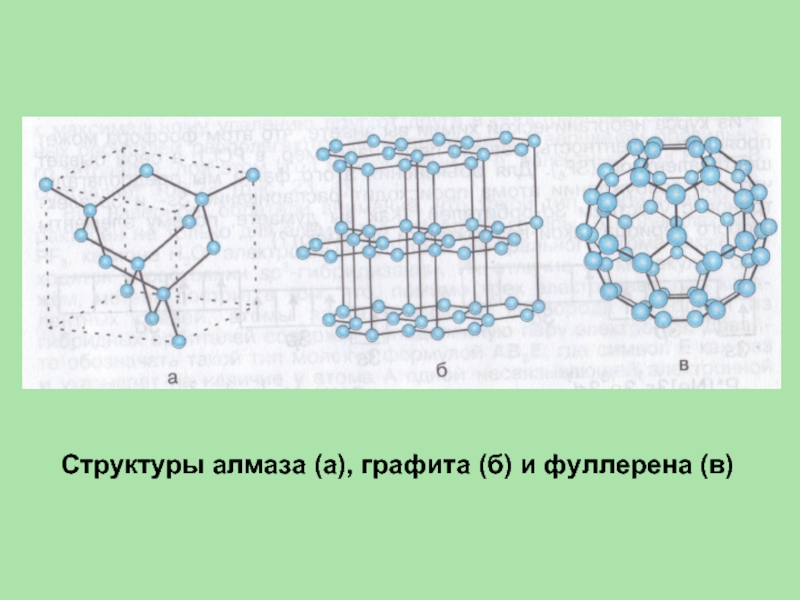
- 15. Структуры алмаза (а), графита (б) и фуллерена (в)
- 16. Кристаллические решётки алмаза (а) и графита (б) а
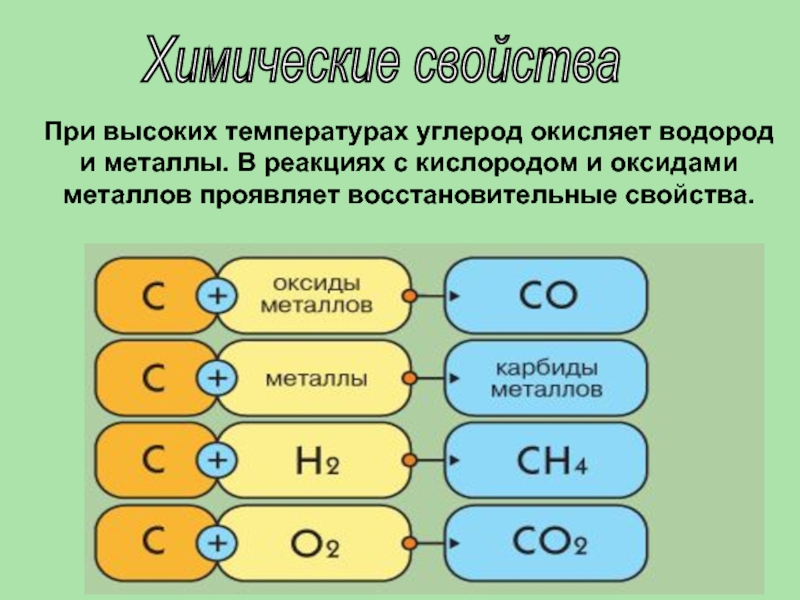
- 17. Химические свойства При высоких температурах углерод окисляет
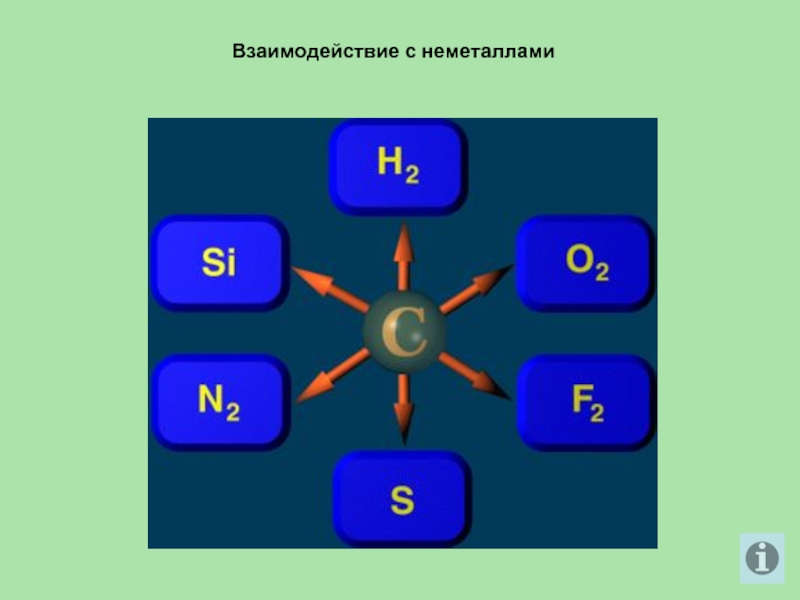
- 19. Взаимодействие с неметаллами
- 20. При нагревании углерод соединяется с кислородом, образуя
- 22. Углерод – сильный восстановитель. При нагревании с
- 23. При взаимодействии с металлами углерод образует карбиды
- 24. Углерод в виде сажи, кокса, древесного угля,
- 25. Оксиды углерода
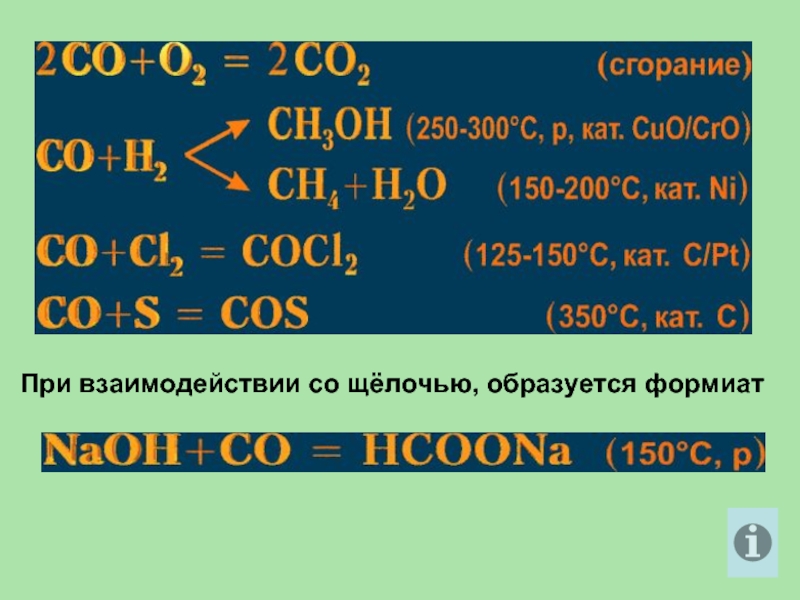
- 27. При взаимодействии со щёлочью, образуется формиат
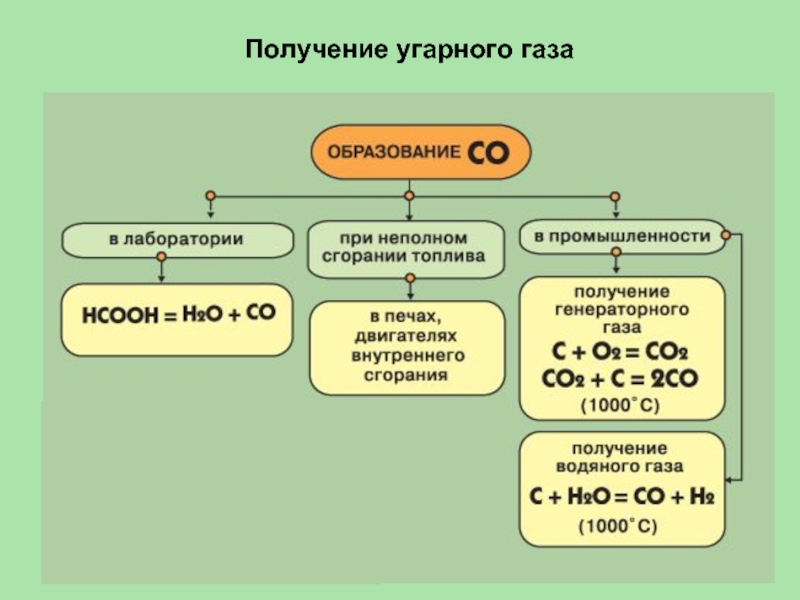
- 28. Получение угарного газа
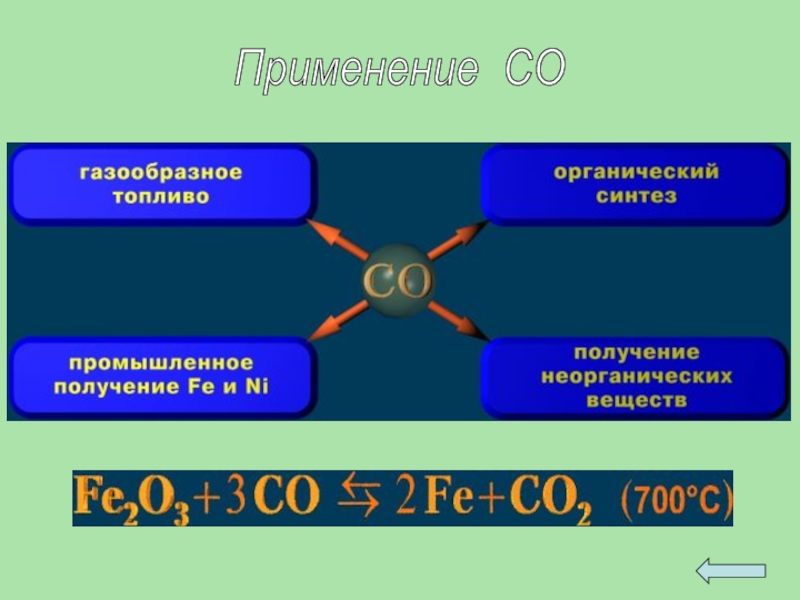
- 29. Применение СО
- 30. Оксид углерода (IV), или углекислый газ, –
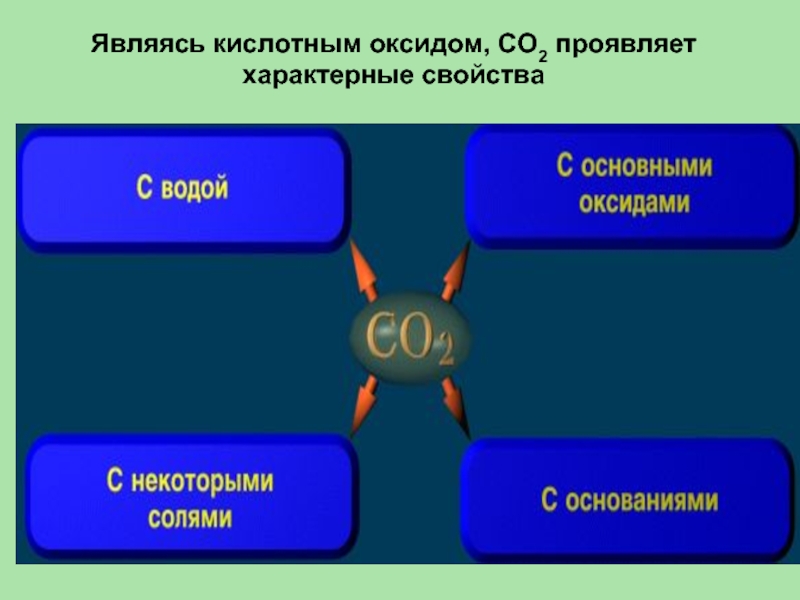
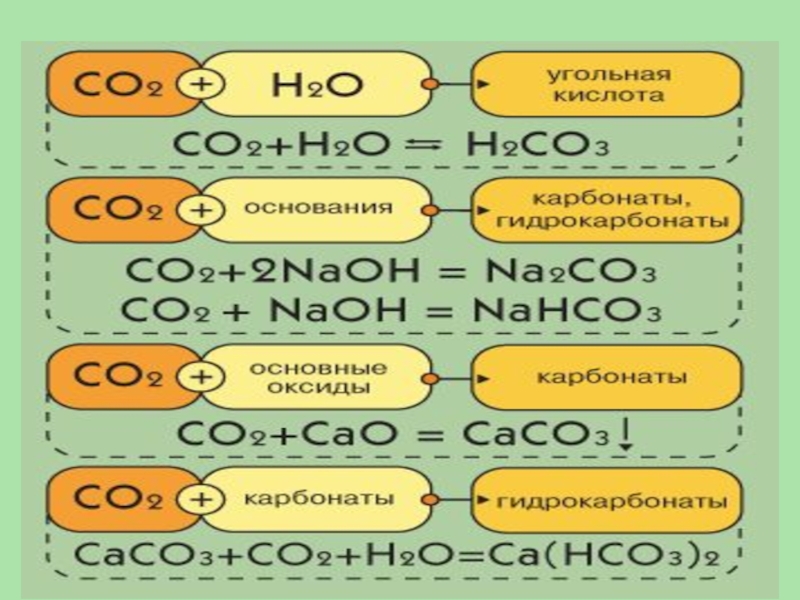
- 31. Являясь кислотным оксидом, СО2 проявляет характерные свойства
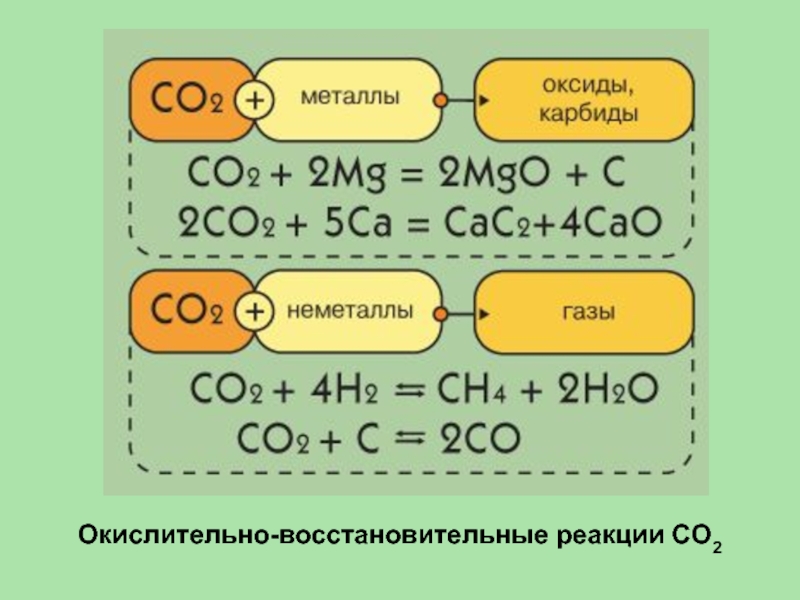
- 34. Окислительно-восстановительные реакции СО2
- 35. В лаборатории оксид углерода (IV) получают взаимодействием
- 37. Реакция СО2 с известковой водой (помутнение раствора из-за образования осадка СаСО3) является качественной реакцией.
- 38. Применение СО2
- 39. Фотосинтез
- 42. Угольная кислота и её соли
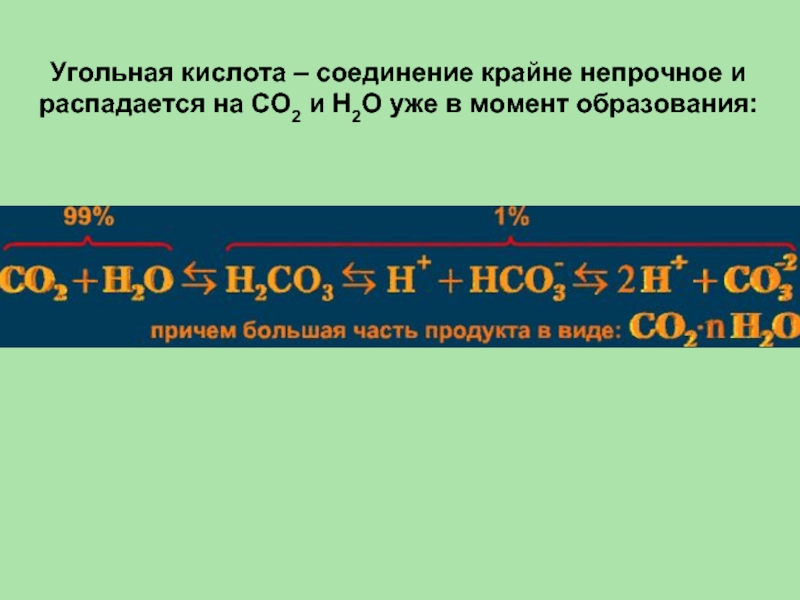
- 43. Угольная кислота – соединение крайне непрочное и
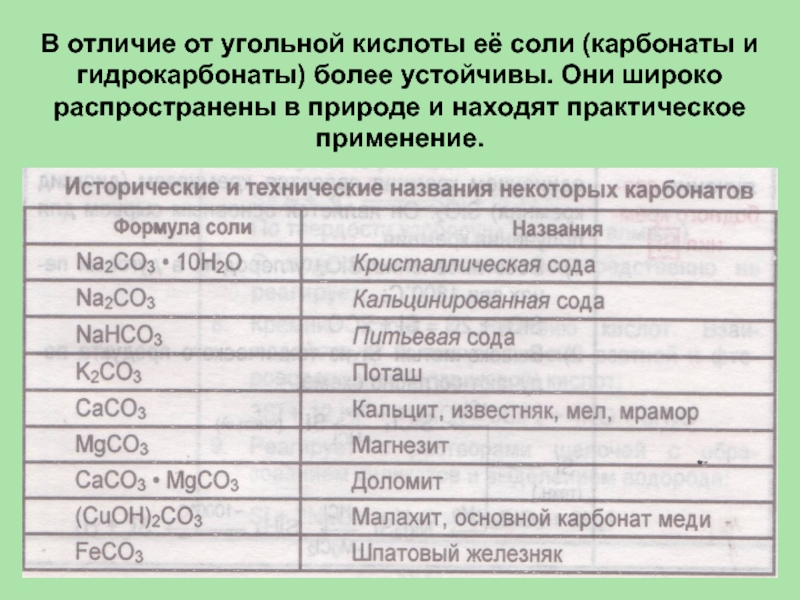
- 45. В отличие от угольной кислоты её соли
- 46. В водных растворах карбонаты и гидрокарбонаты подвергаются гидролизу по аниону:
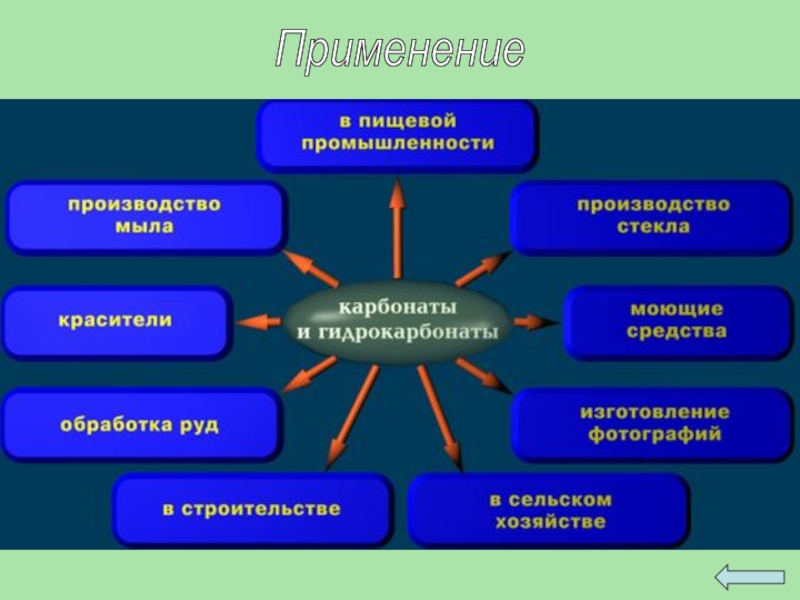
- 48. Применение
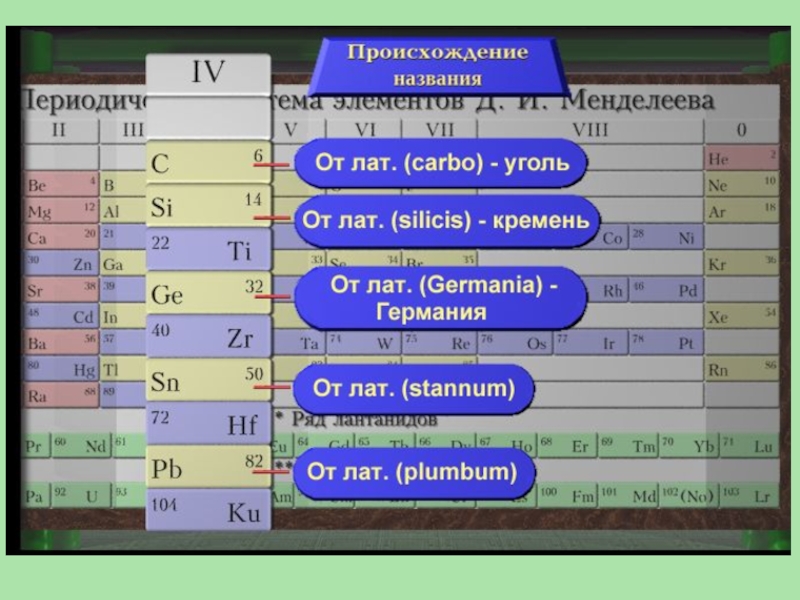
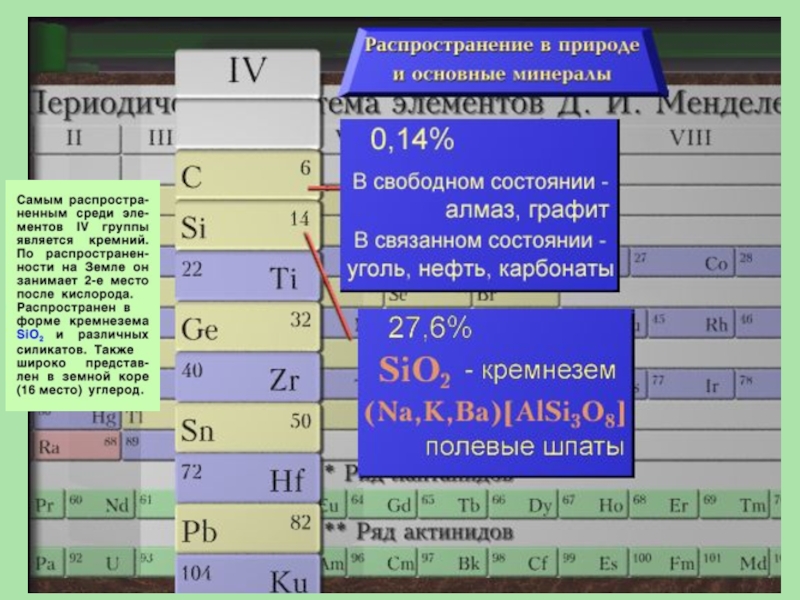
Слайд 2Общая характеристика элементов IV группы
Углерод:
Строение и аллотропия
Химические свойства
Круговорот
в природе
Оксиды углерода:
Угарный газ
Углекислый газ
Угольная кислота и её соли
Оксиды углерода:
Угарный газ
Углекислый газ
Угольная кислота и её соли
Слайд 17Химические свойства
При высоких температурах углерод окисляет водород и металлы. В реакциях
с кислородом и оксидами металлов проявляет восстановительные свойства.
Слайд 20При нагревании углерод соединяется с кислородом, образуя оксид углерода (IV), или
углекислый газ:
С + O2 = CO2
При недостатке кислорода образуется оксид углерода (II), или угарный газ:
2С + О2 = 2СО
С водородом углерод соединяется только при высоких температурах и в присутствии катализаторов. В зависимости от температуры образуются различные углеводороды, например, метан:
С + 2H2 = CH4
Углерод взаимодействует при нагревании с серой и фтором, в электрической дуге с азотом:
С + 2S = CS2
С + 2F2 = CF4
2С + N2 = (CN)2
С + O2 = CO2
При недостатке кислорода образуется оксид углерода (II), или угарный газ:
2С + О2 = 2СО
С водородом углерод соединяется только при высоких температурах и в присутствии катализаторов. В зависимости от температуры образуются различные углеводороды, например, метан:
С + 2H2 = CH4
Углерод взаимодействует при нагревании с серой и фтором, в электрической дуге с азотом:
С + 2S = CS2
С + 2F2 = CF4
2С + N2 = (CN)2
Слайд 22Углерод – сильный восстановитель. При нагревании с водяным паром он вытесняет из
воды водород:
Н2O + С = СО + Н2
При нагревании углерода с оксидом углерода (IV) образуется угарный газ:
С + СО2 = 2СО
Углерод восстанавливает многие металлы из их оксидов:
2Fe2O3 + 3С = 4Fe + 3CO2
С металлами или их оксидами углерод образует карбиды:
CaO + 3C = CaC2 + СО
Н2O + С = СО + Н2
При нагревании углерода с оксидом углерода (IV) образуется угарный газ:
С + СО2 = 2СО
Углерод восстанавливает многие металлы из их оксидов:
2Fe2O3 + 3С = 4Fe + 3CO2
С металлами или их оксидами углерод образует карбиды:
CaO + 3C = CaC2 + СО
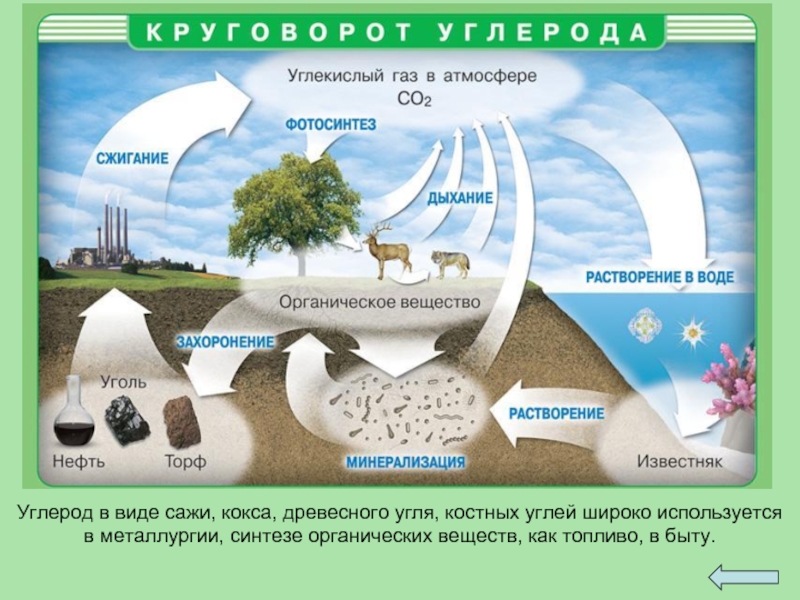
Слайд 24Углерод в виде сажи, кокса, древесного угля, костных углей широко используется в
металлургии, синтезе органических веществ, как топливо, в быту.
Слайд 26
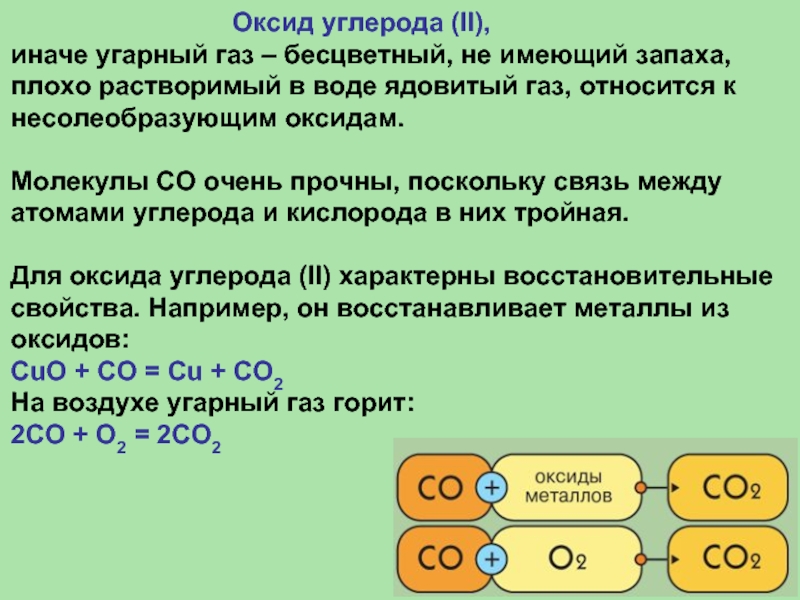
Оксид углерода (II),
иначе угарный газ – бесцветный, не имеющий запаха, плохо растворимый в воде ядовитый газ, относится к несолеобразующим оксидам.
Молекулы СО очень прочны, поскольку связь между атомами углерода и кислорода в них тройная.
Для оксида углерода (II) характерны восстановительные свойства. Например, он восстанавливает металлы из оксидов:
CuO + CO = Cu + CO2
На воздухе угарный газ горит:
2CO + O2 = 2CO2
иначе угарный газ – бесцветный, не имеющий запаха, плохо растворимый в воде ядовитый газ, относится к несолеобразующим оксидам.
Молекулы СО очень прочны, поскольку связь между атомами углерода и кислорода в них тройная.
Для оксида углерода (II) характерны восстановительные свойства. Например, он восстанавливает металлы из оксидов:
CuO + CO = Cu + CO2
На воздухе угарный газ горит:
2CO + O2 = 2CO2
Слайд 30Оксид углерода (IV),
или углекислый газ, – газ без цвета и запаха.
Это кислотный оксид, ему соответствует двухосновная угольная кислота.
Растворение оксида углерода (IV) – обратимый процесс:
H2O + CO2 ↔ H2CO3
Для углекислого газа не характерны ни окислительные, ни восстановительные свойства, хотя некоторые наиболее активные металлы горят в оксиде:
CO2 + 2Mg = 2MgO + С
Растворение оксида углерода (IV) – обратимый процесс:
H2O + CO2 ↔ H2CO3
Для углекислого газа не характерны ни окислительные, ни восстановительные свойства, хотя некоторые наиболее активные металлы горят в оксиде:
CO2 + 2Mg = 2MgO + С
Слайд 35В лаборатории оксид углерода (IV) получают взаимодействием карбоната кальция (мел, мрамор) с
соляной кислотой в аппаратах Киппа:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
В промышленности этот оксид получают сжиганием угля и при обжиге известняка:
С + O2 = CO2
CaCO3 = CaO + CO2
CaCO3 + 2HCl = CaCl2 + H2O + CO2
В промышленности этот оксид получают сжиганием угля и при обжиге известняка:
С + O2 = CO2
CaCO3 = CaO + CO2
Получение СО2
Слайд 37Реакция СО2 с известковой водой (помутнение раствора из-за образования осадка СаСО3)
является качественной реакцией.
Слайд 43Угольная кислота – соединение крайне непрочное и распадается на CO2 и
H2O уже в момент образования:
Слайд 45В отличие от угольной кислоты её соли (карбонаты и гидрокарбонаты) более
устойчивы. Они широко распространены в природе и находят практическое применение.