- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 презентация
Содержание
- 2. Вопросы: 1. О каком веществе
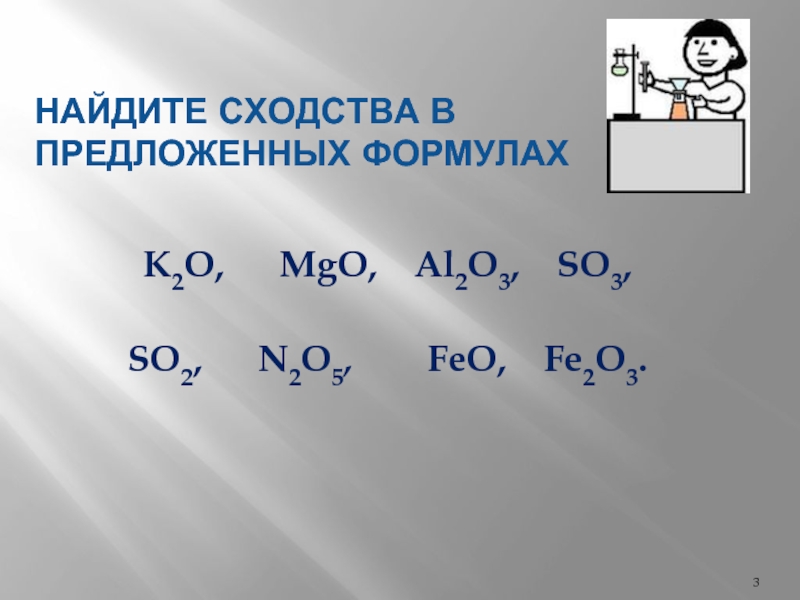
- 3. НАЙДИТЕ СХОДСТВА В ПРЕДЛОЖЕННЫХ ФОРМУЛАХ K2O,
- 4. Ответ : Сложные вещества;
- 5. Кроссворд 1. Назовите самый распространенный химический
- 6. ТЕМА УРОКА: ОКСИДЫ – СОЕДИНЕНИЯ ЭЛЕМЕНТОВ С КИСЛОРОДОМ
- 7. Выберите из предложенных формул формулы оксидов. Запишите
- 8. Схема: Название оксида = «Оксид» + название
- 9. Проверяем: Na2O – оксид натрия B2O3
- 10. Найди ошибку в названии вещества CuO
- 11. Лабораторный опыт: 1. Рассмотрите выданные вам оксиды.
- 12. Выводы: 1. Оксиды могут быть твёрдыми, жидкими,
- 13. Оксиды в природе SiO2 - кварцевый песок,
- 14. Оксиды в природе: Al2O3 2SiO2 2H2O – белая глина, состоит из оксидов алюминия и кремния
- 15. Оксиды в природе: Fe2O3 – руда железная
- 16. Оксиды в природе:
- 17. Оксиды в природе: ? Самый распространенный
- 18. Антуан Лоран Лавуазье
- 19. Составьте формулы оксидов и дайте им названия:
- 20. Проверь себя CaO – оксид кальция
- 21. Составьте уравнения реакций получение оксидов магния, алюминия, лития
- 23. Дополни уравнения химических реакций Вариант I
- 24. Проверь себя: Вариант I 4Р +
- 25. Реши задачу Вариант I Рассчитайте
- 27. ДОМАШНЕЕ ЗАДАНИЕ: § 23, стр. 104 номера 2, 4, 6, 8.
- 28. До новых встреч! ПОДГОТОВИЛ УЧИТЕЛЬ ХИМИИ: ХРАПОВИЦКАЯ С.А.
Слайд 2 Вопросы: 1. О каком веществе идет речь? 2. Что вы можете сказать о
Слайд 5Кроссворд 1. Назовите самый распространенный химический элемент в земной коре. 2. Как называется
Слайд 7Выберите из предложенных формул формулы оксидов. Запишите их в тетради в
Слайд 8Схема: Название оксида = «Оксид» + название элемента в родительном падеже +
Слайд 9Проверяем: Na2O – оксид натрия B2O3 – оксид бора P2O3 – оксид фосфора (III) ZnO
Слайд 10Найди ошибку в названии вещества CuO – оксид меди CaO – оксид кальция CO
Слайд 11Лабораторный опыт:
1. Рассмотрите выданные вам оксиды. Обратите внимание на:
агрегатное состояние;
запах.
2. Исследуйте их отношение к воде.
Для этого долейте в пробирку с оксидом воды до 1/3 её объёма.
3. Свои наблюдения запишите в таблицу.
Слайд 12Выводы: 1. Оксиды могут быть твёрдыми, жидкими, газообразными веществами. 2. Могут быть бесцветными
Слайд 13Оксиды в природе
SiO2 - кварцевый песок, кремнезём.
Кварцевый песок
Аметист
Агат
Яшма
Слайд 15Оксиды в природе:
Fe2O3 – руда железная (красный железняк)
Fe3O4 или FeO Fe2O3
Красный железняк
Магнитный железняк
Слайд 17Оксиды в природе:
? Самый распространенный на земле оксид, даже организм человека
Слайд 19Составьте формулы оксидов и дайте им названия: Ca, C(IV), Al, Mg,
Если сильный кислород
На другого нападет –
Элемент другой навзрыд
Образует с ним - оксид.
Слайд 20Проверь себя CaO – оксид кальция CO2 – оксид углерода (IV) Al2O3 – оксид
Слайд 23Дополни уравнения химических реакций
Вариант I
? + O2→ P2 O5
C + O2
Fe + ? → FeO
H2S + O2→ ? + ?
Вариант II
? + O2 → CuO
S + O2→ ?
H2 + O2 → ?
C2H2+ O2 → ? + ?
Слайд 24Проверь себя:
Вариант I
4Р + 5O2→ 2P2 O5
C + O2 → СО2
2Fe
2H2S + 3O2→ 2Н2О + 2SO2
Вариант II
2Сu + O2 → 2CuO
S + O2→ SО2
2H2 + O2 → 2Н2О
2C2H2+ 5O2 → 4СО2 + 2Н2О
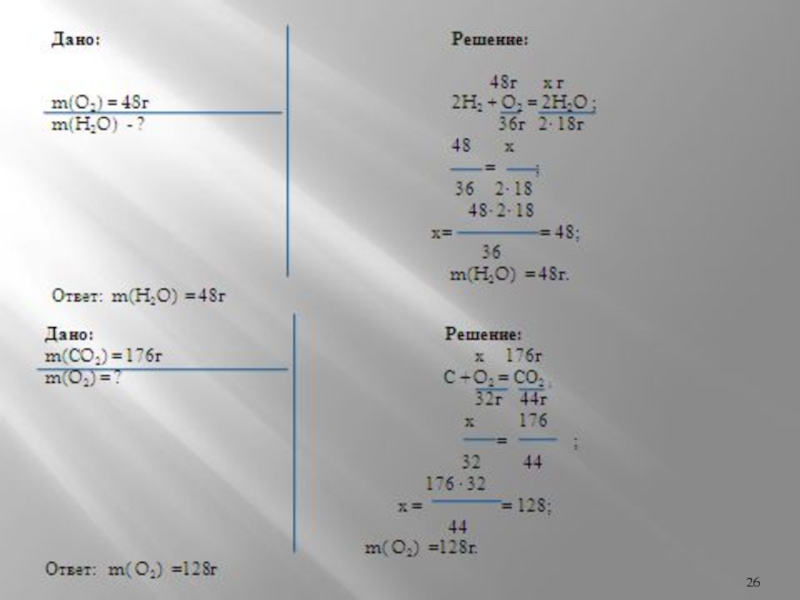
Слайд 25Реши задачу
Вариант I
Рассчитайте массу воды, которая образуется при взаимодействии
Вариант II
Рассчитайте массу кислорода, которая расходуется при сжигании угля, если образуется углекислый газ массой 176 г.