АММИАК
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
. презентация
Содержание
- 1. .
- 2. План изучения 1.Строение молекулы 2.Физические свойства
- 3. Строение молекулы Азот образует с водородом
- 4. Видно, что из 4-х электронных пар
- 5. Физические свойства Аммиак – бесцветный
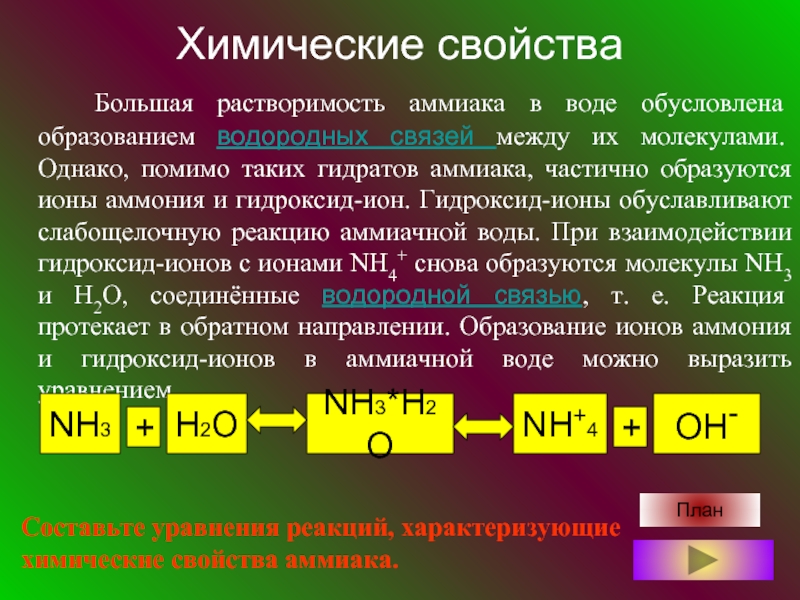
- 6. Химические свойства Большая растворимость аммиака
- 7. План
- 8. Важным химическим свойством аммиака является
- 9. Аммиак окисляется при температуре с образованием
- 10. 3CuO+2NH3 = 3Cu +N2 +3H2O
- 11. Получение и применение В лабарторных условиях аммиак
- 12. Основным промышленным способом получения аммиака является синтез
- 13. Большие количества аммиака расходуются для получения азотной
- 14. Вопросы для повторения Каково строение молекулы? Каковы
Слайд 2План изучения
1.Строение молекулы
2.Физические свойства
3.Химические свойства
4.Получение и применение
5.Вопросы для
NH
3
Слайд 3Строение молекулы
Азот образует с водородом несколько
соединений, из
является аммиак.Электронная формула
аммиака:
H
H
H
N
План
В чём особенность строения молекулы аммиака?
Слайд 4 Видно, что из 4-х электронных пар при
Азоте 3 общие
Химическая связь N-H полярная:
положительный заряд сосредоточен
на атомах водорода, отрицательный – на
атоме азота. Поэтому между молекулами
аммиака образуется водородная связь.
План
Слайд 5Физические свойства
Аммиак – бесцветный газ с характерным резким запахом,
План
Перечислите физические свойства аммиака.
Слайд 6Химические свойства
Большая растворимость аммиака в воде обусловлена образованием водородных
План
Составьте уравнения реакций, характеризующие химические свойства аммиака.
Слайд 8 Важным химическим свойством аммиака является его взаимодействие с кислотами
NH3+HCl=NH4Cl
NH3+H3PO4=NH4H2PO4
Из приведённых примеров следует, что для аммиака характерна реакция присоединения протона.
План
Слайд 9 Аммиак окисляется при температуре с образованием азота и воды:
4NH3+3O2=2N2+6H2O
А
4NH3+5O2=4NO+6H2O
Аммиак – сильный восстановитель. При нагревании он восстанавливает оксид меди (I I), а сам окисляется до свободного азота.
План
Слайд 10
3CuO+2NH3 = 3Cu +N2 +3H2O
3Cu+2O+2N -3H3 = 3Cu0 +N20 +3H2O
2N-3 – 6e = N2 0 1
Cu+2+2e = Cu 0 3
Слайд 11Получение и применение
В лабарторных условиях аммиак обычно получают слабым нагреванием смеси
2NH4Cl+Ca(OH)2=CaCl2+2NH3+2H2O
Эта реакция основана на смещении
Равновесия взаимодействия аммиака с водой при добавлении гидроксид-ионов.
План
Напишите уравнения реакций получения аммиака в промышленности и в лаборатории.
Слайд 12Основным промышленным способом получения аммиака является синтез его из азота и
N2+3H2⬄2NH3
План
Слайд 13Большие количества аммиака расходуются для получения азотной кислоты, азотосодержащих солей, мочевины,
План
Перечислите области применения аммиака.