- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ВИРТУАЛЬНОЕ ПУТЕШЕСТВИЕ презентация
Содержание
- 1. ВИРТУАЛЬНОЕ ПУТЕШЕСТВИЕ
- 2. ГИДРОСКОПОЛЬ
- 3. ВИРТУАЛЬНОЕ ПУТЕШЕСТВИЕ ВИРТУАЛЬНОЕ ПУТЕШЕСТВИЕ 24.12.2009 КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- 4. ДЕВИЗ УРОКА «Знание только тогда знание,
- 5. ЧЕМУ БУДЕМ УЧИТЬСЯ? Составлять формулы веществ,
- 6. ГИДРОСКОПОЛЬ
- 7. Классификация веществ. Вещества
- 8. ОксидоКС ОсновоКС СолюКС КислоКС
- 9. ПЛАНЕТА ОКСИДОКС СаО оксид кальция PbO
- 10. ОКСИДЫ ОСНОВНЫЕ Оксиды металлов с валентностью до
- 11. ГИДРОСКОПОЛЬ
- 12. ОксидоКС ОсновоКС СолюКС КислоКС
- 13. ПЛАНЕТА ОСНОВОКС Fe(OH)3 гидроксид железа (III)
- 14. ОСНОВАНИЯ РАСТВОРИМЫЕ Это ЩЕЛОЧИ NaOH LiOH KOH НЕРАСТВОРИМЫЕ Mg(OH)2 Fe(OH)3
- 15. ВНИМАНИЕ ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ С
- 16. ГИДРОСКОПОЛЬ
- 17. ОксидоКС ОсновоКС СолюКС КислоКС
- 18. Пропуск на планету: техника
- 19. ХИМИЧЕСКИЙ ДИКТАНТ HNO3
- 20. ЗАПИШИТЕ
- 21. КИСЛОТЫ Кислородосодержащие H3PO4 фосфорная
- 22. ЗАПОМНИ НЕСТОЙКИЕ КИСЛОТЫ
- 23. ГИДРОСКОПОЛЬ
- 24. ОксидоКС ОсновоКС СолюКС КислоКС
- 25. Планета солюкс Запишите реакцию
- 26. ГИДРОСКОПОЛЬ ПУТЕШЕСТВИЕ ЗАКОНЧЕНО
- 27. ЗАПИШИ В СПРАВОЧНИК
- 28. МЫ СЕГОДНЯ УЗНАЛИ: Классификация оксидов
- 29. Всем спасибо. Домашнее
Слайд 4ДЕВИЗ УРОКА
«Знание только тогда знание, когда оно приобретено усилиями своей
Л. Толстой,
русский писатель.
Слайд 5ЧЕМУ БУДЕМ УЧИТЬСЯ?
Составлять формулы веществ,
различать классы соединений.
А зачем это
Слайд 7
Классификация веществ.
Вещества
Простые
Металлы
Неметаллы
Сложные
Оксиды
Соли
Основания
Кислоты
Кислоты – это сложные вещества, состоящие из
HxКОx- – общая формула
Соли – это сложные вещества, состоящие из катиона металла и кислотного остатка.
MexKOy – общая формула
Основания – это сложные вещества, состоящие из катиона металла и одного или нескольких гидроксогрупп.
Me(ОH)x – общая формула
- OH - гидроксогруппа
Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород.
ЭхОу – общая формула.
Слайд 9ПЛАНЕТА ОКСИДОКС
СаО оксид кальция
PbO оксид свинца (II)
CO2 оксид углерода(IV)
Na2O оксид
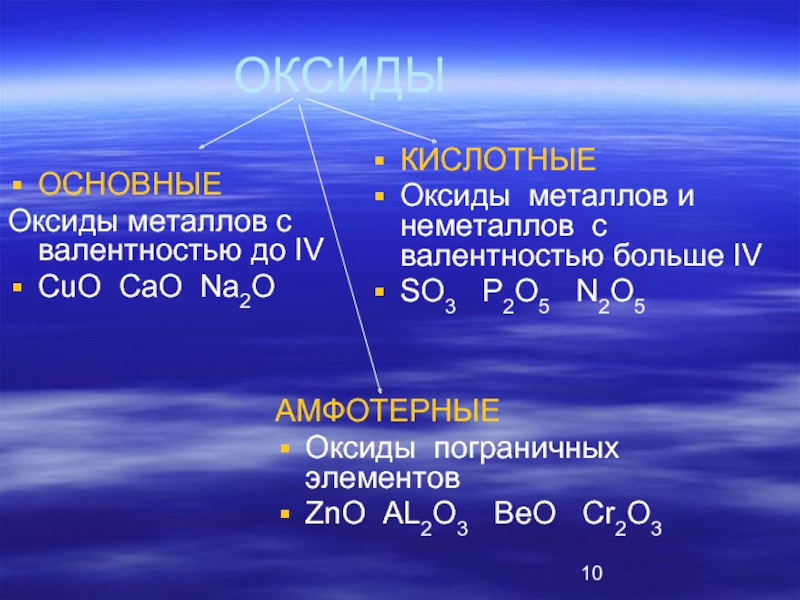
Слайд 10ОКСИДЫ
ОСНОВНЫЕ
Оксиды металлов с валентностью до IV
СuO CaO Na2O
КИСЛОТНЫЕ
Оксиды металлов
SO3 P2O5 N2O5
АМФОТЕРНЫЕ
Оксиды пограничных элементов
ZnO AL2O3 BeO Cr2O3
Слайд 13ПЛАНЕТА ОСНОВОКС
Fe(OH)3 гидроксид железа (III)
NaOH гидроксид натрия
Cr(OH)3
Слайд 15ВНИМАНИЕ
ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ С ОСНОВАНИЯМИ
ЗАДАНИЕ ДЛЯ АГЕНТОВ «МАЛИНА»
ОПРЕДЕЛИТЬ В
Слайд 18
Пропуск на планету:
техника безопасности при обращении с кислотами
Задание агентам «сыщики»
ПЛАНЕТА КИСЛОКС
Слайд 20
ЗАПИШИТЕ УРАВНЕНИЯ РЕАКЦИЙ до конца
NaOH +
Na2SO4+2H2O
ZnCl2 + H2
2NaOH + H2SO4
Zn + 2HCl
Слайд 21КИСЛОТЫ
Кислородосодержащие
H3PO4 фосфорная
HNO3 азотная
H2SO4 серная
H2S сероводородная
НCl хлороводородная
Слайд 22ЗАПОМНИ
НЕСТОЙКИЕ КИСЛОТЫ
Угольная H2СO3
Н2О
SО2
Сернистая H2SO3
Н2О
Нерастворимая кислота
Кремниевая H2SiO3
Слайд 25Планета солюкс
Запишите реакцию
Сульфат натрия +
+ Хлорид бария = ?
Na2SO4 +
Слайд 27ЗАПИШИ В СПРАВОЧНИК
Mg(OH)2 – для очистки сахара, компонент
H2S – раствор. Лечебные сероводородные ванны!
СаСО3 - мрамор, мел.
SiO2 - кварцевый песок, стекло
Слайд 28МЫ СЕГОДНЯ УЗНАЛИ:
Классификация оксидов
основные, кислотные и амфотерные
Классификация
Растворимые- щелочи
и нерастворимые
Нестойкие кислоты
Н2СО3 и Н2SО3
Нерастворимая кислота
Н2SiO3
Формула мела
SiO2
Формула кварцевого песка
СаСО3