және химиялық технология кафедрасы
Тақырыбы:
Суды жұмсарту
Орындаған: МХТОВБ 11 магистранты
Меңдіхан Қ.Қ
Тексерген: доцент Гумаров М.Х
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Суды жұмсарту презентация
Содержание
- 1. Суды жұмсарту
- 2. Суға кермектілік беретін кальций және магний қосылыстарынан
- 3. Физикалық әдіс – суды термиялық өңдеуге негізделінген,
- 4. Химиялық (реагенттік) әдістер – негізінде ағын су
- 5. Өндірісте көбінесе әк – сода және фосфат
- 6. Фосфат әдісі – кермек суды натрий фосфатымен
- 7. Химиялық әдістердің кемшіліктері: реагенттер көп жұмсалынады;
- 8. ФИЗИКА-ХИМИЯЛЫҚ ӘДІС – ИОН АЛМАСУ ӘДІСІ
- 9. Өндірістерде көбінесе Na катиониттер ретінде алюмосиликаттар қолданылады
- 10. Иондар алмасу процесінің механизмін мынадай сұлбамен өрнектеуге
- 11. Н – катионит қолданғанда ион алмасу процессінің
- 12. Анион алмасу сұлбасын өрнектеу: 2[Ан]OH+H2SO4= [Ан]2SO4+2H2O
Слайд 1Жәңгір хан атындағы Батыс Қазақстан аграрлық – техникалық университеті
Машина жасау факультеті
Химия
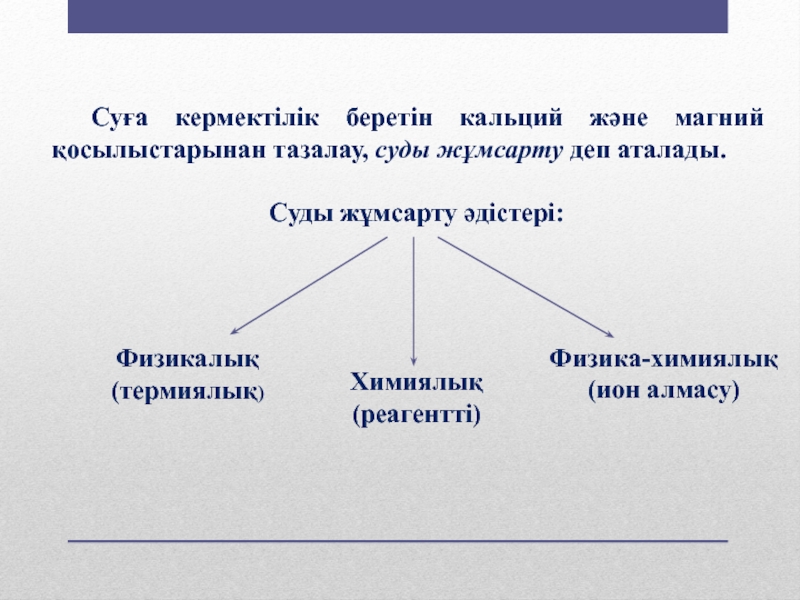
Слайд 2 Суға кермектілік беретін кальций және магний қосылыстарынан тазалау, суды жұмсарту деп
аталады.
Суды жұмсарту әдістері:
Суды жұмсарту әдістері:
Физикалық
(термиялық)
Химиялық
(реагентті)
Физика-химиялық
(ион алмасу)
Слайд 3 Физикалық әдіс – суды термиялық өңдеуге негізделінген, яғни қайнау, дистилляциялау және
қатыру.
Судың жұмсару тиімділігін арттыру үшін 95-980С қайнатқанда бикарбонаттар ыдырап карбонатқа ауысып тұнбаға түседі:
Ca(HCO3)2=CaCO3+H2O+CO2
Mg(НСО3)2 = MgCO3 + СО2 + Н2О
Түзілген магний карбонатын әк суымен әрекеттестіріп, қиын еритін магний гидроксидіне айналдырады.
MgCO3 + Са(ОН)2 = СаСО3 + Mg(OH)2
Судың жұмсару тиімділігін арттыру үшін 95-980С қайнатқанда бикарбонаттар ыдырап карбонатқа ауысып тұнбаға түседі:
Ca(HCO3)2=CaCO3+H2O+CO2
Mg(НСО3)2 = MgCO3 + СО2 + Н2О
Түзілген магний карбонатын әк суымен әрекеттестіріп, қиын еритін магний гидроксидіне айналдырады.
MgCO3 + Са(ОН)2 = СаСО3 + Mg(OH)2
Слайд 4 Химиялық (реагенттік) әдістер – негізінде ағын су құрамындағы уытты заттардың уытын
басуға және бейорганикалық қоспалардан тазартуға негізделінген.
Реагенттік әдіске жататындар: қышқылдарды және сілтілерді, иондарды ерімейтін қоспаларға айналдыру, бейорганикалық заттарды қоса тұндыру.
Химиялық әдістер – оны қолданғанда Са (ІІ) және Mg (ІІ) иондары әртүрлі реагенттермен мүлдем ерімейтін қосынды болып түзіледі. Реагент түрінде әк, кальцийленген сода, натрий және барий гидроксидтері және басқа да заттар қолданылады.
Реагенттік әдіске жататындар: қышқылдарды және сілтілерді, иондарды ерімейтін қоспаларға айналдыру, бейорганикалық заттарды қоса тұндыру.
Химиялық әдістер – оны қолданғанда Са (ІІ) және Mg (ІІ) иондары әртүрлі реагенттермен мүлдем ерімейтін қосынды болып түзіледі. Реагент түрінде әк, кальцийленген сода, натрий және барий гидроксидтері және басқа да заттар қолданылады.
Слайд 5 Өндірісте көбінесе әк – сода және фосфат әдістерін қолданады.
Әк –
сода әдістері бойынша суды алғашынды әксуымен, сонан соң сода ертіндісімен өңдейді. Химиялық процестердің нәтижесін де кальций тұздары ерімейтін кальций карбонаттарына, магний тұздары магний гидроксидіне және карбонатына айналады.
Mg(HCO3)2+2Ca(OH)2=Mg(OH)2+2H2O+CaCO3
CaCl2+Na2CO3=2NaCl+CaCO3
MgSO4+Na2CO3=Na2SO4+MgCO3
Әк – сода әдісі көп қолданылатын және ең арзан әдіс, бірақ жұмсарту дәрежесі төмен (шамамен 0,3 мг-экв×л-1 шамасында).
Mg(HCO3)2+2Ca(OH)2=Mg(OH)2+2H2O+CaCO3
CaCl2+Na2CO3=2NaCl+CaCO3
MgSO4+Na2CO3=Na2SO4+MgCO3
Әк – сода әдісі көп қолданылатын және ең арзан әдіс, бірақ жұмсарту дәрежесі төмен (шамамен 0,3 мг-экв×л-1 шамасында).
Слайд 6 Фосфат әдісі – кермек суды натрий фосфатымен өңдеуге негізделінген.
3Ca(HCO3)2+2Na3PO4=6NaHCO3+Ca3(PO4)2
3CaCl2+2Na3PO4=6NaCl+Ca3(PO4)2
Суды жұмсартудың фосфатты
әдісі қымбат болғандықтан, өзінше бөлек қолданылмайды. Бұл әдіспен суды жұмсартатын басқа әдістерді қолданып, болғаннан кейін, (мысалы: әк, және сода қоспасынан кейін) одан әрі қарай жұмсарту үшін ғана қолданылып жүр. Реагент ретінде три немесе динатрифосфат қолданылыды. Бұл реагенттерді суға қосқан кезде, магний мен кальцийдің нашар еритін фосфаттары түзіледі:
Слайд 7Химиялық әдістердің кемшіліктері:
реагенттер көп жұмсалынады;
тұндырғыш және аппараттар көп орын алады, тым
үлкен;
жаңа қосындылар түзіледі – тұнбалар, олар көп мөлшерде жыйналып жер қыртысын ластайды және т.б.
жаңа қосындылар түзіледі – тұнбалар, олар көп мөлшерде жыйналып жер қыртысын ластайды және т.б.
Слайд 8ФИЗИКА-ХИМИЯЛЫҚ ӘДІС – ИОН АЛМАСУ ӘДІСІ
Ион алмасу әдісі - суды арнаулы
материалдар арқылы өткізгенде солардың құрамындағы Na(I) немесе H(I) иондары судың құрамындағы Ca(II) Mg(II) иондарына алмастырылады. Иониттер катиониттер және аниониттерге жіктелінеді. Катиониттер құрамында қозғалмалы натрий немесе сутек катиондары болғандықтан олар натрий катиониті немесе Н (сутек) катиониті деп аталады. Аниониттер құрамында қозғалмалы гидроксиль топтары болғандықтан – ОН-аниониты деп аталынады.
Слайд 9 Өндірістерде көбінесе Na катиониттер ретінде алюмосиликаттар қолданылады (глауконит, цеолит, пермутит және
т.б.).
Н – катиониттер ретінде сульфирленген көмір (концентрлі күкірт қышқылымен өңделген көмір) және тағы басқа да синтетикалық шайырлар, құрамында окси, карбоксил және сульфо топтары бар, фенол, резорцин, пирогаллол, таннин және басқа үлкен молекулалы қосылыстар.
Аниониттер ретінде карбомидтер, меламин, грандин, анилин метафенилендиамин және басқа да синтетикалық үлкен молекулалық қосылыстар қолданылады.
Н – катиониттер ретінде сульфирленген көмір (концентрлі күкірт қышқылымен өңделген көмір) және тағы басқа да синтетикалық шайырлар, құрамында окси, карбоксил және сульфо топтары бар, фенол, резорцин, пирогаллол, таннин және басқа үлкен молекулалы қосылыстар.
Аниониттер ретінде карбомидтер, меламин, грандин, анилин метафенилендиамин және басқа да синтетикалық үлкен молекулалық қосылыстар қолданылады.
Слайд 10 Иондар алмасу процесінің механизмін мынадай сұлбамен өрнектеуге болады. Мысалы, катион алмастырғыш
алюмосиликат катионитының қатысуымен Na2O×Al2O3×2SiO2×nH2O жүретін алмасу процесі,
Na2O[Кат]+CaCl2= CaO[Кат]+2NaCl (a)
Мұнда: [Кат] - алмасуға қатыспайтын молекула бөлігі, яғни Al2O3×2SiO2×nH2O
Na2O[Кат]+CaCl2= CaO[Кат]+2NaCl (a)
Мұнда: [Кат] - алмасуға қатыспайтын молекула бөлігі, яғни Al2O3×2SiO2×nH2O
Слайд 11 Н – катионит қолданғанда ион алмасу процессінің мехнизмінің сұлба өрнегі:
H2[Кат]+CaSO4= Ca[Кат]+H2SO4
(ә)
H2[Кат]+Ca(HCO3)2= Ca[Кат]+2H2O+2CO2 (б)
Иониттердің ион алмасу қабілеті белгілі шамада (мөлшерде) болады. Уақыт өткен сайын алмасатын ион саны азаяды, яғни қоры таусыла бастайды, сондықтан алмасатын иондарды қайтадан толықтандыру мақсатпен ионитты регенерациялайды, мысалы ас тұзы ертіндісімен немесе қышқыл ертіндісімен катионитты жуады.
H2[Кат]+Ca(HCO3)2= Ca[Кат]+2H2O+2CO2 (б)
Иониттердің ион алмасу қабілеті белгілі шамада (мөлшерде) болады. Уақыт өткен сайын алмасатын ион саны азаяды, яғни қоры таусыла бастайды, сондықтан алмасатын иондарды қайтадан толықтандыру мақсатпен ионитты регенерациялайды, мысалы ас тұзы ертіндісімен немесе қышқыл ертіндісімен катионитты жуады.
Слайд 12Анион алмасу сұлбасын өрнектеу:
2[Ан]OH+H2SO4= [Ан]2SO4+2H2O (в)
Анионитты регенерациялау үшін оны сілті ертіндісімен
жуады.
[Ан]2SO4+2NaOHÛNa2SO4+2[Ан]-OH
Суды Na – катиониты арқылы өткізіп кальций және магний иондарынан тазартып, натрий ионын Н-катионит арқылы өткізіп сутек ионымен алмастырып, әрі қарай анионит сүзгіде судан аниондарды бөліп алып, су сүзгіштен өтіп көміроксидінен (4) тазарту үшін дегазаторға ауысады, осылай тазартылған су тұтынушыға ұсынылады.
[Ан]2SO4+2NaOHÛNa2SO4+2[Ан]-OH
Суды Na – катиониты арқылы өткізіп кальций және магний иондарынан тазартып, натрий ионын Н-катионит арқылы өткізіп сутек ионымен алмастырып, әрі қарай анионит сүзгіде судан аниондарды бөліп алып, су сүзгіштен өтіп көміроксидінен (4) тазарту үшін дегазаторға ауысады, осылай тазартылған су тұтынушыға ұсынылады.









![Н – катионит қолданғанда ион алмасу процессінің мехнизмінің сұлба өрнегі:H2[Кат]+CaSO4= Ca[Кат]+H2SO4 (ә)H2[Кат]+Ca(HCO3)2= Ca[Кат]+2H2O+2CO2 (б) Иониттердің ион](/img/tmb/5/428889/d3dbcc5e0aa2a9e1bb20e3a5621c56b9-800x.jpg)
![Анион алмасу сұлбасын өрнектеу: 2[Ан]OH+H2SO4= [Ан]2SO4+2H2O (в) Анионитты регенерациялау үшін оны сілті ертіндісімен жуады. [Ан]2SO4+2NaOHÛNa2SO4+2[Ан]-OH Суды Na – катиониты](/img/tmb/5/428889/342de7180a550ca6090d14e53429cd15-800x.jpg)





