- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 5 Получение водорода электролизом воды презентация
Содержание
- 1. Лекция 5 Получение водорода электролизом воды
- 2. Физико-химические основы процесса электролиза воды
- 3. Значение электродного потенциала зависит от концентрации с
- 4. Обратимое выделение или поглощение теплоты в электрохимической
- 5. для получения 1 м3 (90 г) водорода
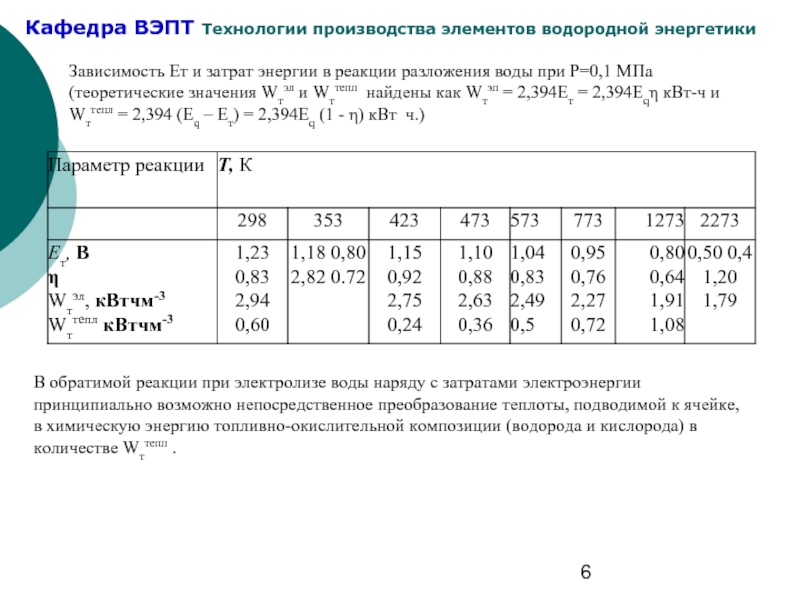
- 6. Зависимость Ет и затрат энергии в реакции
- 7. В области (3) Е"q ≤U≤ Е'q при
- 8. В условиях ЭХ равновесия поверхность электрода в
- 9. Поляризация электродов: возникает из-за конечной скорости разряда
- 10. Концентрационная поляризация ∆φk логарифмически зависит от плотности
- 11. В реальных электролизерах всегда U>Еq, т. е.
- 12. Тепловой баланс При отсутствии утечек тока все
- 13. Удельные энергозатраты Затраты электроэнергии на единицу продукции
- 14. Основные типы электролизеров и их характеристики По
- 15. Электролизеры со щелочным электролитом Обычно фильтр-прессного типа.
- 16. Электродные реакции в щелочном электролизере : На
- 17. Катализаторы анодного процесса выделения кислорода. Ряд электрохимической
- 18. Проблема диафрагм Совершенствование пористых разделительных диафрагм (мембран)
- 19. Пути совершенствования щелочных электролизеров: увеличение температуры и
- 20. Основные характеристики мощных щелочных электролизеров для работы
- 21. Твердополимерные электролизеры Мембрана Nafion Протонообменная мембрана Nafion®
- 22. Если мембрану увлажнить, то кислотные группы –SO3H
- 23. Полимерная мембрана – кислота, - нужно использовать
- 24. Твердооксидные электролизеры Затраты энергии на электролиз
- 25. В ТОЭ используется керамический электролит (стабилизированная иттрием
- 26. Стоимость водорода, получаемого электролизом воды Современные электролизные
- 27. Направления развития Уменьшение ионного сопротивления мембран Уменьшение
Слайд 1Лекция 5 Получение водорода электролизом воды
Физико-химические основы электролиза воды
Основные типы
Щелочные электролизеры
Электролизеры с твердым полимерным электролитом
Твердооксидные электролизеры
Слайд 2Физико-химические основы процесса электролиза воды
CuSO4
-
-
-
-
Cu
+
+
+
+
+
+
Электрод: -
На межфазной границе раздела электрод — раствор протекают электродные процессы, и устанавливается разность потенциалов — электродный потенциал, значение которого зависит от природы протекающей на поверхности электрода электрохимической реакции.
Непосредственно измерить можно только разность электродных потенциалов нескольких электродов. Практическое значение имеют относительные электродные потенциалы, представляющие собой разность электродного потенциала рассматриваемого электрода и электрода сравнения, электродный потенциал которого условно принят равным нулю.
Равновесный электродный потенциал: напряжение ячейки, составленной из этого электрода и электрода сравнения, при условии, что на всех фазовых границах ячейки установилось равновесие.
Электродный потенциал Е, соответствующий условиям равновесия, связан с изменением энергии Гиббса ∆G электрохимической реакции, протекающей на электроде (электродной реакции), соотношением (1):
z — число электронов, участвующих в электрохимическом равновесии; F—число Фарадея:F=NAe (2)
Слайд 3Значение электродного потенциала зависит от концентрации с или активности аМе веществ,
R—универсальная газовая постоянная; Т — температура; Е0 — нормальный электродный потенциал, соответствующий электродному потенциалу системы, в которой активность находящихся в электрохимическом равновесии веществ равна единице.
Электрод может состоять из нескольких последовательно включенных фаз, и на каждой из межфазных границ может осуществляться какая-то отдельная стадия полной электродной реакции. Поэтому электродную реакцию следует рассматривать как суммарный, итоговый процесс, который слагается из ряда последовательных стадий.
Если вместо изменения энергии Гиббса подставить алгебраическую сумму химических потенциалов μi, всех компонентов полной реакции, то ЭДС ячейки (4):
где νi-— стехиометрический коэффициент компонента i в суммарной реакции ячейки. Продифференцировав (1) по температуре, получим температурный коэффициент ЭДС ячейки (5):
Слайд 4Обратимое выделение или поглощение теплоты в электрохимической ячейке определяется величиной (6):
где
Если ∆H <∆G, то энергия, освобождаемая при реакции, оказывается больше той, которая может быть превращена во внешнюю работу, и ячейка разогревается. Если, ∆H >∆G, то в работу превращается больше энергии, чем освобождается при реакции, и ячейка охлаждается. Т.е., выделение или поглощение теплоты при обратимой работе ячейки определяется соотношением (7):
С учетом уравнения Гиббса — Гельмгольца (8):
и 1, 5, зависимость для энтальпии (теплового эффекта реакции) (9):
Зависимость ЭДС ячейки от давления, важная для газовых электродов (из 1), (10):
∆V —изменение объема системы при стехиометрическом превращении на 1 моль образовавшегося газа. Пренебрегая изменениями объемов жидких и твердых фаз:
Слайд 5для получения 1 м3 (90 г) водорода требуется 805 г воды
Теоретическое значение ЭДС ячейки Ет, необходимой для осуществления обратимой реакции разложения воды, определяется соотношением соответствует той части энергии, которую необходимо подвести в виде работы:
Тепловой эффект реакции разложения воды – это ∆H - сумма работы и теплоты, затраченных в процессе. Соответствующее тепловому эффекту напряжение ячейки Еq=∆H/zF называется термонейтральным напряжением. Оно равно напряжению ячейки в гипотетическом изобарно-изотермическом обратимом процессе, при котором отсутствует тепломассообмен с внешней средой и вся необходимая для реакции энергия (сумма необходимых теплоты и работы) подводится в виде электроэнергии.
Т.к. ∆H очень слабо зависит от температуры, Еq практически постоянно и при электролизе воды с учетом теплоты испарения составляет .Е'q=1,481 В, а при электролизе водяного пара Е'q=1,25 В.
Доля работы, необходимой для разложения воды, по отношению к полным затратам энергии в электрохимическом процессе η равна отношению Ет/Еq, т.к. Ет для воды с ростом Т уменьшается (при атмосферном давлении dЕт/dТ=—0,25 мВ-К-1) при повышении Т доля теплоты возрастает и при T~5000 К практически вся энергия, необходимая для разложения воды, используется в виде теплоты (η~0).
Слайд 6Зависимость Ет и затрат энергии в реакции разложения воды при Р=0,1
В обратимой реакции при электролизе воды наряду с затратами электроэнергии принципиально возможно непосредственное преобразование теплоты, подводимой к ячейке, в химическую энергию топливно-окислительной композиции (водорода и кислорода) в количестве Wттепл .
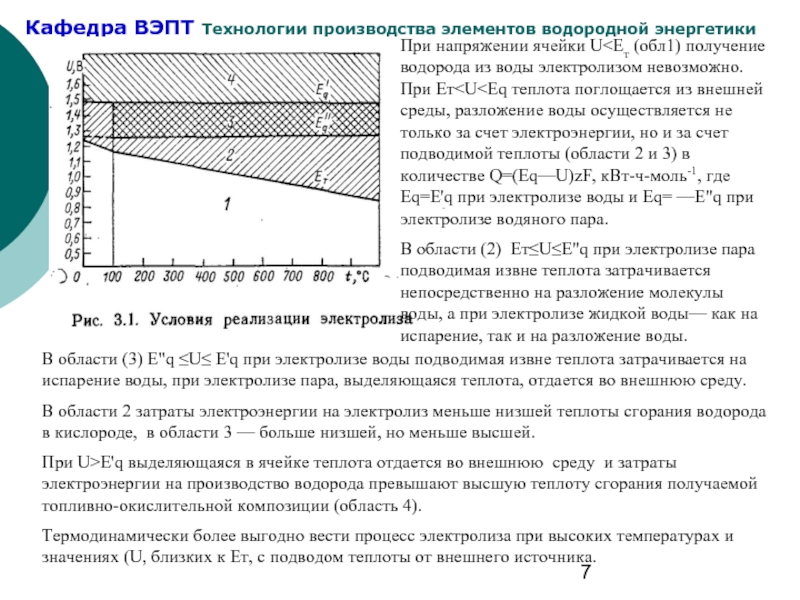
Слайд 7В области (3) Е"q ≤U≤ Е'q при электролизе воды подводимая извне
В области 2 затраты электроэнергии на электролиз меньше низшей теплоты сгорания водорода в кислороде, в области 3 — больше низшей, но меньше высшей.
При U>Е'q выделяющаяся в ячейке теплота отдается во внешнюю среду и затраты электроэнергии на производство водорода превышают высшую теплоту сгорания получаемой топливно-окислительной композиции (область 4).
Термодинамически более выгодно вести процесс электролиза при высоких температурах и значениях (U, близких к Ет, с подводом теплоты от внешнего источника.
При напряжении ячейки U<Ет (обл1) получение водорода из воды электролизом невозможно. При Ет
Слайд 8В условиях ЭХ равновесия поверхность электрода в растворе имеет нулевой заряд:
Iо — стандартный ток обмена (при а=1); а — кажущийся коэффициент переноса ионов в растворе; z—заряд иона; F—число Фарадея; φ — фактический электродный потенциал; φ0 — равновесный электродный потенциал. Величина ∆φ = φ — φ 0 показывает, насколько должен быть удален электродный потенциал от равновесного его значения для обеспечения необходимой скорости реакции разряда или образования ионов I, и называется перенапряжением (поляризацией) электрода.
При постоянной активности ионов в растворе (из 14), ∆φ -линейная функция логарифма I, что выражается известным уравнением Тафеля:
∆φ=A-BlnI
где А и В — константы. Константа В -тафелевский наклон (параметр Тафеля), пропорциональна температуре, обратно пропорциональна кажущемуся коэффициенту переноса и определяется процессами в растворе и материалом электрода, но не состоянием его поверхности. Константа А определяется процессами на межфазной границе и в большей степени зависит от материала электрода и состояния его поверхности.
Слайд 9Поляризация электродов: возникает из-за конечной скорости разряда или образования ионов (химическая
Концентрационная поляризация ∆φконц : Наблюдается при значительных плотностях тока и продолжительном электролизе. Связана с замедленной скоростью поступления ионов из объема раствора к поверхности электродов, которое осуществляется диффузией через тонкий слой раствора вблизи поверхности.
На поверхности электрода в единицу времени нейтрализуется I/zF ионов. С ростом поляризации электрода поток ионов к его поверхности возрастает, так как уменьшается их концентрация на самой поверхности. Это возрастание ограничено предельным током Iпред, который соответствует концентрации ионов на поверхности электрода, равной нулю, т. е. когда все ионы, способные за счет диффузии в единицу времени попасть из объема раствора к поверхности электрода, немедленно разряжаются. Дальнейший рост поляризации электрода уже не приводит к возрастанию I.
Предельная плотность тока определяется уравнением (16):
где Di — коэффициент диффузии ионов; с — объемная концентрация ионов; δ — толщина диффузионного пограничного слоя; ni — число переноса ионов; КD — константа скорости диффузии.
Слайд 10Концентрационная поляризация ∆φk логарифмически зависит от плотности тока (17):
С ростом Т
При протекании тока в растворе возникает омическое падение напряжения ∆φом в электролите и в диафрагме, разделяющей электроды. Кроме того, выделение на электродах газообразных продуктов электролиза в виде пузырьков газа приводит к увеличению удельного сопротивления электролита вблизи электрода и уменьшению площади поверхности контакта электролит — электрод, т. е. к увеличению омических потерь (18):
где ∆φом — омические потери в электролите и пористой диафрагме; ∆φкат — катодное перенапряжение (суммарное ∆φ определяемое процессами на катоде); ∆φан — анодное перенапряжение (суммарное ∆φ, определяемое процессами на аноде).
Слайд 11В реальных электролизерах всегда U>Еq, т. е. теплота выделяется в окружающую
Распределение потерь напряжения
Суммарные энергетические потери в электролизной ячейке складываются из энергетических потерь на электродах, характеризующихся тафелевской зависимостью поляризационных кривых, и из омических потерь в электролите и местах контактов, пропорциональных плотности тока. Обобщенная вольт-амперная характеристика электролизной ячейки имеет вид (19):
U=A+BlnI+rI
а эффективное сопротивление ячейки rэф=dU/dI зависит от плотности тока:
rэф=B/I +r
и не зависит от активности (каталитичности) электродов.
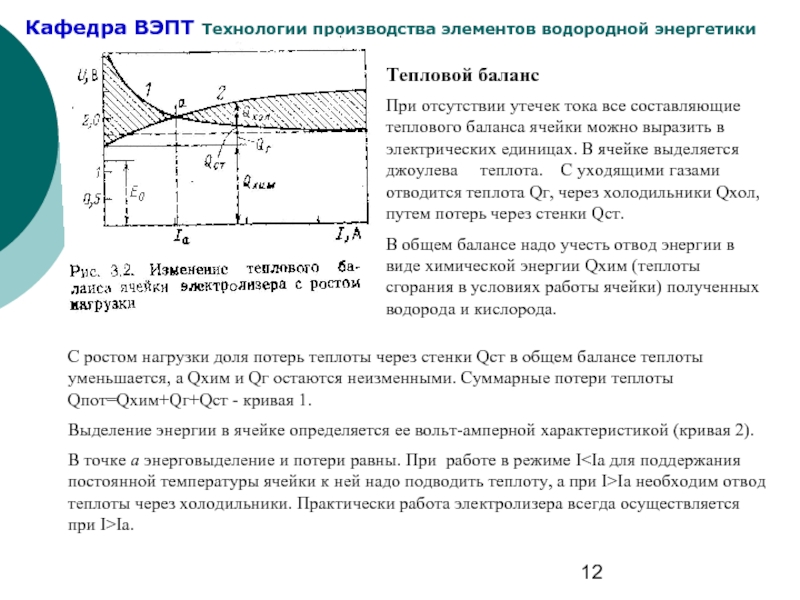
Слайд 12Тепловой баланс
При отсутствии утечек тока все составляющие теплового баланса ячейки можно
В общем балансе надо учесть отвод энергии в виде химической энергии Qхим (теплоты сгорания в условиях работы ячейки) полученных водорода и кислорода.
С ростом нагрузки доля потерь теплоты через стенки Qст в общем балансе теплоты уменьшается, а Qхим и Qг остаются неизменными. Суммарные потери теплоты Qпот=Qхим+Qг+Qст - кривая 1.
Выделение энергии в ячейке определяется ее вольт-амперной характеристикой (кривая 2).
В точке a энерговыделение и потери равны. При работе в режиме I
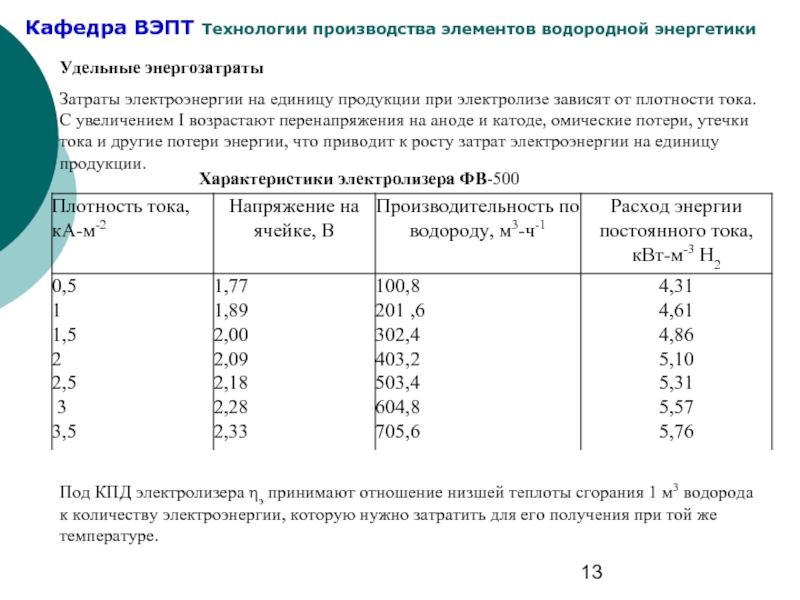
Слайд 13Удельные энергозатраты
Затраты электроэнергии на единицу продукции при электролизе зависят от плотности
Характеристики электролизера ФВ-500
Под КПД электролизера ηэ принимают отношение низшей теплоты сгорания 1 м3 водорода к количеству электроэнергии, которую нужно затратить для его получения при той же температуре.
Слайд 14Основные типы электролизеров и их характеристики
По конструкции и схеме включения в
По виду электролита: с водным щелочным электролитом (рабочая температура — до 500 К); с катионообменной мембраной (рабочая температура— до 423 К); с твердым окисным электролитом (рабочая температура 1100—1300 К.)
Слайд 15Электролизеры со щелочным электролитом
Обычно фильтр-прессного типа. Применяются два типа конструкций электролизных
В ячейке на рис. б каталитический слой 2 нанесен непосредственно на заполненную электролитом пористую диафрагму-сепаратор 1, генерация газа происходит на внутренней поверхности каталитического слоя; контактирующая с каталитическими слоями биполярная металл. пластина 3 разделяет две соседние ячейки и, обеспечивает сепарацию продуктов электролиза.
Омические потери складываются из потерь в диафрагме и на контактном сопротивлении между электродами и биполярной пластиной.
Слайд 16Электродные реакции в щелочном электролизере :
На катоде:
На аноде:
Наиболее существенны поляризационные
Ток обмена реакций зависит от материала (каталитичности) электродов и в соответствии с законом Аррениуса увеличивается с ростом температуры. Наиболее активными катализаторами катодного процесса выделения водорода являются металлы Ni, Pd, Рt, хорошо адсорбирующие водород. С точки зрения экономики целесообразно использовать неплатиновые катализаторы.
Для никелевых катодов, при температурах 298—373 К энергия активации процесса выделения водорода при I=1 А-см-2 составляет около 41 кДж-моль-1 Н2, при увеличении температуры от 298 до 363 К ток обмена возрастает от 10-7 до 2*10-5 А-см-2.
Слайд 17Катализаторы анодного процесса выделения кислорода. Ряд электрохимической активности металлов для этого
Типичные характеристики анодного процесса выделения кислорода на металлических катализаторах на основе Ni при электролизе водного раствора 30 % КОН при 353 К, I=2-10-5 А-см-2:
Пути повышения эффективности:
Развитие поверхности катализатора.
Гидрофобизация.-приводит к уменьшению отрывных диаметров газовых пузырьков, уменьшению степени заполнения поверхности газовой фазой и к увеличению поверхности контакта электролит — катализатор, т. е. к увеличению активности электродов. Гидрофобизация в большей степени влияет на эффективность анодного процесса выделения кислорода, чем на процессы на катоде, в связи с меньшими диаметрами пузырьков водорода.
Слайд 18Проблема диафрагм
Совершенствование пористых разделительных диафрагм (мембран) с целью уменьшения омических потерь.
Металлокерамические диафрагмы - хорошая коррозионная стойкость при повышенных температурах и относительно низкое сопротивление. В никелевых пористых дифрагмах с пористостью около 50%, размерами пор от 2 до 30 мкм и толщиной от 0,4 до 0,7 мм потери напряжения в 30 % КОН при Т=353 К и I~2 А-см-2 составляют от 0,1 до 0,25 В.
Пористые диафрагмы, не обладающие электронной проводимостью: уменьшается опасность коротких замыканий и увеличивается надежность работы электролизера. Наиболее распространенным материалом для таких диафрагм сегодня является асбестовая ткань или асбокартон, который, однако, недостаточно стабилен и подвержен коррозии при температурах Т> 350 К. Одной из важнейших задач является разработка коррозионно-стойких при повышенных температурах и прочных пористых материалов, не обладающих электронной проводимостью, для диафрагм щелочных электролизеров. В качестве таких исходных материалов в последнее время активно исследуются сульфонированный тетрафторэтилен, титанат бария, гексатитанат калия. Перспективным материалом для диафрагм может оказаться пористый окисленный никель.
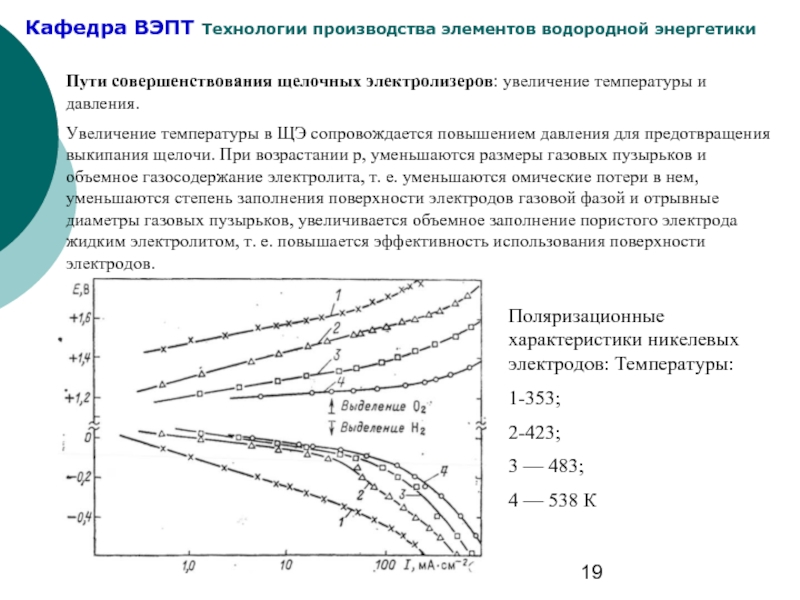
Слайд 19Пути совершенствования щелочных электролизеров: увеличение температуры и давления.
Увеличение температуры в
Поляризационные характеристики никелевых электродов: Температуры:
1-353;
2-423;
3 — 483;
4 — 538 К
Слайд 20Основные характеристики мощных щелочных электролизеров для работы под давлением
Плотность тока, кА-м-2 1—2
Напряжение
Затраты энергии на производство
водорода, кВт-ч-м-3 4,2—4,7
Рабочая температура, К 380—400
Рабочее давление, МПа 3—4
Тип электролита 25—30 % КОН
Производительность единичного агрегата
по водороду, м3-ч-1 100—750
Слайд 21Твердополимерные электролизеры
Мембрана Nafion
Протонообменная мембрана Nafion® представляет собой пленку из полимера, сочетающего
Достоинства ТПЭ:
Экологическая чистота
возможность работы при низких напряжениях на ячейке, больших плотностях тока, высоких давлениях и температурах
Высокая эффективность (80 – 90%)
Высокая чистота водорода (>99.999%)
Твердый электролит – нет риска утечек, как в щелочном Э-ре
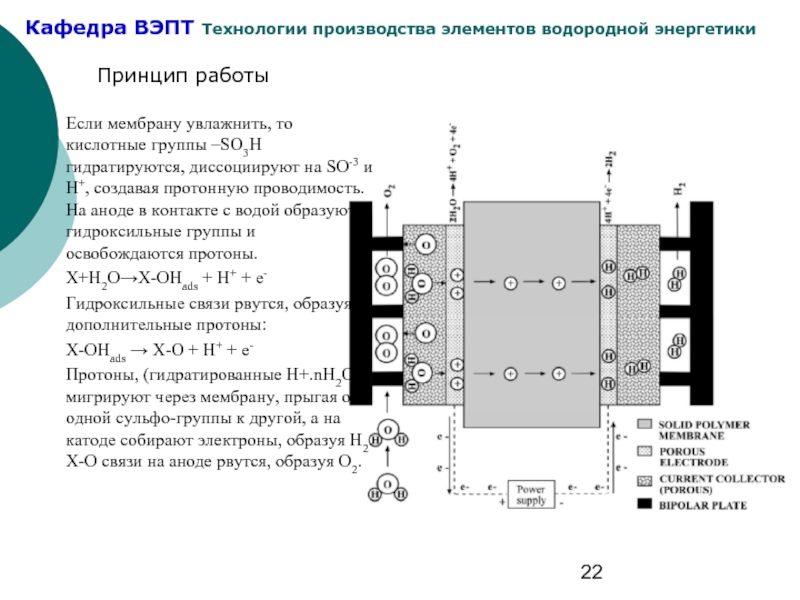
Слайд 22Если мембрану увлажнить, то кислотные группы –SO3H гидратируются, диссоциируют на SO-3
X+H2O→X-OHads + H+ + e-
Гидроксильные связи рвутся, образуя дополнительные протоны:
X-OHads → X-O + H+ + e-
Протоны, (гидратированные H+.nH2O), мигрируют через мембрану, прыгая от одной сульфо-группы к другой, а на катоде собирают электроны, образуя Н2. X-O связи на аноде рвутся, образуя О2.
Принцип работы
Слайд 23Полимерная мембрана – кислота, - нужно использовать коррозионно – стойкие материалы.
Катодные материалы: Pt Pd
Анодные материалы: Ir, IrO2, Rh, Pt, Rh-Pt, Pt-Ru
Биполярные пластины – графит
Удобно соединять ячейки последовательно – можно использовать более дешевые ИП
Обычные параметры: Т= 80-150°C, давление до 30 Атм., плотность тока до 2 А/см2, напряжение на ячейке 1.4 - 2 В
Устойчивы к изменениям питания, поэтому хорошо сочетаются с солнечными элементами.
Дорогие, т.к. используются драгметаллы.
Нужна чистая вода
Нужно контролировать перепад давлений на мембране.
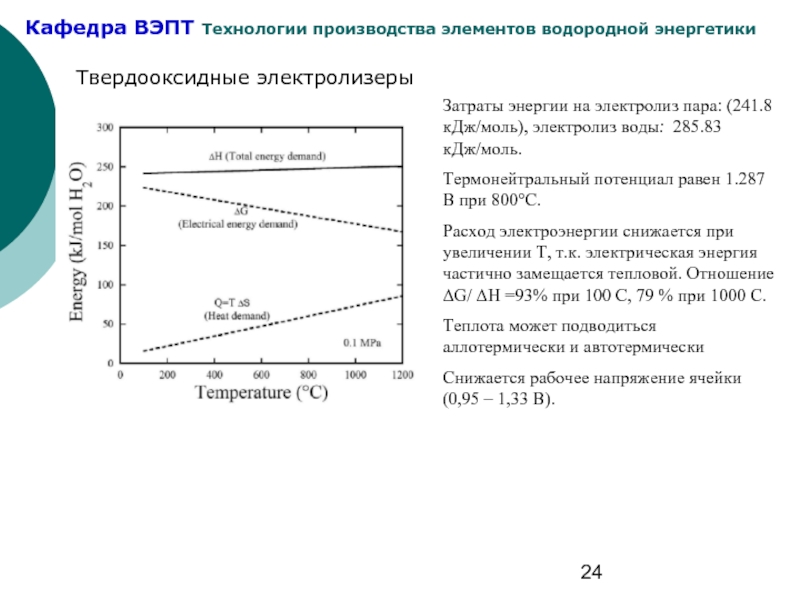
Слайд 24Твердооксидные электролизеры
Затраты энергии на электролиз пара: (241.8 кДж/моль), электролиз воды: 285.83
Термонейтральный потенциал равен 1.287 В при 800°C.
Расход электроэнергии снижается при увеличении Т, т.к. электрическая энергия частично замещается тепловой. Отношение ΔG/ ΔH =93% при 100 С, 79 % при 1000 С.
Теплота может подводиться аллотермически и автотермически
Снижается рабочее напряжение ячейки (0,95 – 1,33 В).
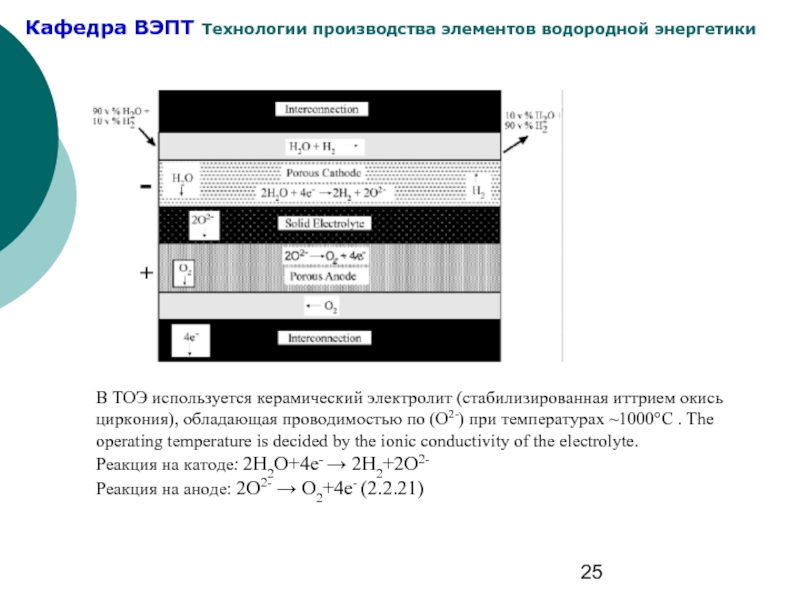
Слайд 25В ТОЭ используется керамический электролит (стабилизированная иттрием окись циркония), обладающая проводимостью
Реакция на катоде: 2H2O+4e- → 2H2+2O2-
Реакция на аноде: 2O2- → O2+4e- (2.2.21)
Слайд 26Стоимость водорода, получаемого электролизом воды
Современные электролизные установки имеют производительность~ 480 кг/день,
Достаточно для заправки 120 автомобилей ( по 4 кг).
Общая эффективность электролизной установки: 63.5% (НТС), включая все паразитные нагрузки кроме компрессора.
Электролизер работает при давлении 10 атм. Автомобили заправляются при 400 атм. На сжатие нужно 2.3 кВт/кг/час: нужно примерно на 5% увеличить потребление электричества.
Стоимость водорода определяется ценой электричества на электролиз и капитальными затратами.
Капитальные затраты на такую установку: 1000 US$/kW входной мощности.
Полная стоимость системы: 2.5 млн. US$.
При сроке окупаемости 7 лет, стоимости 0,07 $/kWh: стоимость Н2 $6.50/kg
Слайд 27Направления развития
Уменьшение ионного сопротивления мембран
Уменьшение паразитных потерь системы
Оптимизировать число компонентов системы
В
Совершенствовать катализатор
Конструкции биполярной пластины
Долговечность мембраны
Упрощение конструкции
Необходимо снижение удельной цены с $1000/kW до $125/kW в течение 15 – 20 лет.
Развитие ТОЭ может поднять эффективность системы в целом до 95%