Выполнил: Килыбаев Е.
Гр. 401 “Б” ТФП
Приняла: Бакытжанова А
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Управление качеством на фармацевтическом предприятии. Служба качества фармацевтических компаний презентация
Содержание
- 1. Управление качеством на фармацевтическом предприятии. Служба качества фармацевтических компаний
- 2. Система менеджмента качества предприятия фармацевтического профиля необходимо считать
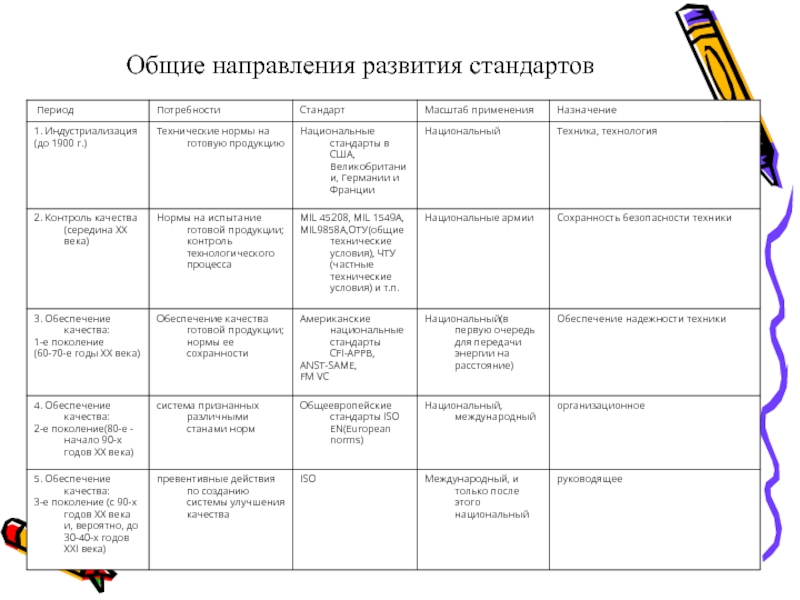
- 3. Общие направления развития стандартов
- 4. В настоящее время в развитии фармацевтического производства
- 5. Система менеджмента качества (СМК) – это система
- 6. Система обеспечения качества при производстве лекарственных средств
- 7. Необходимо отметить, что внедрение стандартов ИСО серии
- 8. Таблица 2 – Фармацевтические предприятия мира с сертифицированной системой качества
- 9. Основными преимуществами внедрения интегрированной системы менеджмента являются:
- 10. Систему обеспечения качества фармацевтического предприятия нужно рассматривать,
- 11. «На сегодня из 42 производителя лекарственных средств
- 12. Спасибо за внимание!!!!!!!
Слайд 1Южная Казахстанская Фармацевтическая Академия
Министерство Здравохранение Республики Казахстана
Технология лекарственных производств
Управление качеством на
фармацевтическом предприятии Служба качества фармацевтических компаний
Слайд 2Система менеджмента качества предприятия фармацевтического профиля необходимо считать комплексом процессов (наиболее часто
классифицируемых на основные, управленческие и обеспечивающие), с грамотно документированным определением их взаимосвязей и взаимодействия, формулированием показателей результативности и методов их мониторинга, условий анализа и политикой постоянного улучшения. Каждый из процессов этой системы должен управляться с учетом современных принципов менеджмента качества, а также быть согласованным с соответствующими требованиями правил GMP и отвечать действующим нормативным и законодательным требованиям. Один из главных концептуальных вопросов в этом направлении — создание рационального алгоритма выполнения всех описанных выше требований. Исходя из этого, представляется интересным разработать методологию формирования ИСМ в фармацевтической индустрии и изучить возможность и рациональность внедрения таких систем на отечественных предприятиях. Актуальность такой работы может быть подтверждена серьезной значимостью возникшей проблемы адаптации производителей лекарственных средств развивающихся стран к общепринятым в современном мире законам, нормативам, стандартам, а также желанием сформировать систему качественного производства и контроля лекарств в соответствии с требованиями GMP.
Слайд 4В настоящее время в развитии фармацевтического производства нашей страны наступил критический
момент, характеризующийся разнонаправленными тенденциями и, прежде всего, снижением конкурентоспособности большинства устаревших отечественных предприятий.
Понятия «качество» и «безопасность» должны стать девизом предприятий фармацевтической промышленности. Фармацевтический рынок мира динамично развивается, что приводит к повышению конкуренции и требовании к организации управления фармацевтическими предприятиями. В этих условиях определение основных направлений повышения конкурентоспособности является важной стратегической задачей фармацевтического предприятия.
Проведенный анализ фармацевтических предприятий стран – лидеров мировой экономики показывает, что достижения стратегической цели в управлении обеспечивается интегрированных систем использования европейских методов менеджмента качества, сертификация систем в соответствии с ISO 9000, GMP, GLP, GCP, GDP, т.д. [1]
Понятия «качество» и «безопасность» должны стать девизом предприятий фармацевтической промышленности. Фармацевтический рынок мира динамично развивается, что приводит к повышению конкуренции и требовании к организации управления фармацевтическими предприятиями. В этих условиях определение основных направлений повышения конкурентоспособности является важной стратегической задачей фармацевтического предприятия.
Проведенный анализ фармацевтических предприятий стран – лидеров мировой экономики показывает, что достижения стратегической цели в управлении обеспечивается интегрированных систем использования европейских методов менеджмента качества, сертификация систем в соответствии с ISO 9000, GMP, GLP, GCP, GDP, т.д. [1]
Слайд 5Система менеджмента качества (СМК) – это система внутрифирменного управления, направленная на
достижение определенных критериев качества выпускаемой продукции, созданная в организации для формирования политики в области качества и достижения поставленных задач. СМК позволяет создать на предприятии порядок, при котором ответственность персонала точно распределена и документирована. Особенностью современных подходов к менеджменту качества является то, что требования предъявляются не к качеству продукции напрямую, а к системе менеджмента, которая в свою очередь призвана обеспечивать предсказуемый и стабильный уровень качества продукции, процесса производства и деятельности организации в целом. СМК фармацевтического предприятия – это управляющая система, направляющая и контролирующая деятельность предприятия, связанную с качеством лекарственных средств. При этом непосредственными объектами управления являются факторы и условия, влияющие на качество лекарственных средств, а также процессы формирования качества лекарственных средств на разных стадиях и этапах производства. [2]
Слайд 6Система обеспечения качества при производстве лекарственных средств должна гарантировать, что:
Продукция разработана
с учетом всех требовании и стандартов;
На все операции по производству и контролю составлена четкая документация в соответствии с правилами стандарта;
Ответственность и полномочия строго определены;
Выполняются мероприятия по производству, поставке и использованию надлежащего исходного сырья и упаковочного материала;
Проводиться контроль промежуточной продукции и технологического процесса, а также валидация;
Контроль и проверка готовой продукции проводиться в соответствии с требованиями стандарта и законодательства;
Выполняется процедура проведения самоинспекции и/или аудита качества, по которой регулярно оценивают эффективность и пригодность системы обеспечения качества.
На все операции по производству и контролю составлена четкая документация в соответствии с правилами стандарта;
Ответственность и полномочия строго определены;
Выполняются мероприятия по производству, поставке и использованию надлежащего исходного сырья и упаковочного материала;
Проводиться контроль промежуточной продукции и технологического процесса, а также валидация;
Контроль и проверка готовой продукции проводиться в соответствии с требованиями стандарта и законодательства;
Выполняется процедура проведения самоинспекции и/или аудита качества, по которой регулярно оценивают эффективность и пригодность системы обеспечения качества.
Слайд 7Необходимо отметить, что внедрение стандартов ИСО серии 9000 на предприятии является
добровольным решением руководства и направлено, прежде всего, на повышение конкурентоспособности предприятия. В отличие от этого, внедрение стандарта GMP в медицинской промышленности РК с 2014 года при производстве готовых лекарственных средств является обязательным. В то же время становится все более очевидным, что осуществить такой переход невозможно без разработки и внедрения на предприятиях интегрированных систем менеджмента качества (ИСМ). Под интегрированной системой менеджмента понимается система, отвечающая требованиям двух и более международных стандартов, функционирующая как единое целое.
Для фармацевтических предприятий наиболее характерно создание интегрированной системы менеджмента, которая соответствует требованиям стандартов ИСО серии 9000 и правилам GMP. В связи с этим совершенствования деятельности на фармацевтическом предприятии необходимо внедрение интегрированных систем менеджмента, отвечающих требованиям международных стандартов и обобщающих мировой опыт системного управления. Количество фармацевтических предприятий с интегрированной системой менеджмента качества увеличивается с каждым годом.(табл. 2).
Для фармацевтических предприятий наиболее характерно создание интегрированной системы менеджмента, которая соответствует требованиям стандартов ИСО серии 9000 и правилам GMP. В связи с этим совершенствования деятельности на фармацевтическом предприятии необходимо внедрение интегрированных систем менеджмента, отвечающих требованиям международных стандартов и обобщающих мировой опыт системного управления. Количество фармацевтических предприятий с интегрированной системой менеджмента качества увеличивается с каждым годом.(табл. 2).
Слайд 9Основными преимуществами внедрения интегрированной системы менеджмента являются:
Изменение подхода к обеспечению качества
и безопасности лекарственных средств, что снижает потери от возникновения брака и отзыва продукции;
Четкое определение ответственности за обеспечение безопасности лекарственных средств;
Документальное подтверждение уверенности в безопасности лекарственных средств, что особо важно при работе с потребителем, в т.ч. при судебных разбирательствах.
Обеспечение системного подхода, включающего все параметры безопасности лекарственных средств – от сырья до потребителя;
Более экономное использование ресурсов для управления безопасностью;
Снижение финансовых издержек, связанных с выпуском некачественной продукции;
Повышение доверия потребителя к качеству выпускаемых лекарственных средств;
Обеспечение деятельности предприятия в целом и оптимального режима работы систем контроля и верификации в частности;
Увеличение возможностей выхода на новые рынки сбыта и расширение существующих;
Повышение готовности у зарубежных инвесторов идти на капиталовложение;
обеспечение репутации производителя качественных и безопасных лекарственных средств.
Четкое определение ответственности за обеспечение безопасности лекарственных средств;
Документальное подтверждение уверенности в безопасности лекарственных средств, что особо важно при работе с потребителем, в т.ч. при судебных разбирательствах.
Обеспечение системного подхода, включающего все параметры безопасности лекарственных средств – от сырья до потребителя;
Более экономное использование ресурсов для управления безопасностью;
Снижение финансовых издержек, связанных с выпуском некачественной продукции;
Повышение доверия потребителя к качеству выпускаемых лекарственных средств;
Обеспечение деятельности предприятия в целом и оптимального режима работы систем контроля и верификации в частности;
Увеличение возможностей выхода на новые рынки сбыта и расширение существующих;
Повышение готовности у зарубежных инвесторов идти на капиталовложение;
обеспечение репутации производителя качественных и безопасных лекарственных средств.
Слайд 10Систему обеспечения качества фармацевтического предприятия нужно рассматривать, как интегрированную систему, в
основе которой лежат стандарты (базовые и дополнительные).Базовые стандарты:
Серии ИСО 9000, описывающие организационную структуру управления качеством;
Стандарты GMP, которые содержат требования к производству и контролю качества лекарственных средств для человека и животных (СТ РК 1617-2006). [5]
Дополнительные стандарты:
Стандарты, устанавливающие требования к системе экологического менеджмента (ISO 14001:2004);
Стандарты, устанавливающие требования к системе менеджмента безопасности продукции (ИСО 22000-2007, Управление рисками по качеству ICH Q9, ISO 31000:2009); 1. Стандарты ИСО
Стандарты, устанавливающие требования к информационной безопасности (ISO/IEC 27001:2005);
Стандарты, устанавливающие требования в области охраны здоровья и безопасности труда (OHSAS 18001:2007);
Стандарты, помогающие предприятию разработать и внедрить эффективную систему управления, направленную на повышение уровня условий труда и жизненного уровня сотрудников компании (SA 8000; ISO 26000:2010).
Серии ИСО 9000, описывающие организационную структуру управления качеством;
Стандарты GMP, которые содержат требования к производству и контролю качества лекарственных средств для человека и животных (СТ РК 1617-2006). [5]
Дополнительные стандарты:
Стандарты, устанавливающие требования к системе экологического менеджмента (ISO 14001:2004);
Стандарты, устанавливающие требования к системе менеджмента безопасности продукции (ИСО 22000-2007, Управление рисками по качеству ICH Q9, ISO 31000:2009); 1. Стандарты ИСО
Стандарты, устанавливающие требования к информационной безопасности (ISO/IEC 27001:2005);
Стандарты, устанавливающие требования в области охраны здоровья и безопасности труда (OHSAS 18001:2007);
Стандарты, помогающие предприятию разработать и внедрить эффективную систему управления, направленную на повышение уровня условий труда и жизненного уровня сотрудников компании (SA 8000; ISO 26000:2010).
Слайд 11«На сегодня из 42 производителя лекарственных средств 4 производственных участков двух
производителей - АО «Химфарм» и АО «Нобел АФФ» имеют заключения о соответствии стандарту GMP».
18 производителей также планируют получить сертификаты GMP. Сейчас они делают для этого все возможное: строят новые здания, проводят реконструкцию старых зданий, обучают инженер-технологов и.т.д. Продолжается подготовка национального инспектората с привлечением международных специалистов. Всего по стране обучено свыше 200 специалистов государственного органа.
Проводится работа по вступлению Казахстана в международную систему сотрудничества фармацевтических инспекций (PIC/S). В марте 2015 Казахстан получил статус заявителя на присоединение к PIC/S.
PIC/S - международная организация, объединяющая фармацевтические инспекционные органы для обеспечения активного сотрудничества в области GMP.
18 производителей также планируют получить сертификаты GMP. Сейчас они делают для этого все возможное: строят новые здания, проводят реконструкцию старых зданий, обучают инженер-технологов и.т.д. Продолжается подготовка национального инспектората с привлечением международных специалистов. Всего по стране обучено свыше 200 специалистов государственного органа.
Проводится работа по вступлению Казахстана в международную систему сотрудничества фармацевтических инспекций (PIC/S). В марте 2015 Казахстан получил статус заявителя на присоединение к PIC/S.
PIC/S - международная организация, объединяющая фармацевтические инспекционные органы для обеспечения активного сотрудничества в области GMP.