- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Стволовые и опухолевые стволовые клетки. Определение, методы изучения, практическое применение презентация
Содержание
- 1. Стволовые и опухолевые стволовые клетки. Определение, методы изучения, практическое применение
- 2. Актуальность Глубокий интерес человечества к созданию новых
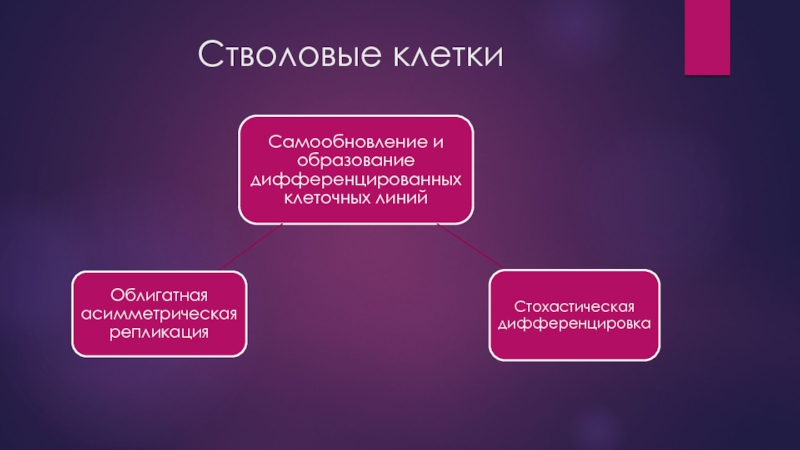
- 3. Стволовые клетки
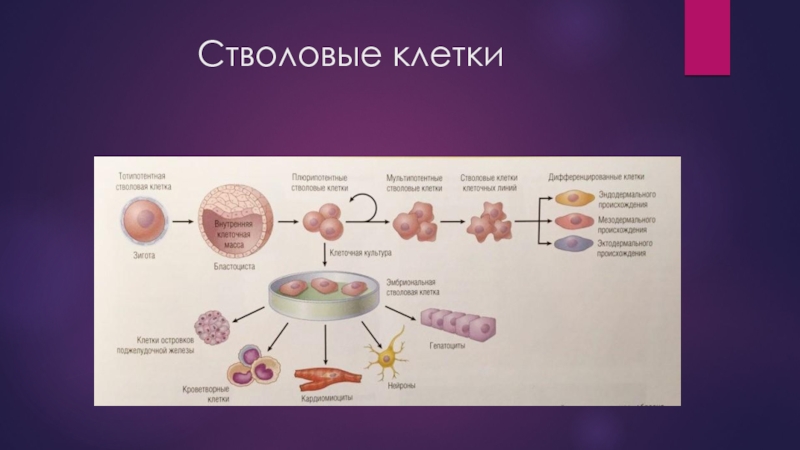
- 4. Стволовые клетки
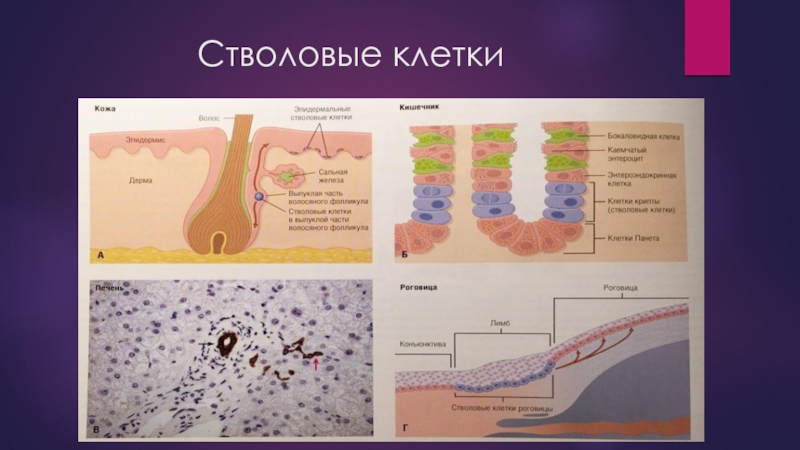
- 5. Стволовые клетки
- 6. Стволовые клетки При изучении особенностей различных соматических
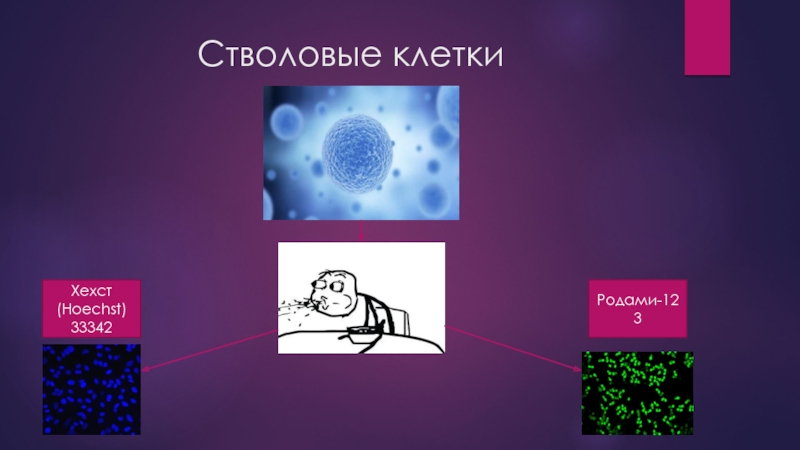
- 7. Стволовые клетки Хехст (Hoechst) 33342 Родами-123
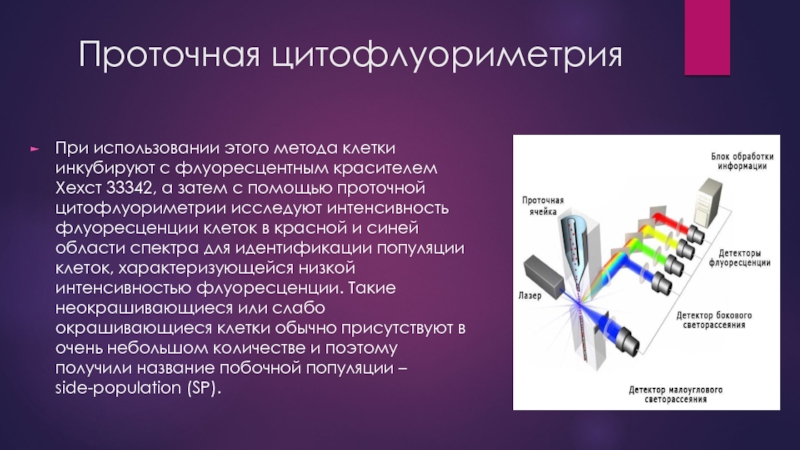
- 8. Проточная цитофлуориметрия При использовании этого метода клетки
- 9. Побочная популяция Побочная популяция, Side population (SP),–
- 10. Мезенхимальная стволовая клетка Александр Яковлевич Фриденштейн (1924—1998)
- 11. Мезенхимальная стволовая клетка Мезенхимальные СК (МСК) костного
- 12. Мезенхимальная стволовая клетка
- 13. Опухолевая стволовая клетка Опухолевая стволовая клетка
- 14. Опухолевая стволовая клетка SCID – мыши с
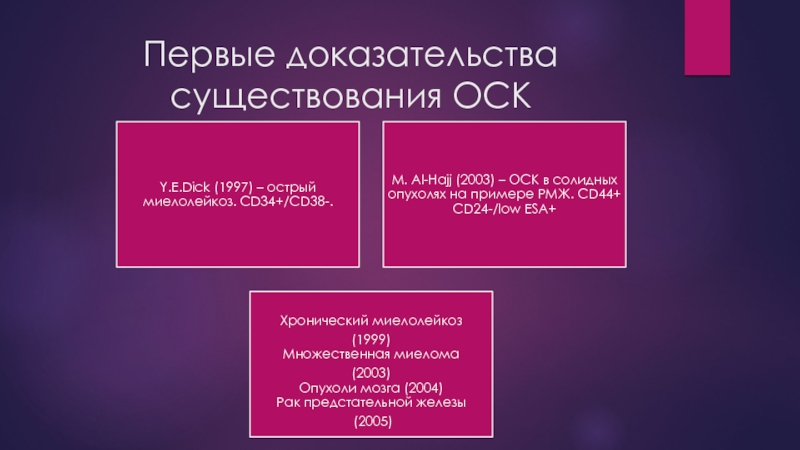
- 15. Первые доказательства существования ОСК
- 16. СК vs ОСК Необходимо подчеркнуть сходство
- 17. Первые выводы 1) В каждой опухоли присутствует
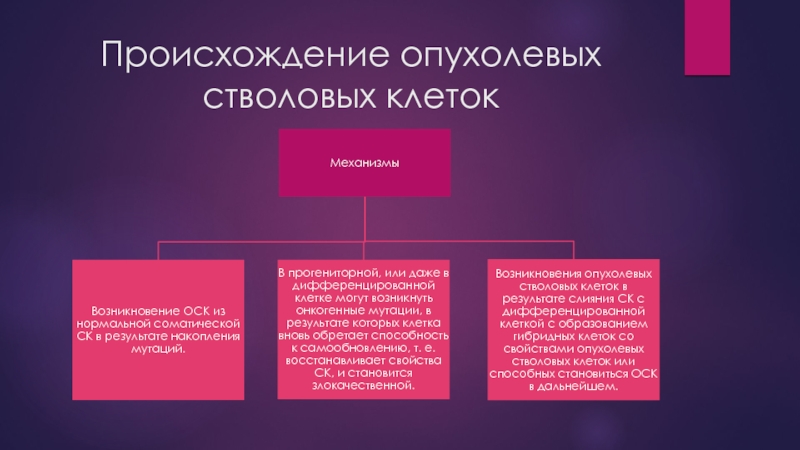
- 18. Происхождение опухолевых стволовых клеток
- 19. Происхождение опухолевых стволовых клеток В настоящее время
- 20. Особенности ОСК, определяющие устойчивость опухоли к химиотерапевтическим препаратам АТФ-зависимые транспортеры (АТР-binding cassette, или АВС-transporters),
- 21. Особенности ОСК, определяющие устойчивость опухоли к химиотерапевтическим
- 22. Опухолевые стволовые клетки и происхождение метастазов F.
- 23. Опухолевые стволовые клетки и происхождение метастазов
- 24. Выводы Крайне небольшое число раковых стволовых клеток
- 25. Выводы Одни исследователи возлагают надежды на клетки
Слайд 1Стволовые и опухолевые стволовые клетки. Определение, методы изучения, практическое применение.
ПОДГОТОВИЛ: ИНТЕРН
Слайд 2Актуальность
Глубокий интерес человечества к созданию новых методов регенеративной медицины с использованием
Слайд 6Стволовые клетки
При изучении особенностей различных соматических СК — кроветворных, нейральных и
Слайд 8Проточная цитофлуориметрия
При использовании этого метода клетки инкубируют с флуоресцентным красителем Хехст
Слайд 9Побочная популяция
Побочная популяция, Side population (SP),– популяция клеток, характеризующаяся отсутствием или
Слайд 10Мезенхимальная стволовая клетка
Александр Яковлевич Фриденштейн (1924—1998)
Основоположник учения о мезенхимальных стволовых клетках,
В его лаборатории было установлено, что данная популяция родоначальных клеток обнаруживается в костном мозге, в лимфоидных органах. Часть из них способна к циркуляции в крови
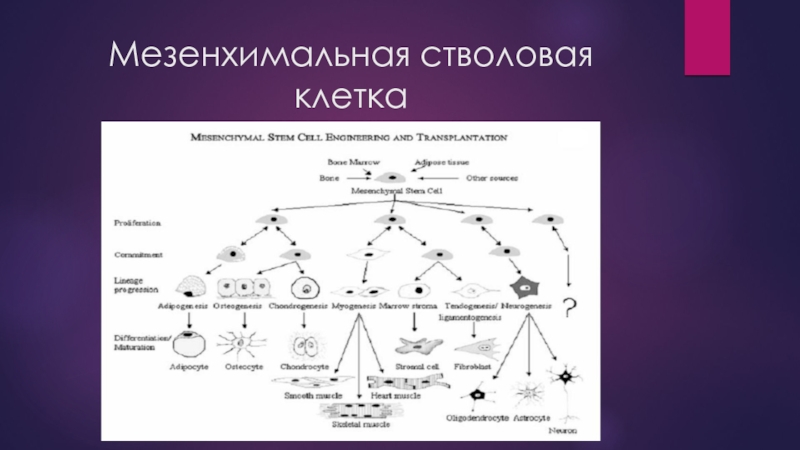
Слайд 11Мезенхимальная стволовая клетка
Мезенхимальные СК (МСК) костного мозга также способны дифференцироваться в
S. Sell даже постулирует, что тканевые СК по своей полипотентности равноценны покоящимся эмбриональным СК .
Слайд 13Опухолевая стволовая клетка
Опухолевая стволовая клетка (ОСК) - специфическая опухолевая клетка,
Слайд 14Опухолевая стволовая клетка
SCID – мыши с тяжелой иммунологической недостаточностью, иммунодефицит определяется
NOD-SCID – мыши SCID с диабетом без ожирения, иммунодефицит характеризуется отсутствием T-, B- и NK-лимфоцитов
Слайд 16
СК vs ОСК
Необходимо подчеркнуть сходство маркеров опухолевых стволовых клеток и названных выше
Следует отметить также, что опухолевые стволовые клетки разного происхождения при исследовании с флуоресцентными красителями Хехст 33342 и родамин-123, как и нормальные СК, обладают способностью исключать эти липофильные красители из клеток и образовывать SP.
Слайд 17Первые выводы
1) В каждой опухоли присутствует лишь очень небольшая доля опухолевых
2) Опухолевые стволовые клетки имеют определенные поверхностные маркеры, что позволяет успешно и воспроизводимо выделять их из общей массы опухолевых клеток с помощью проточной цитофлуориметрии или с помощью различных вариантов иммуноселекции.
3) Опухоли, развивающиеся из опухолевых стволовых клеток, содержат смешанную популяцию туморогенных и не туморогенных клеток, соответствующую гетерогенному клеточному составу исходной опухоли.
Слайд 19Происхождение опухолевых стволовых клеток
В настоящее время пока невозможно установить непосредственную связь
Слайд 20Особенности ОСК, определяющие устойчивость опухоли к химиотерапевтическим препаратам
АТФ-зависимые транспортеры (АТР-binding cassette,
Слайд 21Особенности ОСК, определяющие устойчивость опухоли к химиотерапевтическим препаратам
Транспортеры АВСВ1, АВСС1 и
АВСВ5 – новый, недавно открытый транспортер – обеспечивает, как и АВСВ1, АТФ-зависимый выброс флуоресцентного красителя родамин-123 из клеток и обнаруживается в СD133+-клетках среди опухолевых клеток из эпидермальных меланоцитов человека и в клетках злокачественной меланомы человека – устойчивость к доксирубицину.
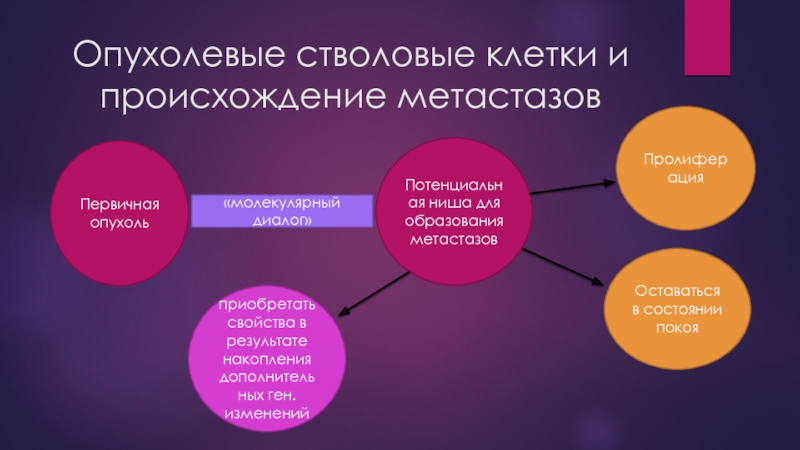
Слайд 22Опухолевые стволовые клетки и происхождение метастазов
F. Li и соавторы предполагают, что
Клетки ниши секретируют факторы, регулирующие баланс между пролиферацией и дифференцировкой СК, а также факторы, обеспечивающие удержание («заякоревание») СК в ее нише.
Слайд 23Опухолевые стволовые клетки и происхождение метастазов
Первичная опухоль
Потенциальная ниша для образования метастазов
«молекулярный
Пролиферация
Оставаться в состоянии покоя
приобретать свойства в результате накопления дополнительных ген. изменений
Слайд 24Выводы
Крайне небольшое число раковых стволовых клеток может давать начало опухолевому процессу,
Современные методы лечения онкологических заболеваний имеют своей целью уничтожение всех опухолевых клеток. Но, как показывают исследования последних лет, за развитие патологического процесса отвечает лишь небольшая их часть. И если при удалении опухоли в организме останется данная особая клеточная популяция, то возобновления злокачественного процесса не избежать. Напротив, если уничтожить именно ее, то остальные клетки опухоли погибнут сами собой.