- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Синдром полиорганной дисфункции. Экстракорпоральные методы гемокоррекции презентация
Содержание
- 1. Синдром полиорганной дисфункции. Экстракорпоральные методы гемокоррекции
- 2. ПОН. Определение. Сегодня мы понимаем под
- 3. ПОН. Определение. Непосредственными факторами, определяющими выраженность
- 4. По этиологии ПОН подразделяют на два основных
- 5. В развитии синдрома ПОН выделяют три основных
- 6. Инициирующий фактор, запускающий выброс медиаторов системного воспаления,
- 7. В настоящее время известно уже около 200
- 8. Медиаторы ПОН Фактор, активирующий тромбоциты - усиливает агрегацию
- 9. Синдром системного воспалительного ответа Суммарные эффекты, оказываемые
- 10. Синдром системного воспалительного ответа Стадия 2. Выброс
- 11. Синдром системного воспалительного ответа Стадия 3. Генерализация
- 12. Синдром системного воспалительного ответа ССВО представляет собой
- 13. Прогностические признаки Выявлены так называемые "маркеры выживаемости"
- 14. Оценка тяжести СПОН и прогноза Для
- 15. Оценка тяжести СПОН и прогноза В
- 16. Оценка тяжести СПОН и прогноза В
- 17. Интенсивная терапия СПОН Одновременность и глубина поражения
- 18. Методы терапии ПОН должны обязательно включать
- 19. Методы терапии ПОН 6) антимедиаторную терапию,
- 20. Экстракорпоральные методы гемокоррекции В интенсивной терапии
- 21. Экстракорпоральные методы гемокоррекции Слепое упорство, в
- 22. Экстракорпоральные методы гемокоррекции Рациональность применения различных
- 23. Гемодиализ наиболее распространенный вид почечно- заместительной терапии,
- 24. Гемодиализ Для обеспечения проведения программного гемодиализа применяется
- 25. Гемодиализ
- 26. Гемодиализ Аппарат "искусственная почка" представляет собой сложное
- 27. Гемодиализ Гемодиализатор (диализатор) – массообменное устройство, в
- 28. Диффузия движение растворимых частиц сквозь полупроницаемую мембрану, основанное на градиенте концентрации
- 29. Ультрафильтрация движение жидкости сквозь полупроницаемую мембрану, основанное на градиенте гидростатического давления
- 30. Конвекция пассивное движение растворимых частиц сквозь полупроницаемую
- 31. Гемодиализ Обычные сеансы гемодиализа проводятся на полупроницаемых
- 32. Гемодиализ Диализирующий раствор – один из важнейших
- 33. Гемодиализ Проведение сеанса очищения крови методом гемодиализа
- 34. Гемодиализ Существуют временные и постоянные сосудистые доступы
- 35. Гемодиализ Средняя продолжительность сеанса гемодиализа составляет 4
- 36. Гемофильтрация / гемодиафильтрация Чем выше молекулярная масса
- 37. Гемофильтрация / гемодиафильтрация Эффективнее успешнее происходит их
- 38. Гемофильтрация / гемодиафильтрация При гемофильтрации диализирующий раствор
- 39. Гемофильтрация / гемодиафильтрация Данным методом хорошо удаляются
- 40. Гемофильтрация / гемодиафильтрация В конце 90-х гг.
- 41. Гемофильтрация / гемодиафильтрация Сегодня исследователи, занимающиеся проблемой
- 42. Гемосорбция (гемоперфузия) Гемосорбция – метод детоксикации, основанный
- 43. Основные показания для проведения гемосорбции: 1. острые отравления
- 44. Гемосорбция (гемоперфузия) Уже несколько десятилетий для удаления
- 45. Гемосорбция (гемоперфузия) В 2000 году один из
- 46. Гемосорбция (гемоперфузия) В 2003 году в отделении
- 47. Гемосорбция (гемоперфузия) В литературе имеются данные и
- 48. Плазмаферез, плазмофильтрация В последнее десятилетие метод плазмафереза
- 49. Плазмаферез, плазмофильтрация Его действие направлено на: 1.
- 50. Плазмаферез, плазмофильтрация На современном этапе ПФ и
- 51. Плазмаферез, плазмофильтрация Показания к проведению плазмафереза являются:
- 52. Плазмаферез, плазмофильтрация Существует 2 разновидности плазмафереза –
- 53. Плазмаферез, плазмофильтрация Применение мембранно-фильтрационных технологий плазмафереза основано
- 54. Плазмаферез, плазмофильтрация Для замещения выведенной плазмы желательно
- 55. Плазмаферез, плазмофильтрация К сожалению, метод не является
- 56. Экстракорпоральная поддержка печени Одной из наиболее новых
- 57. Экстракорпоральная поддержка печени Первый метод был назван
- 58. Экстракорпоральная поддержка печени Акцептором выступает донорский человеческий
- 59. Экстракорпоральная поддержка печени В отличие от гемодиализа,
- 60. Экстракорпоральная поддержка печени Принципиальным отличием методики Prometheus
- 61. Экстракорпоральная поддержка печени Сегодня существует еще одна
Слайд 2ПОН. Определение.
Сегодня мы понимаем под ПОН тяжелую неспецифическую стресс-реакцию организма,
Слайд 3ПОН. Определение.
Непосредственными факторами, определяющими выраженность полиорганной дисфункции, являются различная способность
По данным северо-американских исследователей, ПОН уже в течение 20 лет остается основной причиной смерти среди пациентов палат интенсивной терапии и реанимации хирургических стационаров и занимает около 75-80 % общей летальности.
Слайд 4По этиологии ПОН подразделяют на два основных вида:
ПОН, возникшая в связи
ятрогенная ПОН
Также можно говорить о вариантах посттравматической, постгеморрагической, cептической, панкреатогенной, постреанимационной ПОН. Однако почти 90% случаев ПОН имеют инфекционную природу, при этом уровень летальности колеблется от 35 до 75 % и более.
Слайд 5В развитии синдрома ПОН выделяют три основных фазы:
Индукционную фазу, результатом которой
Каскадную фазу, сопровождающуюся развитием острого легочного повреждения, активацией каскадов калликреин-кининовой системы, системы арахидоновой кислоты, свертывающей системы крови и других;
Фазу вторичной аутоагресии, предельно выраженной органной дисфункции и стабильного гипер-метаболизма, в которую организм больного теряет способность к самостоятельной регуляции гомеостаза.
Слайд 6Инициирующий фактор, запускающий выброс медиаторов системного воспаления, может быть самым разным
Перечисленные воздействия переводят полиморфноядерные нуклеары (нейтрофилы, базофилы, гранулоциты) и эндотелиоциты в состояние "кислородного взрыва", результатом данной трансформации является мощный хаотичный выброс этими клетками в кровоток огромного коли-чества субстанциий, обладающих разнонаправленными эффектами и являющимися медиаторами ПОН.
Слайд 7В настоящее время известно уже около 200 таких медиаторов. Основными из
Цитокины - низкомолекулярные белки, чья биологическая активность осуществляется через специфические рецепторы, расположенные на клеточных мембранах. Наиболее значимыми являются фактор некроза опухоли (TNF) и интерлейкины 1, 6, 10.
Эйкосаноиды - продукты распада арахидоновой кислоты. К ним относят тромбоксаны, лейкотриены, эпоксиды.
Оксид азота (NO) - эндотелий-расслабляющий фактор, вазодилататор.
Интерфероны - низкомолекулярные белки, активирующие эндотелий, способствуют выбросу других цитокинов, образованию факторов роста.
Слайд 8Медиаторы ПОН
Фактор, активирующий тромбоциты - усиливает агрегацию тромбоцитов и нейтрофилов.
Фибронектин - белок, существующий
Кислородные радикалы - повреждают эндотелиальную мембрану, клетки легочного интерстиция, участвуют в образовании хемотаксического липида, притягивающего лейкоциты.
Слайд 9Синдром системного воспалительного ответа
Суммарные эффекты, оказываемые медиаторами повреждения, формируют генерализованную системную
Выделяют три стадии развития ССВО:
Стадия 1. Локальная продукция цитокинов в ответ на травму или инфекцию. Цитокины способны выполнять ряд защитных функций, участвуя в процессах заживления ран и защиты клеток организма от патогенных микроорганизмов.
Слайд 10Синдром системного воспалительного ответа
Стадия 2. Выброс малого количества цитокинов в системный
Слайд 11Синдром системного воспалительного ответа
Стадия 3. Генерализация воспалительной реакции. В том случае,
Слайд 12Синдром системного воспалительного ответа
ССВО представляет собой симптомокомплекс характеризующий выраженность воспалительной реакции
Ряд исследований подтвердил, что основу патогенеза ПОН составляет именно диссеминированная воспалительная реакция, сопровождающаяся активацией и выбросом большого количества биологически активных соединений.
Синдром ПОН следует рассматривать как наиболее тяжелую степень ССВО-генерализованное воспаление вызывающее повреждение органной функции.
Слайд 13Прогностические признаки
Выявлены так называемые "маркеры выживаемости" пациентов с ПОН. Это уровни
Принципиально важным прогностическим признаком является своевременная оценка количества системных дисфункций. Так, при недостаточности по одной системе летальность составляет 25-40 %, по двум - 55-60 %, по трем - 75-98 %, а при развитии дисфункции четырех и более систем летальность приближается к 100 %.
Слайд 14Оценка тяжести СПОН и прогноза
Для выявления, оценки тяжести и прогноза
Наиболее часто используемыми шкалами у взрослых пациентов являются: APACHE (Acute Physiology And Chronic Health Evaluation) и её модификации MODS (Multiple Organ Dysfunction Score), SOFA (Sepsisrelated Organ Failure Assessment), SAPS (Simplified Acute Physiology Score) и её модификация, LODS (Logistic Organ Dysfunction system).
Слайд 15Оценка тяжести СПОН и прогноза
В результате многочисленных исследований эффективности оценки
Слайд 16Оценка тяжести СПОН и прогноза
В большинстве случаев в самом общем
Слайд 17Интенсивная терапия СПОН
Одновременность и глубина поражения определяет необходимость многокомпонснтности программы интенсивной
Первое по значимости и времени направление - устранение действия пускового фактора или заболевания, запустившего и поддерживающего агрессивное воздействие на организм больного (гнойная деструкция, тяжелая гиповолемия, легочная гипоксия, высокоинвазивная инфекция и т.д.). При неустраненном этиологическом факторе любое, самое интенсивное лечение ПОН, безрезультатно.
Второе направление - коррекция нарушений кислородного потока, включающая восстановление кислородтранспортной функции крови, терапию гиповолемии и гемоконцентрации, купирование расстройств гемореологии.
Третье направление - замещение, хотя бы временное, функции поврежденного органа или системы с помощью медикаментозных и экстракоропоральных методов.
Слайд 18Методы терапии ПОН
должны обязательно включать следующие мероприятия:
1) функциональную динамическую оценку
2) нормализацию кровообращения путем коррекции гиповолемии, инотропной поддержки;
3) респираторной поддержку;
4) ликвидацию инфекции путем проведения рациональной антибиотикотерапии и снижения инвазивности лечебных и диагностических процедур;
5) детоксикационную терапию с помощью стимуляции механизмов естественной детоксикации и использованием экстракорпоральных методик;
Слайд 19Методы терапии ПОН
6) антимедиаторную терапию, которая может включать применение препаратов,
7) метаболическая коррекция должна решать несколько задач:
коррекцию нарушений кислотно-щелочного и водно-электролитного обмена; подавление гиперметаболического ответа на системное повреждение.
Слайд 20Экстракорпоральные методы гемокоррекции
В интенсивной терапии различных критических ситуаций используются самые разнообразные
Слайд 21Экстракорпоральные методы гемокоррекции
Слепое упорство, в виде комбинированного использования различных режимов инфузионно-трансфузионной
Несостоятельность механизмов естественной детоксикации и выведения продуктов нарушенного метаболизма в условиях гипоксии не позволяет надеяться на вероятность благоприятного исхода только за счет восстановления кровообращения, вентиляции, стимуляции функции печени и почек и антибиотикотерапии. В результате эндотоксикоз замыкает всю систему «патологических кругов», отличающихся каскадным характером развития.
Слайд 22Экстракорпоральные методы гемокоррекции
Рациональность применения различных методик экстракорпоральной детоксикации (ЭКД) основывается на
Слайд 23 Гемодиализ
наиболее распространенный вид почечно- заместительной терапии, заключающийся в экстракорпоральном очищении крови
Показаниями к острому гемодиализу являются:
1. анурия или олигоанурия,
2. гиперкалиемия (свыше 6,5 ммоль/л).
Слайд 24 Гемодиализ
Для обеспечения проведения программного гемодиализа применяется комплекс аппаратуры, включающий системы очистки
Системы очистки водопроводной воды состоят из двух главных блоков – блок предварительной очистки и блок обратного осмоса для окончательной обработки воды.
Аппараты приготовления концентрата диализирующего раствора представляют собой емкости различного объема, в которых производится смешивание химически чистой воды (из системы водоочистки) и навесок солей в заданных пропорции и объеме.
Слайд 26 Гемодиализ
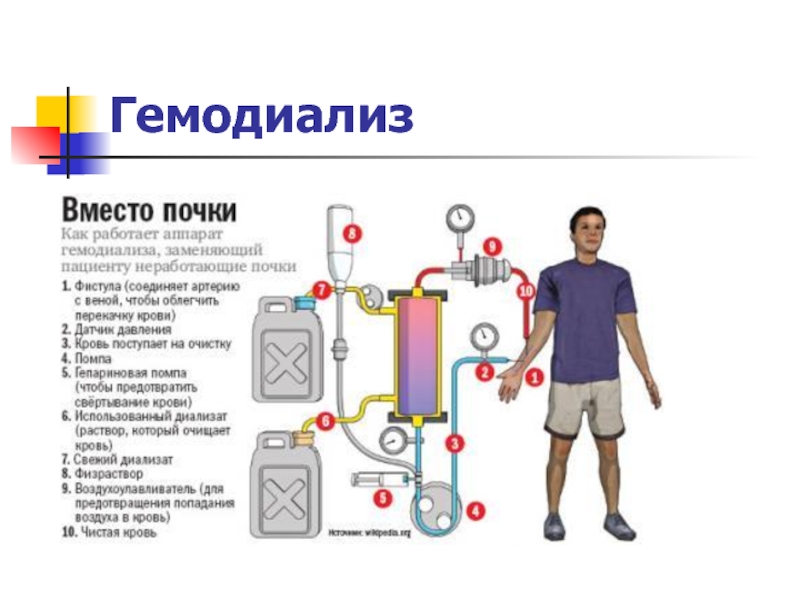
Аппарат "искусственная почка" представляет собой сложное инженерное устройство, состоящее из блока
Все расходные материалы для гемодиализа выпускаются промышленным способом и относятся к одноразовым компонентам, подлежащим утилизации после сеанса.
Слайд 27 Гемодиализ
Гемодиализатор (диализатор) – массообменное устройство, в котором происходит непосредственный процесс очищения
Диализ основан на массопереносе сквозь полупроницаемую мембрану. Мембрана гемодиализатора разделяет кровь пациента от диализируюшей жидкости (диализата). При поступлении крови и диализата в мембрану происходят процессы:
диффузии, конвекции и ультрафильтрации.
Слайд 28Диффузия
движение растворимых частиц сквозь полупроницаемую мембрану, основанное на градиенте концентрации
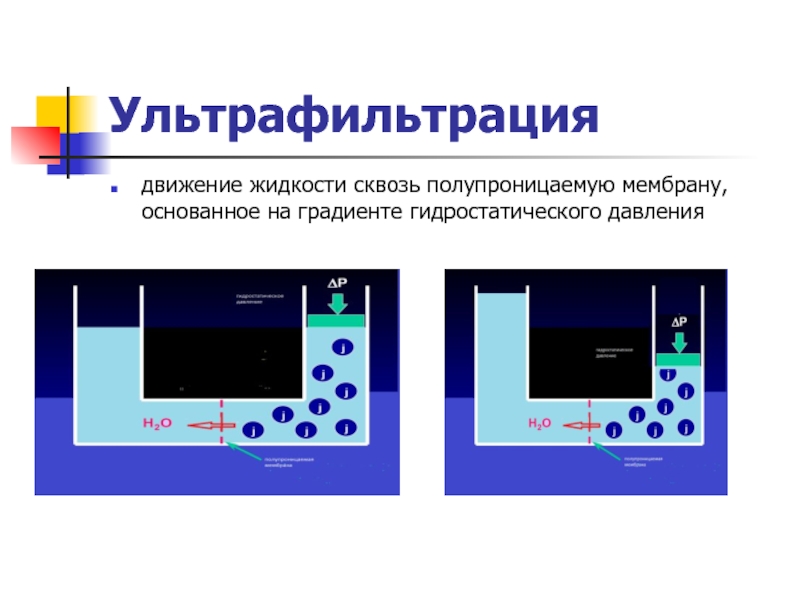
Слайд 29Ультрафильтрация
движение жидкости сквозь полупроницаемую мембрану, основанное на градиенте гидростатического давления
Слайд 30Конвекция
пассивное движение растворимых частиц сквозь полупроницаемую мембрану вместе с жидкостью. Конвекция
Слайд 31 Гемодиализ
Обычные сеансы гемодиализа проводятся на полупроницаемых мембранах с относительно низким коэффициентом
Помимо диализаторов используются и кровопроводящие магистрали – пластиковые трубчатые линии, по которым кровь из организма больного направляется в диализатор, где происходит ее очищение, и возвращается обратно в русло кровообращения.
Слайд 32 Гемодиализ
Диализирующий раствор – один из важнейших компонентов программного гемодиализа, при помощи
Слайд 33 Гемодиализ
Проведение сеанса очищения крови методом гемодиализа требует наличия доступа к системе
Чем больше крови пройдет очищение в диализаторе, тем эффективнее гемодиализ.
Слайд 34 Гемодиализ
Существуют временные и постоянные сосудистые доступы для обеспечения программного гемодиализа. Основным
Существуют и так называемые перманентные катетеры для длительной диализотерапии.
Артерио-венозные фистулы для программного гемодиализа – основной вид сосудистого доступа для подключения аппаратов "искусственная почка". Принцип, заложенный в основу функционирования артерио-венозных соустий сосудов на конечностях, состоит в создании постоянного сброса крови из артерии в вену, что препятствует тромбообразованию и дает возможность регулярного и высокообъемного получения крови для очищения в аппарате "искусственная почка".
Слайд 35 Гемодиализ
Средняя продолжительность сеанса гемодиализа составляет 4 часа. В основном, процедуры «острого»
Сеанс гемодиализа представляет собой сложную процедуру очищения крови вне организма, которая может сопровождаться рядом осложнений, наиболее частыми из которых являются артериальная гипотензия (20–30%), артериальная гипертензия (10–15%), судороги (5–20%), тошнота и рвота (5–15%), головная боль (5–8%), боли за грудиной (2–5%), кожный зуд (3–5%), лихорадка и озноб (1%).
Поэтому его проведение должно осуществляться специально подготовленным медицинским персоналом.
Слайд 36 Гемофильтрация / гемодиафильтрация
Чем выше молекулярная масса уремических токсинов, тем хуже они
Накопление этих токсинов со временем вызывает у пациентов, получающих обычный программный гемодиализ, ряд специфических осложнений, в конечном итоге снижающих выживаемость.
Слайд 37 Гемофильтрация / гемодиафильтрация
Эффективнее успешнее происходит их выведение путем конвекции через высокопроницаемую
На данном принципе основаны конвекционные методы вне почечного очищения крови – гемофильтрация и гемодиафильтрация.
Слайд 38 Гемофильтрация / гемодиафильтрация
При гемофильтрации диализирующий раствор не используется. В гемофильтре под
Замещающий раствор (субститут) вводится из специальных пластиковых емкостей или непосредственно из блоков аппарата в артериальную магистраль кровопроводящего контура (предилюция), либо в венозную (постдилюция) магистраль.
Разница между объемом фильтрата и объемом замещения определяется, исходя из наличия избыточной жидкости у пациента (цель ультрафильтрации).
Слайд 39 Гемофильтрация / гемодиафильтрация
Данным методом хорошо удаляются среднемолекулярные токсины, но низкомолекулярные хуже,
Устройство является технически более сложным, но эффективность лечения повышается значительно. В обоих случаях требуется большое количество стерильного замещающего раствора, что существенно удорожает процедуру.
Слайд 40 Гемофильтрация / гемодиафильтрация
В конце 90-х гг. в мире завоевали популярность методы
Слайд 41 Гемофильтрация / гемодиафильтрация
Сегодня исследователи, занимающиеся проблемой выбора метода гемодиализа во всем
Слайд 42Гемосорбция (гемоперфузия)
Гемосорбция – метод детоксикации, основанный на выведении из крови больного
Технически метрод гемосорбции гораздо проще, в сравнении с гемодиализом или гемодиафильтрацией, и для своего осуществления требует лишь роликовый насос, стерильную разовую систему для гемосорбции и тот или иной гемосорбент и антикоагулянт (гепарин или низкомолекуляр-ный гепарин (Фраксипарин, Клексан).
Слайд 43Основные показания для проведения гемосорбции:
1. острые отравления снотворными медикаментами, хлор- и фосфорорганическими
2. тяжелые эндотоксикозы хирургического и терапевтического генеза (сепсис);
3. абстинентный синдром при наркомании и алкоголизме;
4. острая или хроническая печеночная недостаточность любой этиологии;
5. тяжелые генерализованные формы инфекционных заболеваний (брюшной тиф, вирусный гепатит, дифтерия и др.).
Слайд 44Гемосорбция (гемоперфузия)
Уже несколько десятилетий для удаления различных токсинов и ядов из
Учитывая отрицательные свойства данных сорбентов (микроэмболизация сосудов частичками углей, разрушение эритроцитов, увеличение воспалительной реакции организма и др.), в последнее десятилетие и у этого метода наступил ренессанс и многие клиницисты возвратились или начали применять самые различные, уже новые, селективные сорбенты.
Слайд 45Гемосорбция (гемоперфузия)
В 2000 году один из лидеров интенсивной терапии в Европе
Первые публикации по клиническому применению сорбента на основе Полимиксина В появились в 1994 году. Японские ученые Aoki H. и Kodama M. указали на эффективность этого сорбента в лечении сепсиса с полиорганной недостаточностью. Белорусскими исследователями доказана эффективность отечественного селективного гемосорбента «Овосорб» в лечении тяжелых панкреатитов и перитонитов в результате адсорбции из крови протеаз, выброс в кровь которых повышается в сотни раз при указанных патологических процессах.
Слайд 46Гемосорбция (гемоперфузия)
В 2003 году в отделении очищения крови одного из медицинских
При этом отмечается улучшение гемодинамических параметров, общего состояния пациентов и снижение воспаления, а также улучшение тканевой оксигенации у исследуемых пациентов.
Слайд 47Гемосорбция (гемоперфузия)
В литературе имеются данные и об эффективности плазмосорбции и лимфосорбции,
Таким образом, абсолютно ясно, что использование гемоперфузии для лечения многих патологических процессов в организме оправдано в случае применения селективных сорбентов.
Угольные гемосорбенты и ионообменные смолы из-за своих неизбирательных свойств относительно токсинов, а также возможных осложнений применяются намного реже.
Слайд 48Плазмаферез, плазмофильтрация
В последнее десятилетие метод плазмафереза (ПФ) (или плазмообмена) нашел широкое
Слайд 49Плазмаферез, плазмофильтрация
Его действие направлено на:
1. быстрое удаление содержащихся в крови токсичных
2. быстрое уменьшение содержащихся в крови патологических факторов или клеток как первичная терапия основного заболевания;
3. удаление остаточных факторов в случаях, когда заболевание контролируется или прогрессирование его остановлено, но остается риск развития осложнений из-за циркулирующих в крови патологических субстанций.
Слайд 50Плазмаферез, плазмофильтрация
На современном этапе ПФ и плазмофильтрация стали одними из ведущих
Слайд 51Плазмаферез, плазмофильтрация
Показания к проведению плазмафереза являются: сепсис (перитониты, эндометриты, пневмонии и
К противопоказаниям относят гипопротеинемию (о. белок менее 55 г/л), выраженные анемии, продолжающиеся кровотечения.
Слайд 52Плазмаферез, плазмофильтрация
Существует 2 разновидности плазмафереза – центрифужный и мембранный (плазмафильтрация).
При
Последние реинфузируются обратно в организм пациента. Забранная от больного плазма удаляется.
Слайд 53Плазмаферез, плазмофильтрация
Применение мембранно-фильтрационных технологий плазмафереза основано на использовании специальных плазмафильтров, через
Слайд 54Плазмаферез, плазмофильтрация
Для замещения выведенной плазмы желательно использовать сбалансированные электролиты, растворы глюкозы,
Темп и объем инфузии этих препаратов определяется в каждом конкретном случае индивидуально и зависит как от исходного состояния водно- электролитного и белкового обмена, так и от методических особенностей плазмафереза.
Слайд 55Плазмаферез, плазмофильтрация
К сожалению, метод не является селективным и не позволяет удалять
На сегодняшний день помимо традиционного плазмафереза используется и цитаферез – метод экстракорпоральной гемокоррекции, основанный на выведении определенных клеточных компонентов крови больного и замене их компонентами, препаратами крови и (или) кровезаменителями.
Слайд 56Экстракорпоральная поддержка печени
Одной из наиболее новых методик экстракорпорального очищения крови стала
Причем, в клинических центрах мира используют 2 ее разновидности – систему MARS (Teraclin-Gambro, Германия) и Prometheus (Fresenius, Германия).
Слайд 57Экстракорпоральная поддержка печени
Первый метод был назван описательным термином «Система возвратной молекулярной
В ходе процедуры удается достигнуть выведения токсинов, связанных альбумином, параллельно с удалением водорастворимых токсинов. Ключевым моментом технологии MARS является перенос через высокопроницаемую диализную мембрану токсинов, имеющих сродство с альбумином из крови на акцептор.
Слайд 58Экстракорпоральная поддержка печени
Акцептором выступает донорский человеческий альбумин, циркулирующий в замкнутом контуре.
Для быстрого восстановления акцепторной способности раствор донорского человеческого альбумина, проходя по замкнутому контуру, подвергается гемодиализу, карбоперфузии и перфузии через ионообменную смолу.
Таким образом, альбуминовый контур циркуляции состоит из следующих компонентов: высокопроницаемый модифицированный диализатор с полиамидной мембраной, патрон с активированным углем, патрон с ионообменной смолой, низкопроницаемый диализатор с полисульфоновой мембраной.
Слайд 59Экстракорпоральная поддержка печени
В отличие от гемодиализа, который имеет только два контура
Через промежуточный альбуминовый контур и происходит опосредованное, т. е. вне прямого контакта с кровью, выведение как водорастворимых, так и белково-связанных токсинов.
Высокая стоимость одной процедуры MARS – терапии (до 5000$) ограничивает широкое использование методики.
Слайд 60Экстракорпоральная поддержка печени
Принципиальным отличием методики Prometheus является отсутствие в контуре циркуляции
Вследствие этого «очищенный» альбумин больного вновь идет в контур циркуляции для извлечения патологических токсинов из крови. Такая техническая особенность удешевляет стоимость процедуры до 2500$.
Слайд 61Экстракорпоральная поддержка печени
Сегодня существует еще одна процедура экстракорпоральной поддержки печени, которая
Это – ELAD- терапия, суть которой заключается в пропускании крови больного человека через картридж с живыми гепатоцитами, выращенными генно-инженерным путем.