- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Радиационное поражение живой клетки презентация
Содержание
- 1. Радиационное поражение живой клетки
- 2. Стадии лучевого поражения клетки Физическая (неспецифическая) (10-16-10-14
- 3. Стадии лучевого поражения клетки Физико-химическая (10-13-10-10 с)
- 4. Стадии лучевого поражения клетки Химическая (10-7-10-6 с)
- 5. Стадии лучевого поражения клетки Биологическая – функциональные
- 6. Биологическая стадия (продолжение) Структурные повреждения нуклеиновых кислот
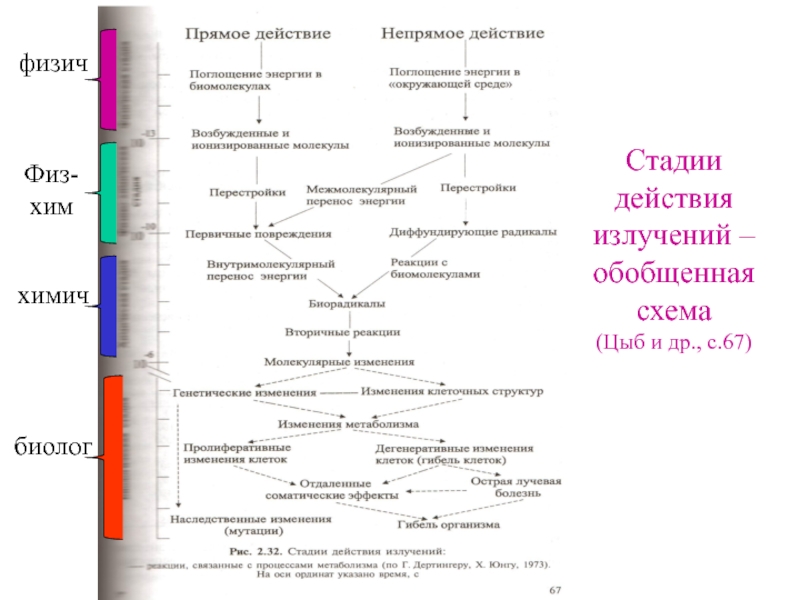
- 7. Стадии действия излучений – обобщенная схема (Цыб
- 8. Изменение радиочувствительности на разных стациях клеточного цикла
- 9. Радиочувствительность клеток на разных стадиях клеточного цикла
- 10. Радиационные эффекты, регистрируемые на уровне клетки
- 11. Радиационная задержка клеточного деления впервые количественно исследована
- 12. Длительность задержки клеточного цикла Длительность задержки деления
- 13. Судьба потомков облученной клетки Клетка облучена в
- 14. Образование гигантских клеток Размеры могут в сотни
- 15. Утеря клоногенного потенциала (Clonogenic survival assay) основной
- 16. Влияние 241Am на жизнеспособность клеток E.coli работа
- 17. Токсическое влияние 241Am, на стационарную культуру клеток
- 18. Утеря клоногенного потенциала II. Оценка выживаемости
- 19. Длительное сохранение повышенной гибели потомков (снижение клоногенной
- 20. SOS-хромотест - метод анализа активности генотоксинов основан
- 21. SOS-хромотест - метод анализа активности генотоксинов Анализ
- 22. Оценка генотоксичности 241Am в SOS-хромотесте Зарегистрирована
- 23. Клеточные изменения при апоптозе и некрозе Стадии
- 24. Радиационная гибель клеток Апоптоз – (энергозависимый механизм)
- 25. Радиационная гибель клеток – Некроз –
- 26. Причины радиационной гибели клеток В результате
- 27. Интерфазная и митотическая гибель клеток
- 28. Интерфазная гибель клеток = Гибель неделящихся (нервные,
- 29. Митотическая (репродуктивная) гибель клеток = в
- 30. Последствия радиационных повреждений ДНК: Эффекты, наблюдаемые в
- 31. Фрагментация хромосом - Образование микроядер фрагменты
- 32. Хромосомные аберрации (Отражают число разрывов ДНК и
- 33. Аберрации хромосом Аберрации хромосом возникают, когда клетка
- 34. Аберрации хроматид Аберрации хроматид возникают, когда клетка
- 35. Нарушение геометрии хромосом метафазная пластинка облученных лимфоцитов
- 36. Транслокации Некоторые заболевания – следствия транслокаций: Рак
- 37. Изучение транслокаций: методы дифференцированной окраски участков хромосом,
- 38. Стабильность аберраций Нестабильные аберрации – ацентрические фрагменты
- 39. Аберрации коррелируют с поглощенной дозой и используются
- 40. Радиационно-индуцированная нестабильность генома Часть клеток, выживших после
- 41. Нестабильность генома: Сохранение НГ на протяжении десятков
- 42. Механизм индукции и поддержания генетической нестабильности мало
- 43. Примеры: эксперименты по облучению цитоплазмы и
- 44. Результаты экспериментов и выводы Облучение цитоплазмы
- 45. «Генетическая нестабильность обусловлена длительно сохраняющимся изменением функционирования
- 46. Следующая тема: радиационные эффекты в области малых доз излучения Задание на дом: Контрольная работа
Слайд 2Стадии лучевого поражения клетки
Физическая (неспецифическая) (10-16-10-14 с) – поглощение, перераспределение и
Радиационный выход активных частиц (G)
G=7-10 частиц / 100 эВ
На данной стадии процессы нельзя модифицировать, т.к. они зависят только от свойств излучения (ЛПЭ), а не от состояния клетки.
Слайд 3Стадии лучевого поражения клетки
Физико-химическая (10-13-10-10 с) – реакции заряженных и возбужденных
Первичные радикалы быстро претерпевают вторичные превращения: образуются органические гидропероксиды и оксирадикалы органических молекул (например, ДНК и липидов мембран), которые взаимодействуют друг с другом.
! Возможна модификация процессов с помощью химических соединений, способных вступать в реакции со свободными радикалами и изменять характер миграции энергии.
(SH-группы, О2, др. химические модификаторы радиочувствительности – см. тему 3)
Слайд 4Стадии лучевого поражения клетки
Химическая (10-7-10-6 с) – к этому времени уже
Происходит выравнивание продуктов радиолиза по объему.
Биологические мембраны: Интенсификация свободнорадикального перекисного окисления полиненасыщенных жирных кислот и накопление продуктов окисления мембран ? нарушение структуры и функции мембран
Макромолекулы белка: повреждение аминокислот ? нарушение первичной структуры ? изменение вторичной структуры ? нарушение конформации ? деградация активного центра ферментов (утрата каталитических свойств, субстратной специфичности, чувствительности к активаторам и ингибиторам)
ДНК: одно- и двунитиевые разрывы полинуклеотидных цепей, разрушение азотистых оснований ? возникновение сшивок ДНК-ДНК, ДНК-белок
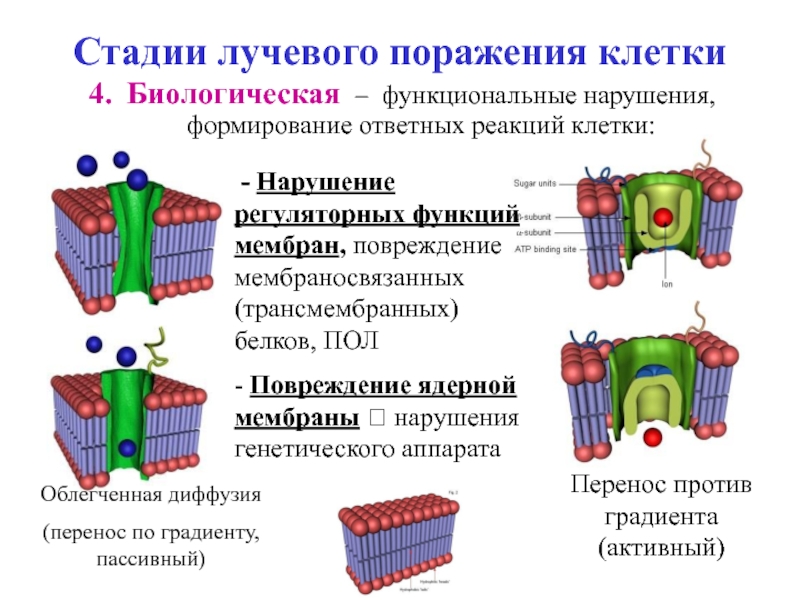
Слайд 5Стадии лучевого поражения клетки
Биологическая – функциональные нарушения, формирование ответных реакций клетки:
Перенос
Облегченная диффузия
(перенос по градиенту, пассивный)
- Нарушение регуляторных функций мембран, повреждение мембраносвязанных (трансмембранных) белков, ПОЛ
- Повреждение ядерной мембраны ? нарушения генетического аппарата
Слайд 6Биологическая стадия (продолжение)
Структурные повреждения нуклеиновых кислот приводят к нарушению процессов репликации,
Активируются защитные механизмы клеток
Стадия длится от секунд до всего периода жизни клетки (!)
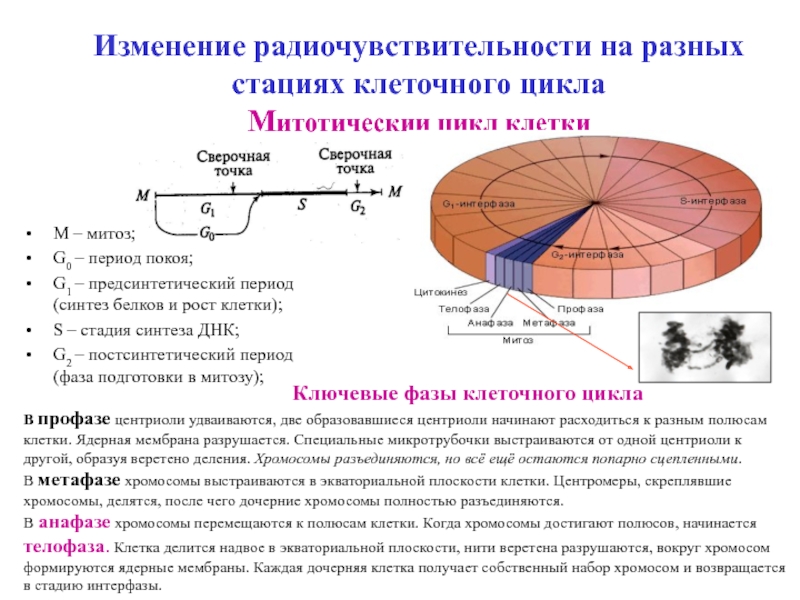
Слайд 8Изменение радиочувствительности на разных стациях клеточного цикла
Митотичеcкии цикл клетки
М
G0 – период покоя;
G1 – предсинтетический период (синтез белков и рост клетки);
S – стадия синтеза ДНК;
G2 – постсинтетический период (фаза подготовки в митозу);
Ключевые фазы клеточного цикла
В профазе центриоли удваиваются, две образовавшиеся центриоли начинают расходиться к разным полюсам клетки. Ядерная мембрана разрушается. Специальные микротрубочки выстраиваются от одной центриоли к другой, образуя веретено деления. Хромосомы разъединяются, но всё ещё остаются попарно сцепленными.
В метафазе хромосомы выстраиваются в экваториальной плоскости клетки. Центромеры, скреплявшие хромосомы, делятся, после чего дочерние хромосомы полностью разъединяются.
В анафазе хромосомы перемещаются к полюсам клетки. Когда хромосомы достигают полюсов, начинается телофаза. Клетка делится надвое в экваториальной плоскости, нити веретена разрушаются, вокруг хромосом формируются ядерные мембраны. Каждая дочерняя клетка получает собственный набор хромосом и возвращается в стадию интерфазы.
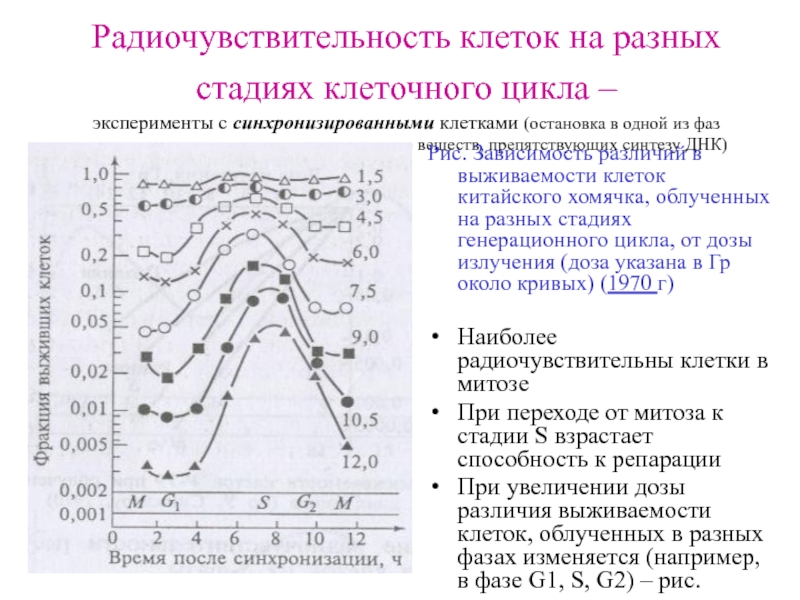
Слайд 9Радиочувствительность клеток на разных стадиях клеточного цикла – эксперименты с синхронизированными
Рис. Зависимость различий в выживаемости клеток китайского хомячка, облученных на разных стадиях генерационного цикла, от дозы излучения (доза указана в Гр около кривых) (1970 г)
Наиболее радиочувствительны клетки в митозе
При переходе от митоза к стадии S взрастает способность к репарации
При увеличении дозы различия выживаемости клеток, облученных в разных фазах изменяется (например, в фазе G1, S, G2) – рис.
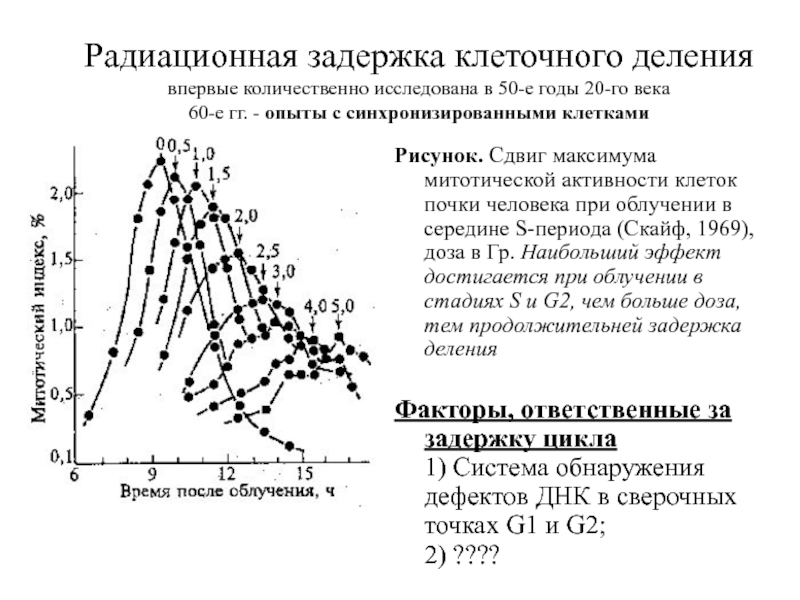
Слайд 11Радиационная задержка клеточного деления впервые количественно исследована в 50-е годы 20-го века 60-е
Рисунок. Сдвиг максимума митотической активности клеток почки человека при облучении в середине S-периода (Скайф, 1969), доза в Гр. Наибольший эффект достигается при облучении в стадиях S и G2, чем больше доза, тем продолжительней задержка деления
Факторы, ответственные за задержку цикла
1) Система обнаружения дефектов ДНК в сверочных точках G1 и G2;
2) ????
Слайд 12Длительность задержки клеточного цикла
Длительность задержки деления зависит от того, в какой
величина задержки индивидуальна для разных клеток (примеры см. на стр.78-79. Ярмоненко, Вайнсон, 2004)
*вещество хромосом - ДНК
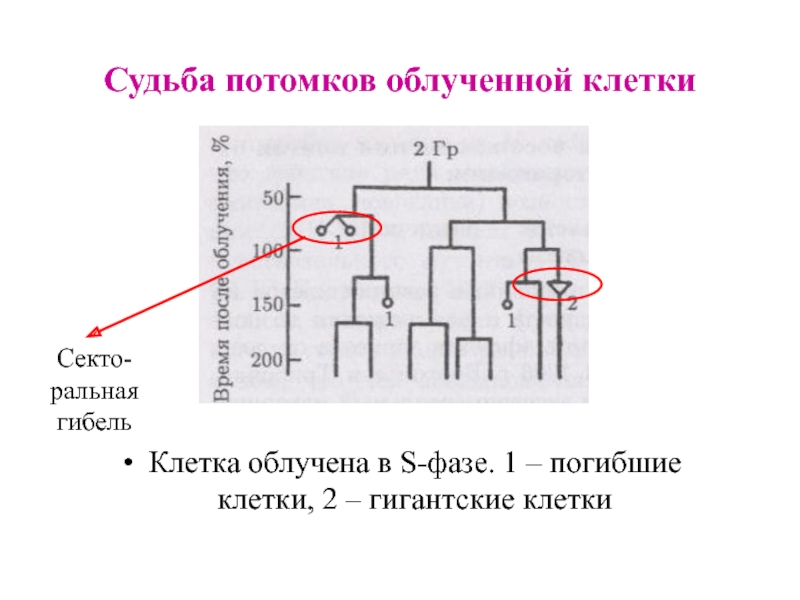
Слайд 13Судьба потомков облученной клетки
Клетка облучена в S-фазе. 1 – погибшие клетки,
Секто-ральная гибель
Слайд 14Образование гигантских клеток
Размеры могут в сотни раз превосходить нормальные (min в
В нормальных условиях число гигантских клеток не превышает 1-2% от общего числа
Пути образования гигантских клеток:
Увеличение массы неделящейся клетки в результате деления ядер без деления самой клетки (клетки не могут разделиться);
Ускоренное репликативное старение – клетки необратимо останавливаются в интерфазе, увеличиваются в размерах, накапливают характерные белки. В итоге активируется самодеструкция в виде апоптоза и некроза.
Слияние потомков только что разделившейся клетки (2, 3 и более)
Итог: Клетки погибают из-за нарушения метаболизма
Слайд 15Утеря клоногенного потенциала (Clonogenic survival assay) основной способ оценки выживаемости клеток Синонимы: клоногенная активность,
I. Метод оценки выживаемости клеток In vitro: («золотой стандарт» ), 1956 г.: отделение клеток от стенок сосуда, разбивание суспензии на одиночные клетки, посев на чашку, подсчет колоний. Облучать клетки можно на разных этапах в зависимости от задачи.
оценивается доля выживших клеток в % к числу посеянных колоний: клетка считается выжившей, если она образует колонию из > 50 клеток.
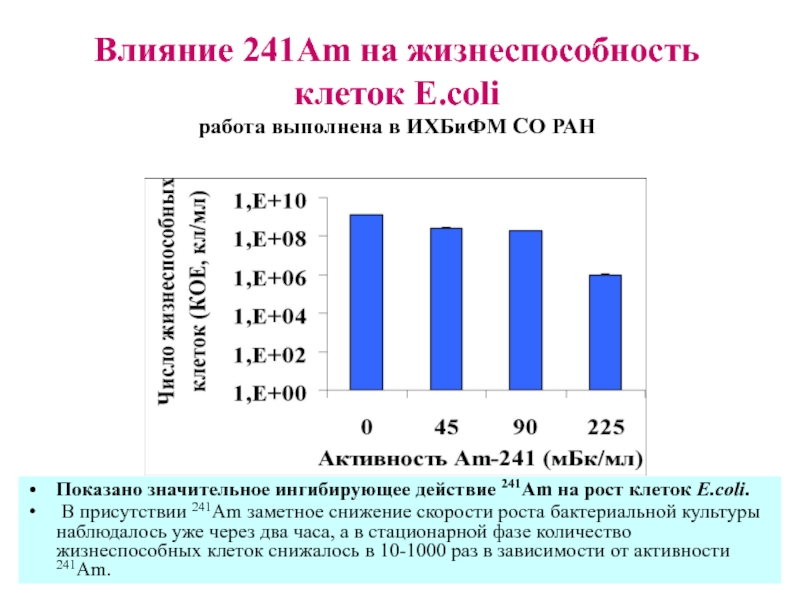
Слайд 16Влияние 241Am на жизнеспособность клеток E.coli
работа выполнена в ИХБиФМ СО РАН
Показано
В присутствии 241Am заметное снижение скорости роста бактериальной культуры наблюдалось уже через два часа, а в стационарной фазе количество жизнеспособных клеток снижалось в 10-1000 раз в зависимости от активности 241Am.
Слайд 17Токсическое влияние 241Am, на стационарную культуру клеток S. typhimurium ТА102.
Показано повышение
В течение 3 суток происходит гибель более 90% клеток, тогда как в чистой воде гибель клеток не наблюдалась.
Слайд 18Утеря клоногенного потенциала
II. Оценка выживаемости клеток In vivo - Модификации
– выращивание стволовых клеток (лимфом и лейкемии) на селезенке, утратившей собственную клеточную популяцию в результате облучения (стр.89 Ярмоненко, Вайнсон, 2004); Клетки берут от облученных в разных дозах животных.
Выращивание колоний в легких (для опухолей нелимфоидного происхождения), (Цыб и др., 2005, стр. 163-167)
выращивание колоний на капсуле почки, камере глаза, жировой подушке стопы (для опухолевых клеток, клеток медленно обновляющихся тканей) (см. Цыб и др., 2005, стр. 163-167)
В настоящее время разработаны методы оценки выживания клоногенных клеток кожи и тонкого кишечника, хряща, молочной железы и др.
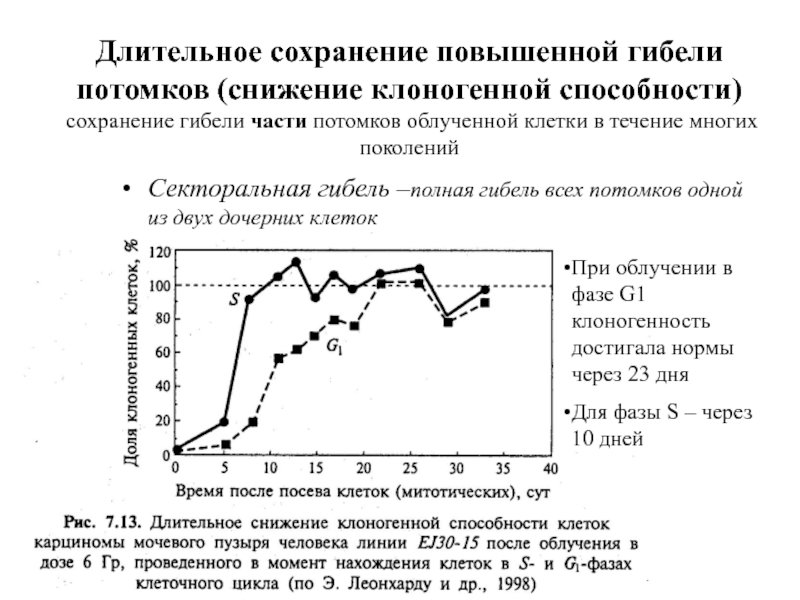
Слайд 19Длительное сохранение повышенной гибели потомков (снижение клоногенной способности) сохранение гибели части
Секторальная гибель –полная гибель всех потомков одной из двух дочерних клеток
При облучении в фазе G1 клоногенность достигала нормы через 23 дня
Для фазы S – через 10 дней
Слайд 20SOS-хромотест - метод анализа активности генотоксинов
основан на индукции SOS ответа в
SOS ответ включает ряд функций, которые индуцируются в ответ на повреждение ДНК или остановку ее синтеза.
SOS-хромотест позволяет измерять способность различных веществ индуцировать экспрессию din-генов (генов, индуцибельных в ответ на повреждения ДНК) в E.coli по активности β-галактозидазы, структурный ген которой, lacZ, поставлен под контроль промотора какого-либо din- гена.
В штамме E.coli PQ37, используемом в SOS хромотесте, структурный ген β-галактозидазы lacZ введен под контроль промотора din-индуцибельного гена sfiA, так что β-галактозидазная активность сильно зависит от экспрессии гена sfiA и индуцируется при действии на клетки бактерий генотоксинов.
Мутация в uvrA гене делает штамм дефицитным по эксцизионной репарации и поэтому увеличивает ответ к некоторым ДНК-повреждающим агентам. Мутация rfa позволяет улучшить диффузию некоторых химических веществ в клетку.
Слайд 21SOS-хромотест - метод анализа активности генотоксинов
Анализ состоит в инкубации индикаторного штамма
Спустя некоторый промежуток времени, необходимый для синтеза белка, определяют активность β-галактозидазы.
Тест выполняется отдельно в присутствии и в отсутствие микросомальной активирующей смеси.
Тестируемые химические соединения могут при некоторых концентрациях ингибировать синтез белка, что, возможно, приведет к недоопределению индукции β-галактозидазы. В экстремальных случаях это может дать неправильный отрицательный результат. Чтобы скорректировать это влияние тестируемых препаратов, определяют общий синтез белка в инкубационный период, анализируя параллельно с β-галактозидазой активность щелочной фосфатазы, конститутивно экспрессируемого фермента.
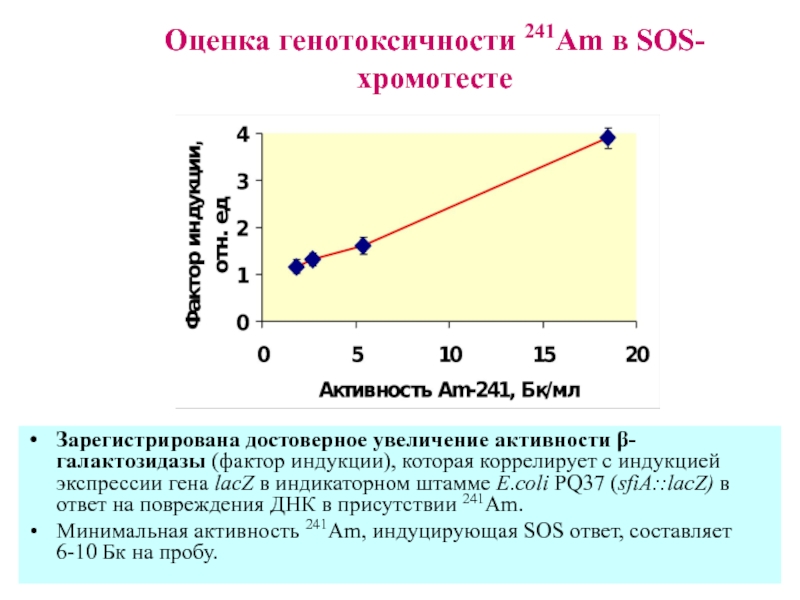
Слайд 22Оценка генотоксичности 241Am в SOS-хромотесте
Зарегистрирована достоверное увеличение активности β-галактозидазы (фактор индукции),
Минимальная активность 241Am, индуцирующая SOS ответ, составляет 6-10 Бк на пробу.
Слайд 23Клеточные изменения при апоптозе и некрозе
Стадии апоптоза:
http://www.biochemistry.ru/apoptos/apoptosis.html:
2) На ранних стадиях
3) Далее апоптотическая клетка превращается в совокупность окруженных мембраной апоптозных телец различных по своему составу,
4) Апоптозные тельца фагоцитируются макрофагами или соседними клетками in vivo.
Стадии некроза:
5) клетки набухают, их митохондрии и другие органеллы расширяются (вследствие нарушения работы ионных каналов),
6) разрываются внутриклеточные и плазматическая мембраны клетки - выход цитоплазмы во внеклеточное пространство – воспалительная реакция ткани.
Апоптозоподобная ПГК (или аутофагия) – в отличие от апоптоза нет межнуклеосомальной деградации ДНК
Слайд 24Радиационная гибель клеток
Апоптоз – (энергозависимый механизм) программируемая гибель клеток (ПГК). Годом
Радиационный апоптоз характерен как для клеток быстроделящихся тканей (эпителиальных, костный мозг), так и для покоящихся (лимфоциты периферической крови) обнаружение специальными белками нарушений ДНК или мембран митохондрий инициирует апоптоз.
Гибель по апоптотическому пути может происходить при повреждениях ДНК, не являющихся препятствием к жизнедеятельности клетки
Апоптоз включается при дозах, не достигающих летальных значений
Биологический смысл апоптоза – недопущение размножения клеток с ошибками в генетическом аппарате.
Во взрослом организме апоптоз распространен в различных типах тканей. Он встречается как в медленно пролиферирующей популяции клеток (гепатоциты, клетки эпителия коры надпочечников), так и в быстро пролиферирующих клеточных популяциях. В первом случае он выполняет функцию гомеостатической регуляции оптимального объема ткани. Во втором случае роль апоптоза, в основном, связана с дифференцировкой клеток.
Слайд 25Радиационная гибель клеток –
Некроз – «клеточная катастрофа» или вид ПГК
Некроз реализуется при уровне поражений, несовместимых с жизнедеятельностью клетки. (причины: гипертермия, ингибирование окислительного фосфорилирования, гликолиза или цикла Кребса, гипоксия, действие различных токсинов)
Радиационный некроз индуцируется большими дозами облучения (> 20Гр). Некротическим путем клетки обычно разрушаются при остановке в митозе.
В норме встречается крайне редко, хотя обнаружен в нервной ткани и в эпителии кишечника.
Слайд 26Причины радиационной гибели клеток
В результате лучевого поражения клетки гибнут как
-Гибель в первые часы после облучения обусловлена работой сигнальной системы включения ПГК в отчет на неотрепарированные двойные разрывы ДНК
-Более поздняя гибель связана с обнаружением нарушений строения хромосом в периоде G2;
-Гибель в митозе обусловлена хромосомными аберрациями
Слайд 28Интерфазная гибель клеток = Гибель неделящихся (нервные, мышечные) или медленно делящихся
изменения, предшествующие гибели клеток:
Физиологические:
Нарушение ядерного фосфорилирования
Угнетение клеточного дыхания
Изменяется проницаемость мембран (тесты с исп. красителей, выход К+) и др.
Морфологические:
Набухание ядер
Вакуолизация и распад ядрышек
Гибель клеток происходит в первые часы или сутки после облучения
В зависимости от дозы и др. факторов, модифицирующих радиочувствительность
Слайд 29Митотическая (репродуктивная) гибель клеток
= в основном, быстроделящихся
Гибель в митозе
Поврежденные хромосомы (генетический материал) не могут равномерно разделиться между дочерними клетками
Двойной мост в анафазе митоза
у элодеи канадской
Неравномерное расхождение хромосом
в анафазе митоза водяного лютика
Отстающие хромосомы в
анафазе митоза водяного лютика
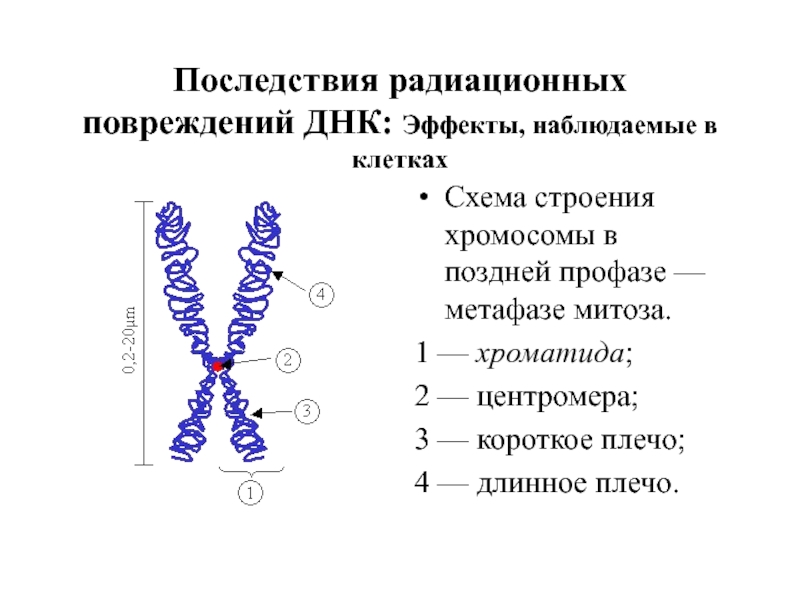
Слайд 30Последствия радиационных повреждений ДНК: Эффекты, наблюдаемые в клетках
Схема строения хромосомы в
1 — хроматида;
2 — центромера;
3 — короткое плечо;
4 — длинное плечо.
Слайд 31Фрагментация хромосом - Образование микроядер
фрагменты хромосом образуются в результате разрывов ДНК,
В
микроядра в метафазе остаются в центре клетки,
распределяются между дочерними клетками случайным образом);
Передаются дочерним клеткам нескольких поколений
Число микроядер коррелирует с полученной дозой излучения
Проблемы интерпретации !!!!!!!!!!!!!!!!!!!!!!!!!! (увеличение выхода микроядер у пожилых людей, причины?)
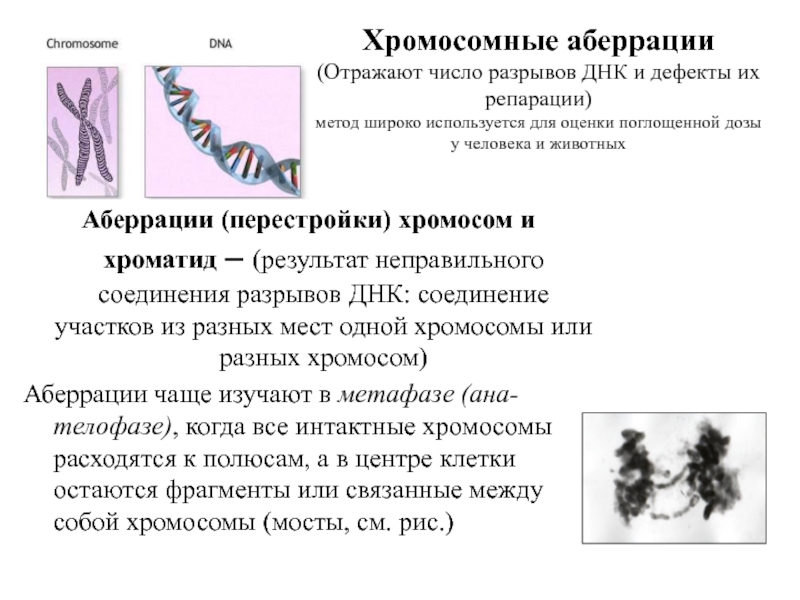
Слайд 32Хромосомные аберрации (Отражают число разрывов ДНК и дефекты их репарации) метод широко используется
Аберрации (перестройки) хромосом и хроматид – (результат неправильного соединения разрывов ДНК: соединение участков из разных мест одной хромосомы или разных хромосом)
Аберрации чаще изучают в метафазе (ана-телофазе), когда все интактные хромосомы расходятся к полюсам, а в центре клетки остаются фрагменты или связанные между собой хромосомы (мосты, см. рис.)
Слайд 33Аберрации хромосом
Аберрации хромосом возникают, когда клетка облучена в предсинтетической стадии или
Виды хромосомных аберраций:
обмен фрагментами между хромосомами – реципрокные (взаимные) транслокации,
нарушения геометрии хромосом (дицентрики, ацентрические фрагменты – образуются при неверном воссоединении оторванных фрагментов ДНК).
Слайд 34Аберрации хроматид
Аберрации хроматид возникают, когда клетка облучена после завершения репликации всей
Виды хроматидных аберраций:
Ацентрические фрагменты, укороченные хроматиды (результат разрыва)
кольцевые хромосомы (результат слипания концов хроматид)
внутрихромосомные обмены
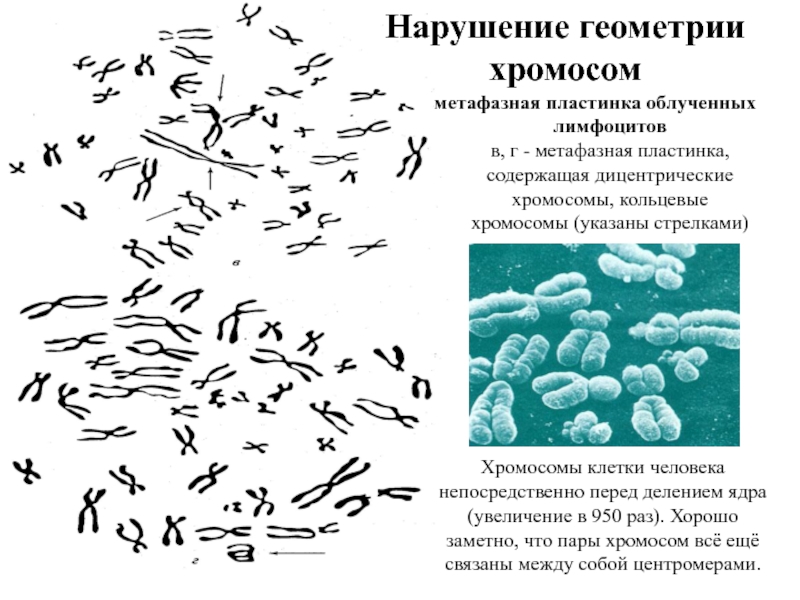
Слайд 35Нарушение геометрии хромосом
метафазная пластинка облученных лимфоцитов
в, г - метафазная пластинка, содержащая
Хромосомы клетки человека непосредственно перед делением ядра (увеличение в 950 раз). Хорошо заметно, что пары хромосом всё ещё связаны между собой центромерами.
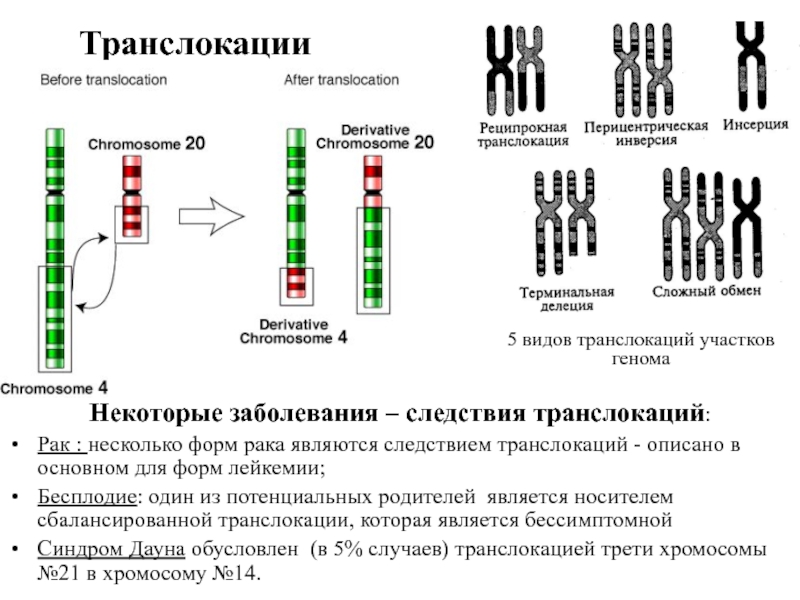
Слайд 36Транслокации
Некоторые заболевания – следствия транслокаций:
Рак : несколько форм рака являются следствием
Бесплодие: один из потенциальных родителей является носителем сбалансированной транслокации, которая является бессимптомной
Синдром Дауна обусловлен (в 5% случаев) транслокацией трети хромосомы №21 в хромосому №14.
5 видов транслокаций участков генома
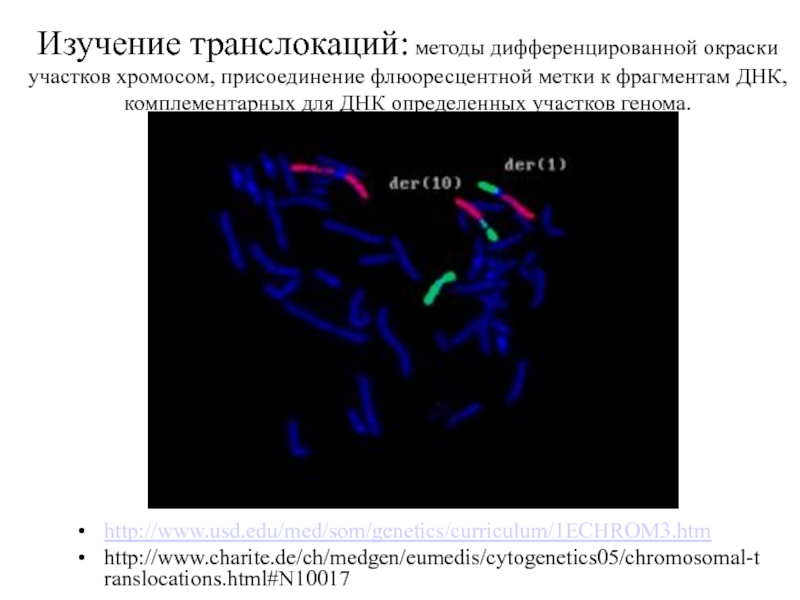
Слайд 37Изучение транслокаций: методы дифференцированной окраски участков хромосом, присоединение флюоресцентной метки к
http://www.usd.edu/med/som/genetics/curriculum/1ECHROM3.htm
http://www.charite.de/ch/medgen/eumedis/cytogenetics05/chromosomal-translocations.html#N10017
Слайд 38Стабильность аберраций
Нестабильные аберрации – ацентрические фрагменты и дицентрики - ведут к
Стабильные аберрации – перемещение участков пораженных хромосом (транслокации), с сохранением центромеры (могут сохраняться в организме в течение нескольких поколений)
Слайд 39Аберрации коррелируют с поглощенной дозой и используются для целей дозиметрии (подробно
Аберрации лимфоцитов периферической крови используют для оценки поглощенной дозы
При смертельной для человека дозе редкоионизирующих излучений (4,5-5 Гр) на каждый лимфоцит приходится одна аберрация
Слайд 40Радиационно-индуцированная нестабильность генома
Часть клеток, выживших после облучения, может давать функционально измененное
В отличие от перманентной геномной нестабильности, приводящей к некоторым наследственным болезням, радиационно-индуцированная нестабильность генома имеет ряд особенностей:
не определяется возникновением стойких нарушений в первичной структуре ДНК;
не определяется копированием в клеточном потомстве радиационных повреждений ДНК родительских клеток,
не имеет клонального характера;
может возникать в клетках, не подвергавшихся облучению (эффект свидетеля);
Нестабильность может проявляться в отдаленные сроки после облучения (иногда через сотни циклов деления).
Слайд 41Нестабильность генома:
Сохранение НГ на протяжении десятков поколений клеток животных было впервые
В 1970-80 е гг. отечественными учеными было показано, что НГ может проявляться и у потомков клеток, облученных в малых дозах;
НГ проявляется как после действия плотноионизирующего, так и редкоионизирующего излучения
У многоклеточных организмов НГ проявляется в увеличении числа (частоты) соматических мутантных клеток
Слайд 42Механизм индукции и поддержания генетической нестабильности мало изучены:
В развитии генетической нестабильности
увеличение поражения ДНК и снижение эффективности репарации - нарушение системы контроля клеточного цикла (экспериментальное подтверждение: возрастание генетической нестабильности в потомстве клеток, облученных в присутствии усилителя радиационных поражений ДНК)
Измененный клеточный метаболизм (?)– не ясно как передается (поиск факторов передачи) - эксперименты по облучению цитоплазмы и ядер - реактивные продукты кислорода
(усиление продукции активных форм кислорода, что приводит к увеличению оксидативных повреждний в молекулах ДНК и, как следствие, к увеличению количества мутаций)
Слайд 43Примеры: эксперименты по облучению
цитоплазмы и ядер:
облучение участков цитоплазмы ускоренными ядрами
При облучении ядра в такой же дозе образование микроядер в трех первых поколениях было более частым, чем при облучении цитоплазмы. Через несколько поколений эффект исчезал.
Роль реактивных продуктов кислорода в увеличении числа мутаций (наблюдалось увеличение числа мутаций после облучения цитоплазмы. При введении перехватчиков радикалов и угнетении синтеза глутатиона (мощный антиоксидант!) число мутаций снижалось
Слайд 44Результаты экспериментов и выводы
Облучение цитоплазмы приводит к учащению точковых мутаций (характерных
Локальное облучение ядра – к учащению хромосомных перестроек
У мутантных клеток в нескольких десятках поколений сохраняется высокое содержание количества высокореакционных продуктов кислорода.
Изменение метаболизма коррелировало с повышенной некротической и апоптотической гибелью
Выводы
Длительная нестабильность генома после облучения обусловлена:
непосредственным поражением генома самим излучением;
дополнительным поражением продуктами измененного клеточного метаболизма.
Слайд 45«Генетическая нестабильность обусловлена длительно сохраняющимся изменением функционирования клетки как целого, передаваемым
Повышенный уровень мутаций
Повышенная частота хромосомных перестроек
Сохраняется в течение 10-30 и более генераций
Радиационно-индуцированная нестабильность генома возникает после облучения в широком диапазоне доз, включая малые (<20 сГр), особенно при воздействии плотноионизирующих излучений